HPLC测定清心安眠颗粒中五味子醇甲、五味子甲素和五味子乙素的含量
闫 冬田 原陈 雪翟延君
1.辽宁中医药大学,辽宁 大连 116600;2.辽宁中医药大学附属医院,辽宁 沈阳 110032
HPLC测定清心安眠颗粒中五味子醇甲、五味子甲素和五味子乙素的含量
闫 冬1田 原2陈 雪1翟延君1
1.辽宁中医药大学,辽宁 大连 116600;2.辽宁中医药大学附属医院,辽宁 沈阳 110032
目的:建立HPLC法测定清心安眠颗粒中五味子醇甲、五味子甲素和五味子乙素的含量。方法:采用Agilent TC-C18色谱柱(250 mm×4.6 mm,5μm);流动相:甲醇-水(65∶35);检测波长:254 nm;流速:1 mL/min;柱温:30℃。结果:五味子醇甲、五味子甲素和五味子乙素分别在0.62~3.1μg(r=1)、3.8~19μg(r=1)、1.98~9.9μg(r=0.9997)范围内线性关系良好。平均加样回收率:五味子醇甲为99.88%,RSD为1.45%(n=6);五味子甲素为102.08%,RSD为2.25%(n=6);五味子乙素为101.53%,RSD为0.76% (n=6)。结论:本法操作简单、快速、重现性好,可用于清心安眠颗粒的质量控制。
高效液相色谱法;清心安眠颗粒;五味子醇甲;五味子甲素;五味子乙素
清心安眠颗粒是在辽宁中医药大学附属医院著名老中医彭静山教授的临床经验方的基础上经田维柱教授加减化裁改进而成的有效方剂。由五味子,枸杞,酸枣仁和百合组成,具有清心除烦,安神定志的功效。为了有效地控制该颗粒的质量,保证临床用药的疗效稳定、安全可靠,采用高效液相色谱测定清心安眠颗粒中五味子醇甲、五味子甲素和五味子乙素的含量。该方法灵敏度高,操作简便、快速,结果准确可靠,专属性强,重现性好,可用于清心安眠颗粒的质量控制。
1 仪器与试药
1.1 仪器 Agilent1100高效液相色谱仪(G1379A真空脱气机,G1313A自动进样器,G1315A柱恒温箱,G1311A四元梯度泵,G1315B二极管阵列检测器,Agilent B.04.03化学工作站);HN101-3A型电热鼓风干燥箱;AE-240电子分析天平;DK-98-1型电热恒温水浴箱。
1.2 试药 五味子、酸枣仁药材 (均购自河北安国,由辽宁中医药大学翟延君教授鉴定)五味子醇甲对照品 (批号:110857-200507)、五味子甲素(批号:0764-200107)、五味子乙素(批号:110765200306)均由中国药品生物制品检定所提供;水为娃哈哈纯净水,甲醇为色谱纯,其余试剂为分析纯。
2 方法与结果
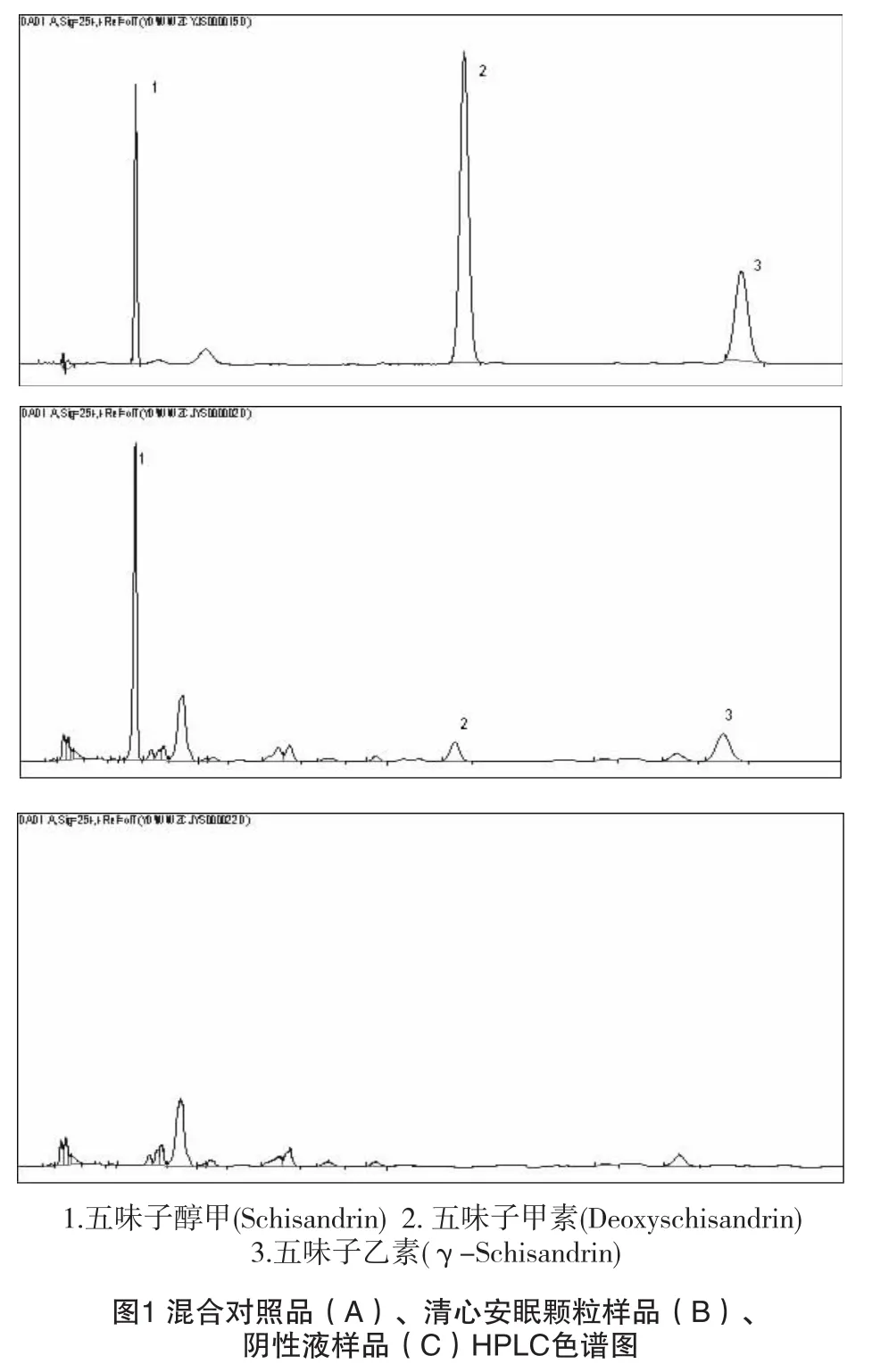
2.1 色谱条件 Agilent TC-C18色谱柱(250 mm×4.6 mm,5μm);流动相:甲醇-水(65:35);检测波长:254 nm;流速:1 mL/min;柱温:30℃。在此条件下,供试品中五味子醇甲、五味子甲素和五味子乙素与其他组分峰均能达到基线分离,保留时间分别为五味子醇甲约为7.7min;五味子甲素约为29.1min;五味子乙素约为47.8min,理论板数按中五味子醇甲、五味子甲素和五味子乙素峰计均不低于2000;分离度均大于2。符合中国药典2010年版一部附录系统适用性试验要求。
2.2 样品制备
2.2.1 阴性对照试验 取处方量以相同工艺制备的阴性对照 (无五味子),按上述方法测定,结果为:阴性对照色谱图中在与五味子醇甲、五味子甲素和五味子乙素对照品色谱图相应的保留时间处无吸收即色谱峰的出现,结果表明阴性对照 (含百合、枸杞子、酸枣仁)用相同制备方法下提取的成分在测定波长处无吸收,故其五味子醇甲、五味子甲素和五味子乙素成分测定无干扰。
2.2.2 对照品溶液的制备 取五味子醇甲对照品、五味子甲素对照品、五味子乙素对照品适量,精密称定,分别加甲醇制成每1mL含0.31mg的溶液、每1mL含1.9mg的溶
液、每1mL含0.99mg的溶液,混合即得。
2.2.3 供试品溶液的制备[1]取颗粒剂3g,精密称定,加甲醇50m L,精密称定,超声提取30min,再精密称定,用甲醇补足失重,摇匀,滤过,取续滤液,即得。分别精密吸取对照品溶液5μL与供试品溶液10μL,注入高效液相色谱仪,测定,即得。对照品、供试品、阴性液色谱见图1。
2.3 方法学考察
2.3.1 线性关系考察 精密吸取混合对照品溶液2.0、4.0、6.0、8.0、10.0μL,注入液相色谱仪中,按上述色谱条件测定五味子醇甲、五味子甲素和五味子乙素色谱峰面积,以进样量X(μg)与峰面积Y,得回归方程为:五味子醇甲Y=1209X+23.35,r=1;五味子甲素Y=380.46X-2.27,r=1;五味子乙素Y=173.53X-2.9,r=0.9997;且五味子醇甲在0.62~3.1μg,五味子甲素在3.8~19μg,五味子乙素在1.98~9.9μg范围内线性关系良好。2.3.2 精密度试验 分别取上述对照品溶液,重复进样6次,测定五味子醇甲RSD为0.112%;五味子甲素为0.94%;五味子乙素为0.64%。
2.3.3 稳定性试验 取上述供试品溶液,分别在0、2、4、6、8h进样,测定五味子醇甲RSD为0.48%;五味子甲素1.93%;五味子乙素1.59%,表明样品在8小时内稳定。
2.3.4 重复性试验 取供试品6份,每份约3g,按“2.2.3”项下方法制备,进样测定五味子醇甲平均含量为1.077mg/g、RSD为1.87%(n=6)、五味子甲素平均含量为0.178mg/g、RSD=2.27%(n=6)、五味子乙素平均含量为0.374mg/g、RSD=2.16%(n=6)。
2.3.5 加样回收试验 分别取已知含量供试品(五味子醇甲平均含量为0.538mg/g、五味子甲素平均含量为0.089mg/g、五味子乙素平均含量为0.187mg/g),加入定量的五味子醇甲、五味子甲素、五味子乙素对照品溶液,按 “2.1”项下的方法测定,计算其五味子醇甲回收率为9.88%,RSD为1.45%(n=6)、五味子甲素回收率为102.08%,RSD=2.25%(n=6),五味子乙素为101.53%,RSD=0.76%(n=6)结果如表(1)。

表1 五味子醇甲、五味子甲素和五味子乙素加样回收率
2.4 样品测定 分别吸取对照品和3批供试品溶液,按 “2.1”项下的方法测定供试品中五味子醇甲、五味子甲素和五味子乙素的含量,其结果 (n=3)如表2。

表2 样品的含量测定
3 讨论
3.1 提取方法的选择 比较张彦东等[2]用氯仿萃取法和李正国等[3]用甲醇超声的提取方法,结果证明后者提取较完全,且方法简单易行,所以选择甲醇超声提取法。
3.2 流动相的选择 比较并参考乙腈-甲醇-水(15∶15∶10)[4]、甲醇-水 (85:15)[5]、甲醇-水(75:25)[10]等方法及摸索试验,最终确定以甲醇-水 (65:35)为流动相可以使清心安眠颗粒中五味子三种成分实现较好分离。
3.3 检测波长的选择 曾试验220nm[4]、224nm[10]、245nm[5]和254nm[9、11]等检测波长,结果显示220nm和224nm处吸收较大,但是容易拖尾,比较245nm和254nm,后者更为稳定且常用,参考文献[2-12],故选择254nm为检测波长。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:344.
[2]张彦东,余少婷,王丽菊.HPLC测定五味子糖浆中五味子甲素的含量[J],中药材,2005,28(8):727-728.
[3]李正国,于立佐,障碍岑.RP-HPLC测定降酶灵胶囊中五味子醇甲、五味子甲素和五味子乙素的含量[J].中成药,2004,8(26):618-621.
[4]崔兰贵,王火,朱铁粱等.HPLC法测定更年安片中五昧子甲素和五昧子乙素的含量[J],中草药,2001,32(5):409-411.
[5]李瑞珍,廖华卫,陈飞苑.RP-HPLC测定丹参五味子片中丹参酮ⅡA和五味子甲素的含量[J].中药材,2007,30(6):732-733.
[6]倪琳,杨锡.HPLC法同时测定生脉饮中五味子醇甲、五味子甲素和五味子乙素正交试验法优选安神颗粒的醇提工艺 [J].中成药,2012,34(5):872-875.
[7]杨人泽,钟美兴,严金玲.正交试验法优选安神颗粒的醇提工艺 [J].中国实验方剂学杂志,2011,17(19):41-44.
[8]吕邵娃,管庆霞,李永吉.HPLC测定利肝隆片中五味子甲素和五味子乙素含量[J].中成药,2006,28(5):662-664.
[9]侯冬岩,回瑞华,李铁纯,等.辽五味子的研究进展 [J].鞍山师范学院学报,2007,9(6):14-17.
[10]禹琦.正交试验法优选枣仁安神胶囊提取工艺 [J].中国医药导报,2011,5(8):47-48.
[11]宋九华,杨孝容,张成志.HPLC测定安神补心丸中的五味子醇甲、五味子酯甲、五味子甲素、五味子乙素和丹参酮ⅡA[J].华西药学杂志,2008,23(1):110-112.
[12]杜英峰,袁志芳,张兰桐等.RP-HPLC法测定五味子及维肝福泰片中五味子甲素和五味子乙素的含量[J].中草药,2004,35(5):519-521.
Determination of Schisandrin、Deoxyschisandrin andγ-Schisandrin Qingxinanmian granules by RP-HPLC
YAN Dong1,TIAN Yuan2,Chen Xue1,ZHAI Yan-jun1
1.Liaoning University of Traditional Chinese Medicine,Dalian116600,China;2.Affiliated Hospital of Liaoning University o f Traditional Chinese Medicine,Shenyang 110032,China
Objective:To setup a determination of Schisandrin,Deoxyschisandrin andγ-Schisandrin in qingxinanmian granules by HPLC.M ethod:These components were separated through Agilent TC-C18(250 mm×4.6mm,5μm)column with methanol water(65:35)by volume as a mobile phase.The flow rate was 1m l/min,and the detection wavelength was 254nm,and temprature was 30℃.Results:The linear range of Schisandrin,Deoxyschisandrin andγ-Schisandrin were 0.62~3.1μg,3.8~19μg and 1.98~9.9μg,respectively.The average recovery was 99.88%with RSD 1.45%(n=6)for Schisandrin,102.08%with RSD 2.25%(n=6)for Deoxyschisandrin and 101.53%with RSD 0.76%(n=6)forγ-Schisandrin respectively.Conclusion:The method is simple,quick and rapid with good reproducibility.It can be used for the quality control of qingxinanmian granules.
HPLC;Qingxinanmian granules;Schisandrin;Deoxyschisandrin;γ-Schisandrin
R286
A
1007-8517(2013)12-0022-03
2013.04.17)
闫冬(1987-)、女(汉族)、硕士研究生、研究方向:中药质量评价研究。Tel:13079235441 E-mail:yandong871111@163.com
翟延君Tel:13019499386 E-mail:lnzyzyj@sohu.com

