表皮干细胞抽提物重编程脂肪干细胞表达表皮细胞表型的实验研究
孙 楠 张 群
表皮干细胞抽提物重编程脂肪干细胞表达表皮细胞表型的实验研究
孙 楠 张 群
目的研究富集的表皮干细胞(Keratinocytes enriched with epidermal stem cells,KSC)抽提物对重编程人脂肪干细胞(Adipose derived stem cells,ASCs)表达表皮细胞表型的影响。方法常规方法收集表皮细胞(Keratinocytes,KC)后,应用Ⅳ型胶原差速贴壁法分别收集KSC与富集后剩余的表皮细胞(Keratinocytes enriched with epidermal stem cells left,KCL),鉴定K19和P63的阳性表达率,Gimsa染色法测定KC、KSC、KCL的克隆形成率,分别制备KC、KSC、KCL的细胞抽提物,作用于链球菌溶血素-O(SLO)通透处理过的原代ASCs,分别应用流式细胞仪与Western-blot测定重编程后ASCs中广谱角蛋白(Pan cytokeratin,P-CK)与ASCs的BRG1表达变化。结果KSC与KC、KCL来源的细胞抽提物重编程ASCs的CK及BRG1表达率,均有明显统计学差异(P<0.01)。结论脂肪干细胞在表皮细胞抽提物的诱导作用下能表达表皮细胞表型,且对表皮细胞优化处理后的KSC有更加显著的重编程作用。
表皮干细胞脂肪干细胞重编程细胞抽提物
细胞重编程技术是近年来研究的热点,重编程能使细胞表型转化为目的细胞表型[1],细胞抽提物重编程的优势在于制备获取过程简单,重复性好[2]。自体脂肪组织作为活性移植物在外科组织重建与美容修复等方面应用广泛[3],而脂肪干细胞在特定的条件下具有多向分化潜能和自我增殖的特性,来源丰富、取材容易、创伤小。使用脂肪干细胞作为种子细胞,通过细胞重编程的方法诱导其表达表皮细胞表型,可以解决临床供体细胞不足的问题,如大面积皮肤缺损导致供皮区不足。目前,关于表皮细胞抽提物重编程脂肪干细胞的相关研究较少,因此,我们拟对来源于表皮干细胞的抽提物对脂肪干细胞重编程效果进行研究。
1 材料与方法
1.1 材料
DMEM培养基(Gibco公司,美国),胰蛋白酶(Gibco公司,美国),胎牛血清(FBS,Hyclone公司,美国),胶原酶NB4(Serva公司,德国),细胞裂解液(Sigma公司,美国),溶血链球菌素(Streptolysin,SLO;Sigma公司,美国),细胞乳化超声破碎仪(上海比朗仪器有限公司,中国),ATP生成体系(Sigma公司,美国),GIS22800型凝胶图像处理系统(上海天能科技公司)。流式直标抗体:FITC-广谱角蛋白抗体(Pan cytokeratin antibody,Anti-P-CK),FITC-角蛋白19(FITC-Cytokeratin19,CK19),PE-P63小鼠单克隆抗体(Santa Cruz公司)。
1.2 实验方法
1.2.1 表皮干细胞的分离培养
取皮肤组织(来源我科上睑或下睑手术切除的健康皮肤,供者年龄为30~46岁,获患者知情同意),先用D-Hank's液洗2次,浸入含青霉素、链霉素的平衡盐溶液30 min,无菌条件下彻底清洗,去除皮下组织及部分真皮,将皮肤剪切成约0.5 cm宽的皮条,0.5%DispaseⅡ消化,4℃过夜;吸弃上清,分离表皮和真皮层,将表皮剪碎,加0.25%胰蛋白酶消化,37℃、5%CO2条件下孵育15 min,用含血清培养基终止消化,过150目不锈钢滤网筛,收集滤液,1 000 r/min离心5 min;弃上清,用人表皮干细胞培养基重新悬浮细胞(KC),吹打成单细胞悬液,锥虫蓝染色,以2.0×106cells/mL接种于预先铺有人胎盘Ⅳ型胶原的培养瓶内,37℃5%的CO2培养箱中孵育15 min后,吸出培养液及未贴壁细胞(KCL),用未加血清的培养基洗2次,留在培养皿内的细胞(KSC)加入KSFM表皮干细胞培养基,隔天半量换液,以后2~3 d换液1次,光镜下观察细胞生长情况。
留在培养瓶内的细胞为富集的表皮干细胞(KSC),吸出的未贴壁细胞为富集后剩余表皮细胞(KCL),未分选的表皮细胞为常规方法收集的表皮细胞(KC)。
1.2.2 脂肪干细胞的分离培养
无菌条件下取脂肪抽吸术后的腹部脂肪组织,用磷酸盐缓冲液(PBS)冲洗3次,以除去红细胞和细胞碎片。清洗后加入等体积0.1%的Ⅱ型胶原酶,37℃恒温摇床消化2 h后,1 500 r/min离心5 min,弃去上清液和漂浮的脂肪细胞,获得高密度的细胞沉淀物。用含有10%胎牛血清(FBS)、1%双抗(青霉素penicillin,链霉素streptomycin)的DMEM培养液重悬后,以1×106cells/cm2的细胞密度接种于10 cm培养皿内。本实验所用ADSCs为培养的原代细胞。
1.2.3 流式细胞仪检测
收集待测细胞悬液,1 000 r/min离心5 min;弃上清,1%多聚甲醛室温固定30 min,用10%FCS DMEM调整细胞浓度为5×106~1×107cells/mL,取200 μL细胞悬液加入离心管,行细胞角蛋白19 (K19)(1:50)和P63(1:100)流式细胞仪分析,记录观察数据。
1.2.4 克隆形成率测定
将培养的KSC、KC和KCL分别分散成单细胞悬液,按200个/孔接种到培养板中继续培养。2周后Gimsa染色,显微镜下观察。进行细胞克隆计数,并计算克隆形成率(克隆形成率(%)=细胞克隆数/接种细胞数×100%)。
1.2.5 表皮细胞抽提物制备
收集到的表皮细胞用PBS清洗2次后离心,弃上清后加入预冷的细胞裂解液。细胞悬液用脉冲超声匀浆化,直至光镜下观察不到细胞结构。4℃15 000 r/min离心15 min,提取上层蛋白质溶液,分装于冻存管中,迅速于液氮中冷冻1 min,放入-80℃冰箱中保存备用。
1.2.6 抽提物加入链球菌溶血素O渗透处理ASCs
取原代培养的ASCs,于冰冷的PBS中洗涤2遍后,分装于1.5 mL的EP管中,4℃下1 500 r/min离心5 min,弃去上清液,加入浓度为230 ng/mL的SLO溶液。每100 μL SLO溶液中平均1×105个细胞。将细胞置于37℃水浴中50 min,每隔15 min重悬1次。50 min后,离心收集细胞。每1×105个细胞加入100 μL抽提液和ATP生成体系(1 mmolATP,10 mmol磷酸肌酸,25 μg/mL肌酸激酶及ATP、CTP、GTP、UTP各1 mmol/L),37℃水浴箱中孵育1 h,每20 min重悬1次。此过程中,抽提液中成分进入ASCs内。孵育结束后,加入含10%FBS的DMEM(含有2 mmol的CaCl2),放置于37℃水浴中2 h,以封闭胞膜孔道。离心后加入表皮培养液混匀,接种于培养皿上。24 h换液,以后每3天换液1次。
1.2.7 Western-blot方法检测
取KSC、KC和KCL抽提物重编程的ASCs,RI-PA裂解液裂解细胞,BCA法进行蛋白质浓度测定,取20 μg等量蛋白质进行聚丙烯酰胺凝胶电泳(SDS-PAGE),免疫印迹法检测BRG1蛋白表达变化。1.2.8统计学分析
采用SPSS 16.0软件进行数据分析,数据以均数±标准差表示,组间采用单因素方差分析。
2 结果
2.1 被分选的KSC、KC和KCL细胞的CFE观察(Gimsa染色)
KSC的克隆形成团块多于KC和KCL(图1),显微镜下观察计数,计算细胞克隆形成率(图2)。KSC、KC和KCL的CFE分别为:30.08%±4.29%;5.12%±3.03%;0.78%±0.66%(P<0.01)。

图1 KSC、KC和KCL细胞克隆形成情况大体观察Fig.1The observation of clone forming of KSC,KC and KCL

图2 KSC、KC和KCL的克隆形成率Fig.2Cloning forming efficiency of KSC,KC,and KCL
2.2 被分选的KSC、KC和KCL细胞表型流式鉴定
流式细胞检测发现(图3),KSC、KC和KCL中K19+细胞表达率分别为93.28%±3.11%、23.12%± 3.82%和7.83%±2.29%(P<0.01);KSC、KC和KCL中P63+细胞表达率分别为90.67%±5.52%、18.87%± 2.21%和3.01%±1.07%(P<0.01)。
2.3 三组表皮细胞抽提物重编程ASCs的CK表达的流式鉴定
经过KSC、KC和KCL抽提物诱导后,CK在ASCs中的表达量分别为13.31%±4.29%、5.66%±3.11%和0.89%±0.19%(图4)。
2.4 三组表皮细胞抽提物重编程ASCs的BRG1表达
非溶解型BRG1在KSC,、KC和KCL中的蛋白质表达强度分别为1.83%±0.27%、0.76%±0.14%和0.07%±0.05%。可见重编程效应在KSC抽提物诱导组最强(图5)。

图3 流式细胞仪检测被分选的KSC、KC和KCL的K19、P63的表达Fig.3K19 and P63 expression of KSC,KC,and KCL detected by flow cytometry

图4 流式细胞仪检测三组来源的细胞抽提物重编程的ASCs的广谱角蛋白抗体-FITC的表达Fig.4The expression of cytokeratin(CK)changes of ASCs reprogrammed by different keratinocyte extracts
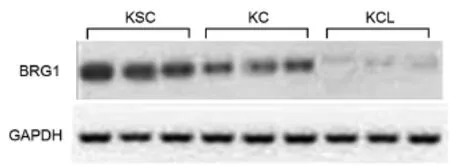
图5 三组表皮细胞抽提物作用下ASCs中BRG1的表达Fig.5The expression of BRG1 of ASCs reprogrammed by cell extracts of KSC,KC,and KCL
3 讨论
细胞抽提物介导的重编程是体细胞重编程的一种方法,不同于经典的核移植或细胞融合[4-7]的重编程方法。细胞抽提物重编程的目的,是使已经分化的体细胞转分化为另一种细胞类型,或者去分化为多能干细胞状态[1,8]。已经有许多文献显示,细胞抽提物重编程模式被证实是一种有效模式[9-12]。实验中所制备的细胞抽提物的成分为细胞质和细胞核的可溶解部分,不包括染色质[13]。目前,细胞抽提物诱导重编程后的细胞与目的细胞仅形态上相近,或者具有相似的细胞表型及功能,并不能确定必然完全分化至同种细胞。细胞抽提物重编程的机制尚不明确,可能与目的基因启动子的组蛋白H3、H4乙酰化(或甲基化)和DNA甲基化有关,引起决定细胞特性的基因转录上调、活化或下调[8],从而改变受体细胞形态。
在成人的表皮基底层中存在大量干细胞(KSC),部分有丝分裂为子代细胞,还有部分以短暂扩增细胞(TA)形式存在,共同参与角质化过程。表皮干细胞具有慢周期性和巨大的增殖潜能[14]。人体正常皮肤中的KSC相对静止,主要功能是分裂增殖维持表皮的自然更替;皮肤组织损伤时愈合创面[15]。KSC在体外培养的条件下仍能保持干细胞特性,即自我更新和增殖分化潜能;而普通的表皮细胞离开体内环境后不可避免得发生终末分化[16]。因此,体外培养研究中,表皮干细胞相对普通表皮细胞有更大的优势,将表皮干细胞分选出来可能成为优化实验条件的因素。
用细胞外基质成分Ⅳ型胶原分选表皮干细胞。14 d观察到KSC组细胞贴壁聚集成团较为明显,而KC组和KCL组的细胞数目明显少于KSC组(P<0.01),换液后染色,可见KSC组细胞克隆形成明显,细胞伸展良好,密度适中;KC组细胞较分散,聚集成团较少;KCL组少量细胞贴壁,几乎没有克隆形成。说明富集方法收集的表皮干细胞(KSC)的分裂增殖能力最强,分选后剩余细胞(KCL)的增殖能力差,未分选的表皮细胞(KC)介于两者之间,具有一定的体外增殖能力。
K19起初被认为在毛囊的隆起区域特定表达。近年来发现,在人毛囊的隆起区域的最外层根鞘和邻近区域也有表达,是决定细胞向表皮细胞表型分化的重要表面标志分子[17,19]。核转录因子P63是肿瘤抑制基因P53的同族产物,对表皮组织的发育、分化、形态发生具有重要作用,主要在表皮干细胞、TA细胞、基底层或接近基底层的表皮细胞或毛囊细胞中高表达,终末分化的表皮细胞中的表达量低[18-19]。KSC、KC和KCL均有K19和P63表达,其中KSC的K19和P63的阳性细胞表达率最高。
广谱角蛋白抗体是上皮细胞特异性抗体,免疫荧光染色后,流式细胞仪检测三组重编程后的ASCs。KSC组诱导的ASCs的CK表达率最高,说明该组细胞抽提物重编程后的ASCs的表皮细胞化最明显。
BRG1是细胞重编程过程中的关键物质。人类BRG1基因定位于染色体19p上,BRG1基因组共由35个外显子和34个内含子构成,基因编码的蛋白质相对分子量为205 KD[20]。文献报道,BRG1参与转录的多个环节,如识别被修饰的DNA结合蛋白,作为SWI/SNF复合体的核心酶成分介导招募染色质结构重塑、参与转录激活、转录抑制和基因沉默[21]。SWI/SNF复合体能够使DNA从核小体部分解离,并使八聚体移动和改变核小体结构,但该复合体如何靶向特异性促进之而产生转录活化因子的机制暂时还不清楚[22]。Bultman等[23]发现,哺乳动物的染色质结构重塑对于合子基因组活化中重编程基因的表达有至关重要的作用。本实验中,收集3组细胞抽提物诱导作用下的重编程脂肪干细胞,通过Western-Blot的方法,检测各组BRG1蛋白的表达量,KSC组的BRG1的表达量最多,提示KSC抽提物的重编程效应最强。
综上所述,细胞抽提物重编程由于能改变已经分化的细胞的命运,使其重回多能干细胞状态或者转分化为另一种细胞类型,为组织工程学研究提供了新的方法。但细胞抽提物重编程还有许多基础问题没有解决,比如重编程的具体机制,重编程效率低等。在现有的研究条件下,抽提物介导的重编程效应短暂且不稳定[24]。重编程后对受体细胞的基因转录调控的持续时间,以及表达新表型的稳定性的问题是未来研究的热点。尽管和胚胎干细胞(ESCs)以及多能干细胞(iPSCs)相比,ASCs作为一种成体干细胞的分化潜能有所限制[25],但是ASCs由于易获取、具备多向分化潜能、增殖能力强的优点,已经成为临床应用和实验研究中的热点,以ASCs为基础的干细胞研究将为今后解决临床实际问题带来新办法。表皮干细胞相对普通表皮细胞有强大的增殖分化能力,通过Ⅳ型胶原差速贴壁法能够稳定有效地分离出表皮干细胞[26]。实验表明,表皮细胞抽提物能诱导脂肪干细胞向表皮细胞表型分化,而富集方法收集的表皮干细胞抽提物的重编程效应较对照组有显著差异,这可能和表皮干细胞抽提物内的某些物质加速了重编程的进程有关,具体机制有待进一步探明。
[1]Collas P,Taranger CK.Epigenetic reprogramming of nuclei using cell extracts[J].Stem Cell Rev,2006,2(4):309-317.
[2]刘辉,黎江,刘新垣,等.细胞提取物介导的体细胞重编程[J].细胞生物学杂志,2008年05期.
[3]Aguena M,Fanganiello RD,Tissiani LA,et al.Optimization of parameters for a more efficient use of adipose-derived stem cells in regenerative medicine therapies[J].Stem Cells Int.2012;2012: 303610.
[4]Gurdon JB,Byrne JA.The first half-century of nuclear transplantation[J].Proc Natl Acad Sci USA,2003,100(14):8048-8052. [5]Wakayama T,Perry AC,Zuccotti M,et al.Full-term developmentof mice from enucleated oocytes injected with cumulus cell nuclei[J].Nature,1998,394(6691):369-374.
[6]Tada M,Takahama Y,Abe K,et al.Nuclear reprogramming of somatic cells by in vitro hybridization with ES cells[J].Curr Biol, 2001,11(19):1553-1558.
[7]Do JT,Han DW,Scholer HR.Reprogramming somatic gene activity by fusion with pluripotent cells[J].Stem Cell Rev,2006,2 (4):257-264.
[8]Collas P,Taranger CK.Epigenetic reprogramming of nuclei using cell extracts[J].Stem Cell Rev,2006,2(4):309-317.
[9]Hakelien AM,Landsverk HB,Robl JM,et al.Reprogramming fibroblasts to express T-cell functions using cell extracts[J].Nat Biotechnol,2002,20(5):460-466.
[10]Gaustad KG,Boquest AC,Anderson BE,et al.Differentiation of human adipose tissue stem cells using extracts of rat cardiomyocytes[J].Biochem Biophys Res Commun,2004,314(2):420-427.
[11]Hakelien AM,Gaustad KG,Collas P.Transient alteration of cell fate using a nuclear and cytoplasmic extract of an insulinoma cell line[J].Biochem Biophys Res Commun,2004,316(3):834-841.
[12]Rajasingh J,Lambers E,Hamada H,et al.Cell-free embryonic stem cell extract-mediated derivation of multipotent stem cells from NIH3T3 fibroblasts for functional and anatomical ischemic tissue repair[J].Circ Res,2008,102(11):e107-117.
[13]唐新杰,谢峰,宋楠,等.人表皮细胞抽提物重编程脂肪干细胞的实验研究[J].组织工程与重建外科,2011,7(3):129-132.
[14]揭彬,罗向东,伍素华,等.皮肤组织工程中人表皮干细胞的体外培养及分化特性研究[J].中国临床康复,2004,8(2):220-222.
[15]Watt FM,Jensen KB.Epidermal stem cell diversity and quiescence [J].EMBO Mol Med,2009,1(5):260-267.
[16]Watt FM.Stem cell fate and patterning in mammalian epidermis变化,必要时行血管探查挽救移植的组织瓣[6]。
参考文献
[1]Gopal S,Majumder S,Batchelor AG,et al.Fix and flap:the radical orthopaedic and plastic treatment of severe open fractures of the tibia[J].J Bone Joint Surg Br,2000,82(7):959-966.
[2]裘华德.负压封闭引流技术[M].北京:人民卫生出版社,2003:23-83.
[3]Weed T,Ratliff C,Drake DB.Quantifying bacterial bioburden during negative pressure wound therapy:Does the wound VAC enhance bacterial clearance clearance[J]?Ann Plast Surg, 2004,52(3):276-279.
[4]李靖,陈绍宗,李学拥.等.封闭负压引流对创面微循环超微结构影响的实验研究[J].中国实用美容整形外科杂志,2006,17(1): 75-77.
[5]陈绍宗,曹大勇,李金清,等.封闭负压引流技术对创面愈合过程中原癌基因表达的影响[J].中华整形外科杂志,2005,21(3):197-200.
[6]杨运发,徐中和,侯之启,等.监测皮岛在多种深部移植组织瓣血供监测中的应用[J].中国修复重建外科杂志,2006,20(10):1059-1060.[J].Curr Opin Genet Dev.2001 Aug;11(4):410-7.
[17]Lyle S,Christofidou-Solomidou M,Liu Y,et al.Human hair follicle bulge cells are biochemically distinct and possess an epithelial stem cell phenotype[J].J Investig Dermatol Symp Proc,1999,4(3): 296-301.
[18]Reis-Filho JS,Torio B,Albergaria A,et al.p63expressionin normal skin and usual cutaneous carcinomas[J].J Cutan Pathol, 2002,29(9):517-523.
[19]Abbas O,Richards JE,Yaar R,et al.Stem cell markers(cytokeratin 15,cytokeratin 19 and p63)in in situ and invasive cutaneous epithelial lesions[J].Mod Pathol,2011,24(1):90-97.
[20]Trotter KW,Archer TK.The BRG1 transcriptional coregulator[J]. Nucl Recept Signal,2008,6:e004.
[21]屈悦,邓辰亮,郑江红,等.Brg1在细胞重编程中作用的研究进展[J].组织工程与重建外科,2011,7(6):344-347.
[22]Peterson CL,Workman JL.Promoter targeting and chromatin remodeling by the SWI/SNF complex[J].Curr Opin Genet Dev, 2000,10(2):187-192.
[23]Bultman SJ,Gebuhr TC,Pan H,et al.Maternal BRG1 regulates zygotic genome activation in the mouse[J].Genes Dev,2006,20 (13):1744-54.
[24]Bru T,Clarke C,McGrew MJ,et al.Rapid induction of pluripotency genes after exposure of human somatic cells to mouse ES cell extracts[J].Exp Cell Res,2008,314(14):2634-2642.
[25]Mizuno H,Tobita M,Uysal AC.Concise review:Adipose-derived stem cells as a novel tool for future regenerative medicine[J]. Stem Cells,2012,30(5):804-810.
[26]刘虎仙,贾赤宇,付小兵,等.重复利用Ⅳ型胶原以差速贴壁法分选表皮干细胞[J].中国临床康复,2006,13:38-40.
(收稿日期:2013年3月6日;修回日期:2013年4月15日)
Research of Reprogramming of Adipose Derived Stem Cells to Express Keratinocyte Phenotype Using Cell Extracts of Keratinocyte Stem Cells
SUN Nan,ZHANG Qun.Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:ZHANG Qun(Email:qunzhang737@sina.com).
ObjectiveTo evaluate the role of the cell extracts of keratinocyte stem cells(Keratinocytes enriched with epidermal stem cells,KSC)express keratinocytes phenotype of reprogramming of the adipose derived stem cells(Adipose derived stem cells,ASCs).MethodsKeratinocytes(KC)were collected in conventional methods,then KSC were isolated from KC with differential attachment to recycled collagenⅣand KCL were gathered by not attached cells in suspension culture solution.Clone forming efficiency(CFE)of KC,KSC,KCL were detected with Gimsa staining methods.Cell extracts of KC,KSC and KCL were prepared respectively.Primary cultured adipose derived stem cells were permeabilized using streptolysin O(SLO),and then incubated with cell extracts.Flow cytometry and western-blot were used to detect the expression of pan cytokeratin(Pan cytokeratin,CK)and Brahma-related Gene 1(BRG1)of reprogrammed ASCs.ResultsCell extracts of KSC comparing with that of KC and KCL,had a statistically significant difference(P<0.01)in reprogramming of ASCs with high expression of CK and BRG1.ConclusionAdipose derived stem cells could be induced to express keratinocyte phenotype with cell extracts of keratinocytes,and optimized keratinocyte stem cells have superiority of reprogramming ability.
Keratinocyte stem cells;Adipose derived stem cell;Reprogramming;Cell extracts
Q813.1+1
A
1673-0364(2013)03-0129-05
2013年2月10日;
2013年3月5日)
200011上海市上海交通大学医学院附属第九人民医院整复外科。
张群(电子邮箱:qunzhang737@sina.com)。
10.3969/j.issn.1673-0364.2013.03.003

