犬细小病毒(CPV-2)的分子生物学特性与进化
贺 英,潘素敏,杨彩然,张艳英,史秋梅*,邵新华
(1河北科技师范学院河北省预防兽医重点实验室,河北秦皇岛,066600;2河北省栾城县新华科极兽药有限公司)
犬细小病毒病是犬的一种具有高度接触性的烈性传染病。临床特征以急性出血性肠炎和非化脓性心肌炎为特征。犬细小病毒(Canine Parvovirus,CPV-2)是引起该病的病原微生物,属细小病毒科细小病毒亚科细小病毒属自主复制的单链DNA病毒。包括两个抗原型和基因型不同的病毒CPV-1型(也称为犬细小病毒,minus virus of caine,MVC)和CPV-2型,能够引发严重临床症状的主要是CPV-2型。早在1967年,Binn等从犬分离到第一种犬细小病毒——犬微小病毒(Minute virus of canine,MVC),后命名为CPV-1型。1977年,美国学者Eugster和Nairn从患出血性肠炎的病犬粪便中首先观察到CPV;1978年,澳大利亚的Kelly和加拿大的Thomson等首次从病犬的粪便中分离得到该病毒。为了区别于CPV-1,该CPV被命名为CPV-2。
1 细小病毒的分子生物学特点
1.1 基因组的结构
犬细小病毒基因组为单链线状DNA,全部基因组包括末端是5 323 nt[1],目前仅报道一个全基因组序列。基因结构包括3'端非编码区,两个主要的开放读码框和5'端的非编码区和一个不知名的蛋白编码区。1~271 nt为3'端非编码区,272~2 278 nt编码非结构蛋白NS1和NS2,2 285~4 540 nt编码结构蛋白VP1和VP2,4 541~5 323 nt为5'端非编码区。CPV仅在3'端有末端重复序列,全长118 nt,其中92 nt形成茎结构,26 nt形成T结构;5'端存在一些正向重复序列,第一个重复序列开始于4 514~4 574 nt,而且越过终止密码(4 538),紧接着重复序列在4 574~4 636 nt,在4 593位有一个碱基的插入,在4 603位有一个C-T的逆转;另一个重复序列开始于4 701 nt,也是62 nt,共有3个拷贝,结束于4 886 nt。在最末端还有一个255个碱基的编码序列,该序列是衣壳蛋白编码序列4 289~4 543 nt的重复序列,具体功能未知。
1.2 基因组编码功能蛋白的研究进展
1.2.1 非结构蛋白(NS1和NS2) 病毒基因组3'端的第一个开放读码框编码病毒的两个非结构蛋白NS1和NS2,主要作用是控制病毒的复制和转录。
犬细小病毒NS1是由272~2 278位核苷酸编码的蛋白质,基因全长2 007 nt,由668个氨基酸残基组成。研究以鼠细小病毒为代表的自主细小病毒发现,NS1的主要功能是控制病毒复制和后代病毒粒子的产生[2,3]。具体包括:ATP结合、水解作用、同源寡聚化、对同源DNA识别基序的特异性结合、DNA解旋、位点特异的内切酶活性,启动子的反式调控和与一系列细胞蛋白的特殊作用[4,5],因而参与病毒繁殖的全部过程,包括病毒基因组的复制,调节同源和异源基因表达以引起细胞病变[6]。NS1的表达通过细胞毒性机制抑制细胞的各种功能[7]。NS1蛋白翻译后修饰作用如磷酸化可能对该蛋白的多种活性有影响,磷酸化的NS1能够启动病毒DNA的复制[3]。NS1 C端T585的突变对病毒基因组复制影响不明显,但可以降低病毒对细胞的毒性,而S588突变为A588却大大增加了病毒对细胞的杀伤力,NS1的后期磷酸化也影响病毒粒子的细胞毒性[2,7]。
NS2是由272~527位核苷酸和2 004~2 278核苷酸编码的蛋白质,基因全长531 nt,由176个氨基酸残基组成[8]。以磷酸化和非磷酸化两种形式存在于感染鼠细小病毒的细胞质中,在感染早期能够被检测到,但半寿期较短(90 min)。NS2参与病毒DNA复制,RNA翻译,病毒衣壳的形成和病毒粒子单链DNA的包装。也有人认为NS2对衣壳蛋白的组装和以宿主特异的方式翻译方面均起到重要作用,但对犬细小病毒的基因组的复制影响不明确。细小病毒NS2通过位于3'端非翻译区的转录本调节病毒mRNA的翻译,而且能够与核输出受体相互作用影响病毒粒子的释放[9]。
1.2.2 结构蛋白(VP1,VP2,VP3) 基因组5'端的开放读码框编码病毒的3种结构蛋白,VP1和VP2是可变剪切基因组右端读码框形成,VP2完全包含于VP1中。VP3是由VP2在组装成了衣壳后经蛋白酶切掉氨基端的9~15个氨基酸残基而形成,存在于感染的病毒粒子中。
VP1由2 286~2 317位核苷酸,2 389~4 541位核苷酸编码,基因全长2 181 nt,由726个氨基酸残基组成。是病毒外壳的组成成分,大约有6~10个拷贝。VP1衣壳蛋白唯一的N端区是病毒感染所必需,但不是衣壳组装所必需,VP1的N末端包含一组碱性氨基酸,这些氨基酸与核定位序列相似,4个碱性氨基酸组成的保守序列在肽链中能够转运其它蛋白进入细胞核,用单抗和多抗血清检测,VP1单一区不裸露在衣壳表面,加热和尿素处理后则使其暴露[10]。
VP2由2 787~4 541位核苷酸编码,基因全长1 755 nt,编码的584氨基酸残基组成的蛋白是构成衣壳的主要蛋白,大约有60个拷贝。CPV衣壳由8股单链以反平行的折叠组成,在几股折叠之间有4个大的环,环1,3,4来自VP2分子,这些亚单位高度缠绕形成一个2.2 nm的纤突,这4个环组成大部分衣壳结构的表面,而且环1,3,4是VP2组装成病毒样粒子所必需的,缺失环2不影响其组装衣壳[8]。VP1和VP3对衣壳蛋白的组装是非必需的,单独VP2就能完成衣壳的组装,在杆状病毒中单独表达VP2以及VP2和GFP融合蛋白均能够形成病毒样粒子,但体积较小[11]。
VP2是构成衣壳的主要蛋白,因而其表面结构和氨基酸序列能决定病毒的许多特性。从抗原位点上看,两个主要的抗原中和位点定位于4个环,位点A由一个VP2的环1和环2以及三重折叠轴的环4组成,环2上222位和224位氨基酸残基的突变会影响这个表位抗原的构象;环4上426位氨基酸残基的变化产生了CPV-2a向CPV-2b的抗原漂移;位点B由大部分存在于环3的299,300和302位氨基酸残基组成,而300位的氨基酸残基是VP2上变化最大的氨基酸[12]。
从宿主范围上看,VP2 93(Lys-Ans),103(Ala-Val),323(Asp-Asn)决定了CPV可以在犬细胞系和活体狗组织内复制,而289,299,300,301位氨基酸残基的变化与CPV能否在犬细胞系复制相关[12]。VP2中80(Lys-Arg),564(Asn-Ser),568(Arg-Gly)也很重要,这些残基是衣壳中3个单体结合到一起的区域。另外,衣壳蛋白359~375位氨基酸残基组成的柔性环结合Ca2+,是病毒感染所必需的,并影响病毒的宿主范围。CPV结构和功能的研究发现,三重对称的纤突控制了细胞的嗜性和宿主范围[13,14]。
2 犬细小病毒的进化
关于CPV的起源目前不是很确切,多数学者认为CPV是以FPV的一个宿主变种出现于1978年。1974年以前没有任何关于CPV-2的报道,1974年希腊首先发现CPV-2的阳性血清,1976年欧洲的血清中发现CPV-2的抗体。直到1978年,在美国和澳大利亚相继发现CPV-2以后,世界上许多其它地区也相继发现了CPV-2型抗体呈阳性,而且在世界各地的犬群中流行。1978年,CPV-2突然出现,并已出现了与最初CPV-2不同的基因型和抗原型变种(CPV-2a,CPV-2b),新变种具有与CPV-2不同的宿主范围,即新变种可以感染猫并进行复制,而且在其他各国都有流行。随着病毒的不断进化,CPV-2逐渐被CPV-2a和CPV-2b所取代,1996在越南等地又从豹猫中分离到新的血清型CPV-2c[15]。
迄今为止,CPV-2型被公认只有1个血清型,但毒株间的抗原性有差异,这种差异称之为抗原漂移。发生抗原漂移的原因是由于疫苗的作用,在免疫的压力下发生变异,但变异株与原始株之间存在交叉反应。变异株比原始株能更好地在犬体内复制,因此传播的机会多。RNA病毒的进化速度快,部分是由于依赖于RNA的RNA聚合酶的易错性。但像CPV这样的DNA病毒出现如此快的抗原替代和序列变化,并且将旧型完全取代是很少见的。犬细小病毒通过抗原漂移产生新的突变株有5个亚型:CPV-2,CPV-2a,CPV-2b,CPV2-c(a)和CPV2-c(b)。细小病毒的中和抗原位点位于VP2上,VP2上几个关键碱基和氨基酸的改变就会改变抗原特征和宿主范围。通过病毒发生的自然宿主漂移是很少发生的,但当其发生时结果是很严重的,因为这种病毒可以通过先天免疫和非适应的宿主群广泛传播。
大约在1979~1981年间,CPV-2在抗原性和基因型上逐渐被CPV-2a所取代。1979年CPV-2引发的病例逐渐增多,到1981年美国临床病犬中主要分离到CPV-2a,日本、澳大利亚也出现相同的情况。1981年以后,CPV-2很少见报道。1984年美国监测到另一种CPV-2变种CPV-2b,到1988年,美国主要是CPV-2b流行,但其他国家则是CPV-2a和CPV-2b混合流行,出现频率相同。而意大利2001~2004收集的CPV-2型病毒中CPV-2a占73.13%,CPV-2b约8.95%,17.91%是VP2 Glu-426的突变种;在意大利CPV-2a比CPV-2b普遍的多,而且CPV-426Glu突变种从2000年开始出现,以后逐年增加,2004年检测到60%的分离病毒是CPV-426Glu突变种[16~18]。欧洲、美国、日本等国家对CPV的研究都表明现在两个新型CPV-2a和CPV-2b,已经在全世界范围内取代了CPV-2型。在我国,1982年梁士哲报道了疑似CPV-2的病例,次年徐汉坤等[19]正式报到了本病的流行,1984年在猫原代肾细胞上分离到该病毒。我国的CPV分离株也存在基因变异现象,除发现CPV-2,CPV-2a,CPV-2b突变株外,还发现在CPV-2a基础上进一步进化产生的2个新的变异株。
病毒衣壳蛋白VP2决定了病毒的宿主范围和其他生物学特性,而且只有很少的氨基酸替换就可明显改变病毒的遗传和抗原特性CPV-2a,CPV-2b和CPV-2仅存在6个氨基酸残基的差异,而CPV-2a和CPV-2b仅有2个氨基酸的差异,555位氨基酸Ile曾经是CPV-2a的特异性位点,CPV-2b发生了恢复突变,为Val,但1990年以后出现的CPV-2a也突变为Val(555)(表1)。根据其变化归结为CPV-2a,555位氨基酸残基为Val。CPV-2a的氨基酸残基555有两种Ile和Val。目前分离的CPV-2a亚型一般为555Val,国内公布的CPV-2a的VP2基因测序结果显示第555位都是Val。

表1 肉食动物细小病毒VP2蛋白氨基酸残基的变异
CPV的抗原型在不同的国家各不相同(表2)。在美国和南美,CPV-2b是CPV的主要亚型;在英国、德国和西班牙,CPV-2a和CPV-2b亚型发生的概率一样;在意大利和我国台湾地区,仍以CPV-2a亚型为主[20,21]。CPV在我国的流行与在意大利、澳大利亚和英国的流行情况相似,CPV-2a比其他毒株更为流行[22,23]。20世纪80年代早期CPV-2曾在我国流行,但1986年后分离到的CPV以CPV-2a为主。谢景之等报道,在2002年送检的8份病料中分离到4株CPV-2a和4株CPV-2b。PV(貉)CC-1-86在CPV-2a的基础上VP2 300位氨基酸残基发生G→S替换,PV(犬)JL-102在CPV-2a的基础上VP2发生氨基酸564S→N替换,其确切的生物学意义尚不清楚。我国的CPV分离株与参考毒株的核酸同源性超过98%,没有形成明显的中国CPV分支,进化方式与文献报道的进化方式一致。
近年来,CPV-2a和CPV-2b广泛并存,但CPV-2a占优势地位。也有报道表明,目前国内市场上所使用的荷兰Intervet的CPV疫苗株的抗原型与分离于南京地区临床发病犬的5株CPV分离株同为CPV-2b亚型。所以,从1982年至今在南京地区CPV流行的主要是CPV2-2b亚型[24]。邱薇等[25]对9株病毒VP2的PCR产物进行回收和序列测定,将其核酸序列及推导的氨基酸序列与CPV参考株进行了比较,发现此次分离到的9株CPV 6个是CPV-2a和3个是CPV2-2b。
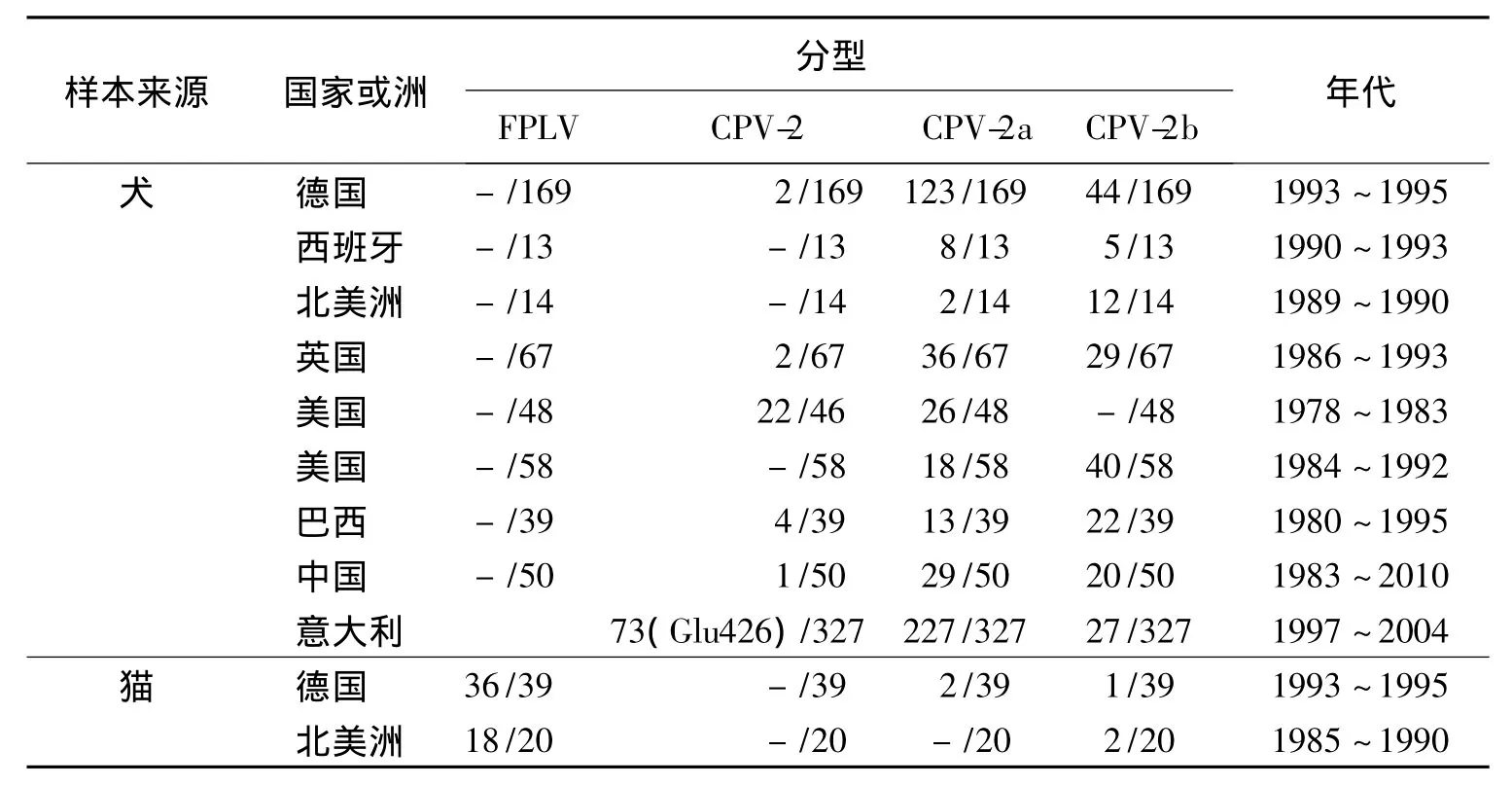
表2 不同国家不同时间FPLV,CPV-2,CPV-2a,CPV-2b的分离情况
3 总结与展望
犬细小病毒从出现到目前仅有近30年的历史。由于该病毒引起的犬细小病毒病,发病率高,死亡率也高,特别是幼犬死亡率更高,是目前危害养犬业的主要传染病。而且由于该病毒经历了较快的进化速度,血清型也不断出现新的变异,所以该病毒目前仍然没有得到有效的控制。了解该病毒的分子生物学特点和进化,对该犬细小病毒病的预防和控制具有重要意义。
国外对于CPV做了许多研究工作,关于其流行特点和进化、宿主范围、基因组结构特点等方面均有报道。但关于中国毒株的报道却很少,国内关于细小病毒的研究多数集中在血清分型和VP2结构蛋白的基因序列研究,更为详尽的研究几乎没有。未来的研究工作应该主要集中于以下方面:
(1)了解中国发病的犬细小病毒的基因组特点,进行分子流行病学研究,进而研究中国细小病毒的进化。
(2)深入研究病毒结构蛋白的功能以及与宿主蛋白的互作机理,为犬细小病毒的预防和控制奠定理论基础。
[1] REED A P,JONES E V,MILLER T J.Nucleotide sequence and genome organization of canine parvovirus[J].J Virol,1988,62(1):266-276.
[2] DAEFFLER L,HORLEIN R,ROMMELAERE J,et al.Modulation of Minute Virus of Mice Cytotoxic Activities through Site-Directed Mutagenesis within the NS Coding Region[J].J Virol,2003,77:12 466-12 478.
[3] CHRISTENSEN J,TATTERSALL P.Parvovirus Initiator Protein NS1 and RPA Coordinate Replication Fork Progression in a Reconstituted DNA Replication System[J].J Virol,2002,76:6 518-6 531.
[4] YOUNG P J,JENSEN K T,BURGER L R,et al.Minute virus of mice NS1 interacts with the SMN protein,and they colocalize in novel nuclear bodies induced by parvovirus infection[J].J Virol,2002,76:3 892-3 904.
[5] LACHMANN S,ROMMELEARE J,NUESCH J P.Novel PKC{eta}Is Required To Activate Replicative Functions of the Major Nonstructural Protein NS1 of Minute Virus of Mice[J].J Virol,2003,77:8 048-8 060.
[6] NUESCH J P,LACHMANN S,CORBAU R,et al.Regulation of Minute Virus of Mice NS1 Replicative Functions by Atypical PKC{lambda}In Vivo[J].J Virol,2002,77:433-442.
[7] CORBAU R,DUVERGER V,ROMMELAERE J,et al.Regulation of MVM NS1 by protein kinase C:impact of mutagenesis at consensus phosphorylation sites on replicative functions and cytopathic effects[J].Virology,2000,278:151-167.
[8] SHACKELTON L A,PARRISH C R,TRUYEN U,et al.High rate of viral evolution associated with the emergence of carnivore parvovirus[J].Proc Nat Acad Sci U S A,2005,102(2):379-384.
[9] LOMBARDO E,RAMIREZ J C,GARCIA J,et al.Complementary roles of multiple nuclear targeting signals in the capsid proteins of the parvovirus minute virus of mice during assembly and onset of infection[J].J Virol,2002,76,7 049-7 059.
[10] VIHINEN-RANTA M,WANG D,WEICHERTWS,et al.The VP1 N-terminal sequence of canine parvovirus affects nuclear transport of capsids and effient cell infection[J].J Virol,2002,76(4):1 884-1 891.
[11] GILBERT L,TOIVOLA J,LEHTOMAAKI E.Assembly of uorescent chimeric virus-like particles of canine parvovirus in insect cells[J].BBRC,2004,313:878-887.
[12] PARKER J S L,PARRISH C R.Canine parvovirus host range is determined by the specific conformation of an additional region of the capsid[J].J Virol,1997,71:9 214-9 222.
[13] CARREIRA A,MENENDEZ M,REGUERA J,et al.In vitro disassembly of a parvovirus capsid and effect on capsid stability of heterologous peptide insertions in surface loops[J].J Biol Chem,2004,279,6 517-6 525.
[14] SIMPSON A A,CHANDRASEKAR V,HEBERT B,et al.Host range and variability of calcium binding by surface loops in the capsids of canine and feline parvoviruses[J].J Mol Biol,2000,300:597-610.
[15] NAKAMURA M,TOHYA Y,MIYAZAWA T,et al.A novel antigenic variant of canine parvovirus from a Vietnamese dog[J].Arch Virol,2004,149:2 261-2 269.
[16] BUONAVOGLIA C,MARTELLA V,PRATELLI A,et al.Evidence for evolution of canine parvovirus type 2 in Italy[J].J Gen Virol,2001,82:3 021-3 025.
[17] BUONAVOGLIA D,CAVALLI A,PRATELLI A,et al.Antigenic analysis of canine parvovirus strains isolated in Italy[J].New Microbiol,2000,23:93-96.
[18] MARTELLA V,CAVALLI A,PRATELLI A,et al.A canine parvovirus mutant is spreading in Italy[J].J Clin Microbiol,2004,42:1 333-1 336.
[19] 徐汉坤,金淮,郭宝发,等.某犬群暴发犬病毒性肠炎的流行病学和临床病理学观察[J].畜牧与兽医,1983(5):5-7.
[20] MARTELLA V,DECARO N,BUONAVOGLIA C.Evolution of CPV-2 and implicance for antigenic/genetic characterization[J].Virus Genes,2006,33:11-13.
[21] WANG H C,CHEN W D,LIN S L,et al.Phylogenetic analysis of canine parvovirus VP2 gene in Taiwan[J].Virus Genes,2005,31:171-174.
[22] ZHANG R,YANG S,ZHANG W,et al.Phylogenetic analysis of the VP2 gene of canine parvoviruses circulating in China[J].Virus Gene,2010,40:397-402.
[23] 谢之景,夏咸柱,扈荣良,等.犬细小病毒基因型的调查[J].中国兽医学报,2004,24(5):421-424.
[24] 邱薇,范泉水,李作生,等.犬细小病毒VP2基因的比较及分型研究[J].动物医学进展,2005,26(5):69-72.
[25] 缪勤,张汇东,朱骞,等.犬细小病毒南京分离株基因型分析[J].兽医与畜牧,2005,37(6):20-21.
(责任编辑:朱宝昌)

