静态注射化学发光法测定黄芩苷含量
张亚莉,李景印,哈婧,李玉佩,王未肖
(1.河北科技大学 理学院,河北 石家庄 050018;2.河北科技大学 化学与制药工程学院,河北 石家庄 050018)
黄芩苷(baicalin,C21H18O11)属于多酚羟基的黄酮类化合物,是中药黄芩的主要有效成分和质量控制指标.具有抗菌消炎、抗氧化、抗病毒、抗肿瘤等生物活性[1-4],还能对早期肾功能损伤和急性肝损伤起到保护作用[5-6],以及吸收紫外线、清除氧自由基、抑制黑色素的生成等作用.因此对黄芩苷测定方法的研究具有重要的意义.目前常用的黄芩苷测定方法有高效液相色谱法及色质联用[7-10]、毛细管电泳[11]、光谱法[12-13]、薄层色谱法[14]及X线衍射分析方法[15],但这些方法的检出限都较低.化学发光分析技术法由于其仪器装置简单、灵敏度高、操作快速等特点已被广泛应用在环境、食品、药物及免疫分析等许多分析科学领域[16].本实验采用静态注射化学发光法,利用黄芩苷对碱性条件下鲁米诺和双氧水化学发光体系的抑制作用,建立了中草药黄芩中黄芩苷含量的检测方法,并将测定结果与高效液相色谱法测定结果进行对比,结果一致.
1 实验部分
1.1 主要原料
鲁米诺(SigmaA8511):北京拜尔迪生物公司;黄芩苷标准品:中国食品药品检定院;体积分数30%过氧化氢(H2O2):天津市恒兴化学试剂制造有限公司;无水乙醇(分析纯):天津市百世化工有限公司;氢氧化钠(分析纯):北京精细化学品有限责任公司.鲁米诺溶于0.1mol/L NaOH配制成2×10-2mol/L储备液,置于冰箱冷藏,实验时用0.1mol/L NaOH溶液稀释至合适浓度.黄芩苷溶于体积分数60%乙醇配制成1×10-3mol/L储备液,置于冰箱冷藏,实验时用二次蒸馏水稀释至合适浓度.实验用水均为二次蒸馏水.
1.2 主要设备
BPCL型化学发光仪(中国科学院生物物理研究所);高效液相色谱仪(AgilentTechnologies 1200Series):安捷伦科技有限公司;电子天平(AL204):梅特勒-托利多仪器(上海)有限公司;石英自动双重纯水蒸馏器:江苏省金坛市富华有限公司;微型植物试样粉碎机:天津泰斯特仪器有限公司.
1.3 实验步骤
在1.5mL塑料离心管中将黄芩苷标准品储备液(或待测样品,空白实验用体积分数60%乙醇,实验表明乙醇对化学发光信号也有一定的抑制作用)用二次蒸馏水稀释至合适浓度,用可调微量进样器吸取50μL试液和40μL鲁米诺的碱性(氢氧化钠浓度为0.016mol/L)溶液加入发光池,置于发光仪测量室中,打开光门,用进样器向发光池中加入40μL的H2O2溶液,用化学发光仪测定发光强度,发光池每次用完用蒸馏水冲洗2遍以减少随机误差.化学发光仪负高压为500V.
2 结果与讨论
2.1 化学发光条件的选择
2.1.1 化学发光反应的动力学性质
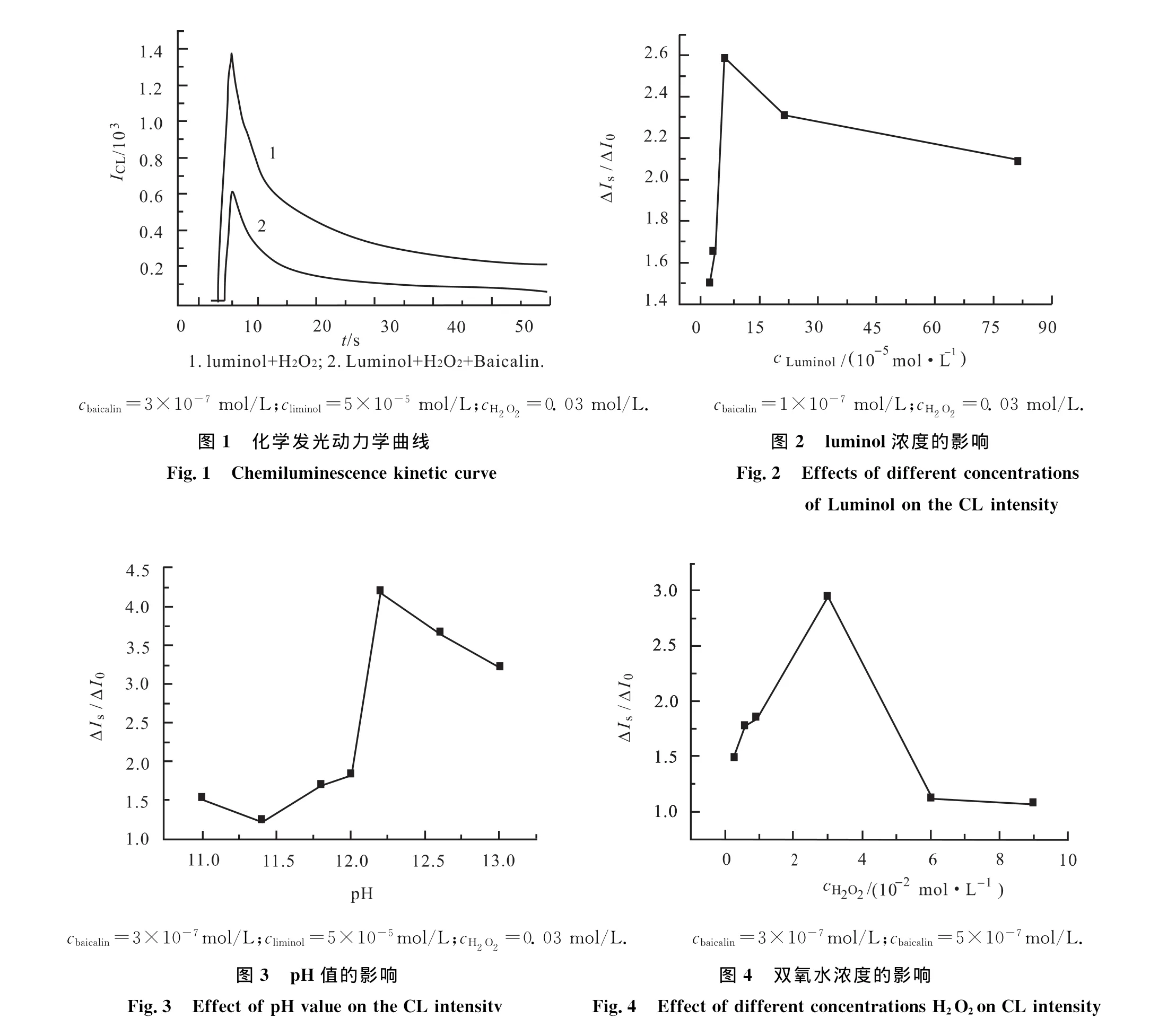
图1中给出了室温下该实验的化学发光反应动力学曲线.其中曲线1表示luminol-H2O2-NaOH体系的化学发光曲线,曲线2表示加入黄芩苷后luminol-H2O2-NaOH体系的化学发光曲线.由图可见:1)由进样器注入H2O2溶液后4s发光强度达到最大值,随后迅速降低,说明该化学发光体系是快发光反应.2)黄芩苷对该发光体系有明显的抑制作用.
2.1.2 Luminol浓度的影响
实验了鲁米诺不同浓度下的化学发光强度(luminol-H2O2,luminol-H2O2-乙醇,luminol-H2O2-黄芩苷).结果如图2所示,以样品抑制发光强度与空白抑制发光强度的比(以下同)对luminol的浓度进行作图,在浓度1×10-5~8×10-4mol/L,比值随着鲁米诺浓度的增加而增加,在鲁米诺浓度为5×10-5mol/L时达到最大,此后相对发光强度的比值逐渐减小,因此本实验选择的鲁米诺浓度为5×10-5mol/L.
2.1.3 氢氧化钠浓度的影响(碱性条件)
鲁米诺的氧化发光反应需在碱性介质中进行,碱性条件对luminol-H2O2化学发光强度有显著的影响.实验发现随着NaOH浓度的增加,样品和空白的相对发光强度明显增强,相对发光强度比值在NaOH浓度为0.016mol/L达到最大而后逐渐降低(图3),因此本实验选择的 NaOH 浓度为0.016mol/L(pH=12.2).
2.1.4 H2O2浓度的影响
实验了不同浓度的H2O2对相对发光强度的影响.结果如图4所示,在0.01~0.06mol/L内,相对发光强度在H2O2浓度为0.03mol/L时达到最大而后减小,因此本实验选择的H2O2浓度为0.03mol/L.
2.2 线性范围、精密度和检出限
在选定的最佳实验条件下对黄芩苷进行测定,黄芩苷浓度在1×10-8~3×10-7mol/L内呈良好的线性关系,线性方程为ΔI=41.03c+74.66(其中,ΔI为体系抑制的发光强度,c为黄芩苷的浓度(10-7mol/L)),线性相关系数为0.996 3.检出限为2.93×10-9mol/L(以最小检测浓度5.0×10-9mol/L计算,11次空白的相对标准偏差是2.5%);对浓度为3×10-8mol/L的黄芩苷平行测定11次,计算其相对标准偏差(RSD)为2.3%,满足分析测定要求.
2.3 干扰测定
在选定的最佳实验条件下,以2×10-7mol/L的黄芩苷进行干扰测定,考察了几种离子对黄芩苷测定的影响.结果表明,当相对误差≤ ±5% 时允许共存的物质有PO3-4,可溶性淀粉、葡萄糖(1 000倍);20倍的Fe3+基本没有干扰,但随着Fe3+浓度的增大其对体系会有增强作用,影响黄芩苷含量的测定;Cu2+对本体系发光强度具有明显的增强作用.
2.4 样品的提取与检测及回收率测定
将购买的4份中草药黄芩样品(河北、山西各2份)于80℃干燥至恒重,粉碎过孔径0.25mm筛得待测样品.用分析天平称取待测样品1g于圆底烧瓶中,加入45mL 60%乙醇溶剂,加热回流1.5h,将回流液倒入锥形瓶中;再次向圆底烧瓶加入45mL体积分数60%乙醇溶剂,回流1.5h,合并2次回流液,用少量溶剂洗涤圆底烧瓶和残渣,洗涤液合并入回流液,过滤,滤液置于100mL容量瓶中,补加溶剂至刻度,摇匀.
按本实验选定的最佳实验条件测定样品中黄芩苷的含量,结果如表1,并与高效液相色谱法测定结果(面积归一法)进行对比,结果比较满意.另选取山西2样品在其中分别加入一定量的黄芩苷标准品进行回收率实验,结果如表2,准确度良好.
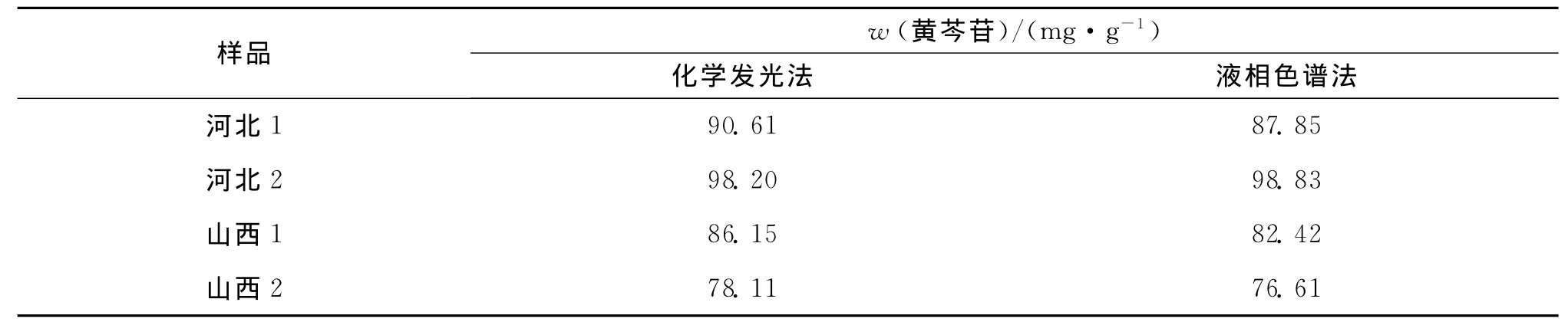
表1 4种黄芩样品中黄芩苷含量的测定Tab.1 Determination results of baicalin in scutellaria

表2 回收率测定Tab.2 Recovery test
3 结论
基于黄芩苷对鲁米诺-过氧化氢-氢氧化钠化学发光体系具有强抑制作用,建立了中草药黄芩中黄芩苷含量的检测方法,该方法灵敏度高,线性范围宽,操作简便.能满足快速分析的要求.
[1]张巍,赵雨,白雪媛,等.黄芩素和黄芩苷与人血清白蛋白相互作用的光谱研究[J].高等学校化学学报,2010,31(9):1834-1840.
ZHANG Wei,ZHAO Yu,BAI Xueyuan,et al.Studies on the interaction for baicalein and baicalin with human serum albumin by spectroscopic methods[J].Chemical Journal of Chinese Universities,2010,31(9):1834-1840.
[2]SHEN Yuhchiang,CHIOU Wenfei,CHOU Yuehching,et al.Mechanisms in mediating the anti-inflammatory effects of baicalin and baicalein in human leukocytes[J].European Journal of Pharmacology,2003,465:171-181
[3]CHENG Yang,PING Jian,XU Huaidong,et al.Synergistic effect of a novel oxymatrine-baicalin combination against hepatitis B virus replication,αsmooth muscle actin expression and typeⅠcollagen synthesis in vitro[J].World Journal of Gastroenterology,2006,12(32):5153-5159.
[4]HIROYA TANIGUCHI,TATSUSHI YOSHIDA,MANO HORINAKA,et al.Baicalein overcomes tumor necrosis factor-related apoptosis-inducing ligand resistance via two different cell-specific pathways in cancer cells but not in normal cells[J].Cancer Research,2008,68(2):8918-8927.
[5]董惠文.黄芩苷对小鼠急性肝损伤的保护作用[J].海峡药学,2011,23(6):45-46
[6]奚百顺,黄培志,童朝阳,等.黄芩苷对脓毒症大鼠早期肾功能损伤的保护作用[J].中国临床医学,2011,18(5):714-717.
XI Baishun,HUANG Peizhi,TONG Zhaoyang,et al.Early protective effect of baicalin for the dysfunction of kidney in rats with sepsis[J].Chinese Journal of Clinical Medicine,2011,18(5):714-717.
[7]杨思敏,陈瑞战,董航,等.高效液相色谱-质谱联用快速筛选并鉴定黄芩甲醇提取物中抗氧化活性成分[J].分析化学,2012,40(6):888-892.
YANG Simin,CHEN Ruizhan,DONG Hang,et al.Rapid screening and structures characterization of antioxidants from methanol extract of scutellariae radix by high performance liquid chromatography-Mass spectrometry[J].Chinese Journal of Analytical Chemistry,2012,40(6):888-892.
[8]郭鹤男,杨学东,刘军,等.高效液相色谱-质谱分析指导下制备黄芩中系列黄酮成分对照品[J].色谱,2012,30(7):690-695.
GUO Henan,YANG Xuedong,LIU Jun,et al.Preparation of flavonoid reference standards from scutellariae radix under the guidance of high performance liquid chromatography-mass spectrometry analysis[J].Chinese Journal of Chromatography,2012,30(7):690-695.
[9]王冬梅,高靥,张洪霞,等.HPLC法同时测定芩连片中黄芩苷﹑黄芩素和汉黄芩素的含量[J].沈阳药科大学学报,2011,28(12):955-958.
WANG Dongmei,GAO Ye,ZHANG Hongxia,et al.Simultaneous determination of baicalin,baicalein and wogonin in Qinlian tablets by HPLC[J].Journal of Shenyang Pharmaceutical university,2011,28(12):955-958.
[10]贾淑杰,王露,王文彤.HPLC法测定风痛炎颗粒中黄芩苷[J].中草药,2012,43(3):507-508.
JIA Shujie,WANG Lu,WANG Wentong.Determination of baicalin in fengtongyan granule by HPLC[J].Chinese Traditional and Herbal Drugs,2012,43(3):507-508.
[11]刘洋,蒋晔,孙捷.HPCE法同时测定小儿清热止咳口服液中3个组分[J].中国中药杂志,2008,30(2):133-135.
LIU Yang,JIANG Ye,SUN Jie.Simple,rapid and simultaneous determination of the contents of 3components in Xiao er Qingre Zhike oral liquid by capillary electrophoresis[J].China Journal of Chinese Materia Medica,2008,30(2):133-135.
[12]王宁,武卫红,李中文.基于近红外光谱技术对双黄连口服液中黄芩苷、绿原酸和连翘苷进行现场快速定量分析方法的研究[J].药物分析杂志,2010,30(9):1689-1694.
WANG Ning,WU Weihong,LI Zhongwen.Research based on near infrared spectroscopy on-site rapid quantitative analysismethod for baicalin,chlorogenic acid and forsythin in Shuanghuanglian oral liquid[J].Chinese Journal of Pharmaceutical analysis,2010,30(9):1689-1694.
[13]蔡朝红,颜鸣,孙燕.双波长分光光度法测定黄连解毒汤中黄芩苷的含量[J].国际药学研究杂志,2010,37(6):466-468.
CAI Zhaohong,YAN Ming,SUN Yan.Determination of baicalin in Coptis decoction for detoxification by dual-wavelength UV spectrophotometry[J].Journal of International Pharmaceutical Research,2010,37(6):466-468.
[14]柯发敏,张开莲.咽炎含片中黄芩的TLC鉴别及黄芩苷的含量测定[J].泸州医学院学报,2010,33(6):606-608.
KE Famin,ZHANG Kailian.Identification of baical skullcap root and determination of the content of baicalin in pharyngitis buccal tablets[J].Journal of Luzhou Medical College,2010,33(6):606-608.
[15]龚宁波,杨宁,季思伟.黄芩 X射线粉末衍射鉴定与黄芩苷定量分析研究[J].中国药师,2010,13(5):607-611.
GONG Ningbo,YANG Ning,JI Siwei.Whole component analysis on Radix scutellariae and new quantitative analysis method on baicalin[J].China Pharmacist,2010,13(5):607-611.
[16]周红伟,汤志勇.流动注射化学发光分析法的应用进展[J].安徽化工,2005,138(6):2-4.
ZHOU Hongwei,TANG Zhiyong.Advance in the application of flow-injection chemiluminescence analysis[J].Anhui Chemical Industry,2005,138(6):2-4.

