葛根玉芪胶囊配方药材组分的提取工艺研究
周天浩,徐 京,牟艳英,解素花,李晋生,*
(1.北京中研同仁堂医药研发有限公司,北京100079;2.北京同仁堂科技发展股份有限公司,北京100079)
葛根玉芪胶囊为保健食品,具有辅助降血糖功能。该产品选用葛根、黄芪、玉竹、桑白皮、胡芦巴、枸杞子、丹参七味药材合理配伍组方。糖尿病属于中医消渴的范畴,现代中医学将糖尿病称为消渴病,所以中医常用补气、补血、清热来调节脏腑功能,从而达到治疗目的[1]。葛根[2]功能主治解肌退热,生津,透疹,升阳止泻,用于外感发热、头痛项强,口渴,消喝等症;桑白皮具有泻肺平喘,利水消肿,用于肺热咳喘,面目浮肿,小便不利等症;胡芦巴用于补肾阳,祛寒湿,肾虚腰酸等症;丹参用于祛瘀止痛,活血通经,清心除烦。枸杞子为传统中医常用的补益药;黄芪[2]具补气固表,托毒排脓,利尿生肌功能[2]。玉竹在《神农本草经》中被列为上品,是中医学治疗“消渴”的常用药物,是我国常用中药材。
根据配方药材饮片有效成分的性质及药理作用,采用醇提和水提分别提取。配方中葛根[3-5]、桑白皮[6-7]、胡芦巴[8]、丹参[9-11]四味药材均以脂溶性成分为主,采用乙醇提取可取得较好效果。其中葛根是配方中的君药,故以葛根素[3-5]作为醇提正交实验考察指标。配方中枸杞子、黄芪、玉竹所含成分都以多糖类为主,采用水提取可取得较好效果,水提部分以粗多糖作为水提正交实验考察指标[12-14]。这些成分可作为药用和保健食品生产的功能性组分,以葛根素和粗多糖为考察指标,通过正交实验设计,对工艺条件进行优选,为工业生产提供工艺参数和理论依据。
1 材料与方法
1.1 材料与仪器
葛根、桑白皮、胡芦巴、丹参、枸杞子、黄芪、玉竹 安国市罗深行中药材有限责任公司;甲醇 色谱纯;纯净水 用微孔滤膜滤过0.45μm;乙醇、冰醋酸、浓硫酸、蒽酮 分析纯。
Agilent 1100 series型高效液相色谱仪 安捷伦科技(中国)有限公司;UV 757CRT型紫外可见光分光光度计 上海精密科学仪器有限公司;DZF06050型真空干燥箱 上海一恒科技有限公司;AB135-S型电光分析天平 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 配方药材提取工艺流程
1.2.1.1 葛根素提取工艺流程 葛根、桑白皮、胡芦巴、丹参→乙醇溶剂提取(80℃)→过滤(120目)→真空浓缩(70℃)→真空干燥(70℃)→醇提干膏。
1.2.1.2 粗多糖提取工艺流程 枸杞子、黄芪、玉竹→纯净水提取(80℃)→过滤(120目)→真空浓缩(70℃)→真空干燥(70℃)→水提干膏。
1.2.2 提取工艺参数的确定
1.2.2.1 醇提工艺参数的确定 醇提工艺采取正交实验设计,提取方法及因素水平的确定,将葛根、桑白皮、胡芦巴、丹参按照配方比例称取配方药材共120g,置圆底烧瓶中回流提取。根据文献[3-11]和预实验,确定提取因素(A)溶剂倍数、(B)乙醇浓度、(C)提取时间、(D)提取次数为考察因素,选用L9(34)正交表,设计四因素三水平正交实验。以每克配方药材中葛根素含量作考察指标,并对每项实验均做2个平行,取平均值进行分析。因素水平表如表1所示:
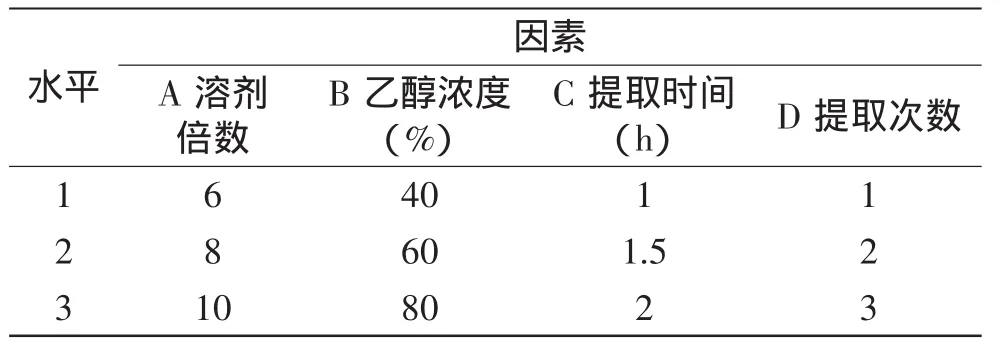
表1 醇提工艺因素水平表Table1 The factors and levels table of alcohol extraction process

表2 水提因素水平表Table2 The factors and levels table ofwater extraction process
1.2.2.2 水提工艺参数的确定 水提工艺采取正交实验设计,提取方法及因素水平的确定,按照配方比例称取枸杞子、黄芪、玉竹共95g,置圆底烧瓶中回流提取。根据文献[12-14]和预实验,提取因素选择(A)溶剂倍数,(B)提取次数,(C)提取时间,通过选用L9(34)正交表,设计三因素三水平正交实验,考察提取溶剂倍数,提取时间及提取次数的参数,以每克配方药材中粗多糖含量作为考察指标,并对每项正交实验均做2个平行,取平均值进行分析。因素水平表如表2所示:
1.2.3 葛根素测定方法
1.2.3.1 葛根素[15]测定色谱条件 色谱柱为waters symmetry C18柱(5μm,4.6mm×150mm);以甲醇-水(25∶75)为流动相,柱温30℃;检测波长为250nm。理论板数按葛根素峰计算应不低于4000。
1.2.3.2 标准曲线的制备 精密称取葛根素1.50mg于10m L容量瓶中,加甲醇溶解,稀释至刻度配制成储备液。分别精密称取储备液0.1、0.2、0.4、0.8、1.6m L于10m L容量瓶中,加甲醇至刻度摇匀,取10μL进样,测定峰面积,进行线形回归方程计算。
1.2.3.3 供样品溶液的制备及测定 取本品粉末(过50目筛)约0.1g,精密称定,置具塞锥形瓶中,精密加入30%乙醇50m L,称定重量,加热回流30m in,冷却至室温,再称定重量,用30%乙醇补足减失的重量,摇匀,滤过,取续滤液,按上述色谱条件测定。
1.2.4 粗多糖测定方法
1.2.4.1 标准曲线的制备 准确称取1.00g经过98~100℃干燥至恒重的分析纯葡萄糖,加水溶解稀释至1000m L,用前稀释10倍。称取0.2g蒽酮置于烧杯中,缓慢加入100m L浓硫酸,配制成0.2%蒽酮硫酸溶液。标准曲线的绘制[15]:准确吸取葡萄糖标准溶液0、0.20、0.40、0.60、0.80、1.00m L分别置于10m L比色管中,准确补充水至1.0m L,加入蒽酮试剂5.0m L充分混匀,在沸水浴中加热10m in,取出在流水中冷却20m in后,在620nm波长下测定吸光度值,进行线性回归方程计算。
1.2.4.2 供样品溶液的制备及测定 准确称取样品1.00~2.00g,置于100m L容量瓶中加水溶解,在沸水中加热30min后过滤,定容至100m L。取待测液5m L至离心管中,加入25m L无水乙醇搅拌均匀,加盖反复倾倒管子数次。在离心机中以4000r/m in离心10m in,并小心弃去上清液,加5m L热水溶解沉淀物,重复上述步骤加25m L无水乙醇再以4000r/min离心10m in,小心弃去上清液。然后用热水分次溶解沉淀并稀释定容至100m L,过滤后即为待测液,按标准曲线制备方法操作,测定吸光度,计算粗多糖含量。
1.2.4.3 提取物中粗多糖的含量 计算公式如下所示:

式中:m1—由标准曲线查得样品液含糖质量(mg);m—样品质量(g);n—稀释倍数;F—换算因子。
2 结果与分析
2.1 醇提正交实验设计
2.1.1 葛根素含量的计算 采用标准曲线性回归方程计算提取物中葛根素的含量。线性回归方程:y= 43779x-50.504,R=0.9999,结果表明在15~240μg·m L-1范围内呈良好的线性关系。以线性回归方程计算提取物中葛根素的含量,再以每克配方药材中葛根素含量作为考察指标。
2.1.2 正交实验结果与分析 对实验结果选择进行极差分析,结果见表3、表4。在上述表中,四因素对葛根素提取的影响程度依次为:B>A>C>D,其优选组合为A3B2C3D3。方差分析显示,乙醇浓度和溶剂倍数对提取葛根素含量有显著的影响,提取时间和提取次数对提取葛根素含量的影响不明显。结合表3、表4的结果,最后醇提优选工艺为:加60%乙醇提取3次,每次用10倍量溶剂,提取2h。按照优选工艺进行2次平行提取实验,测得葛根素含量平均值为15.35,提取工艺基本稳定并且优于正交实验表中的最优结果。实验结果见表5。
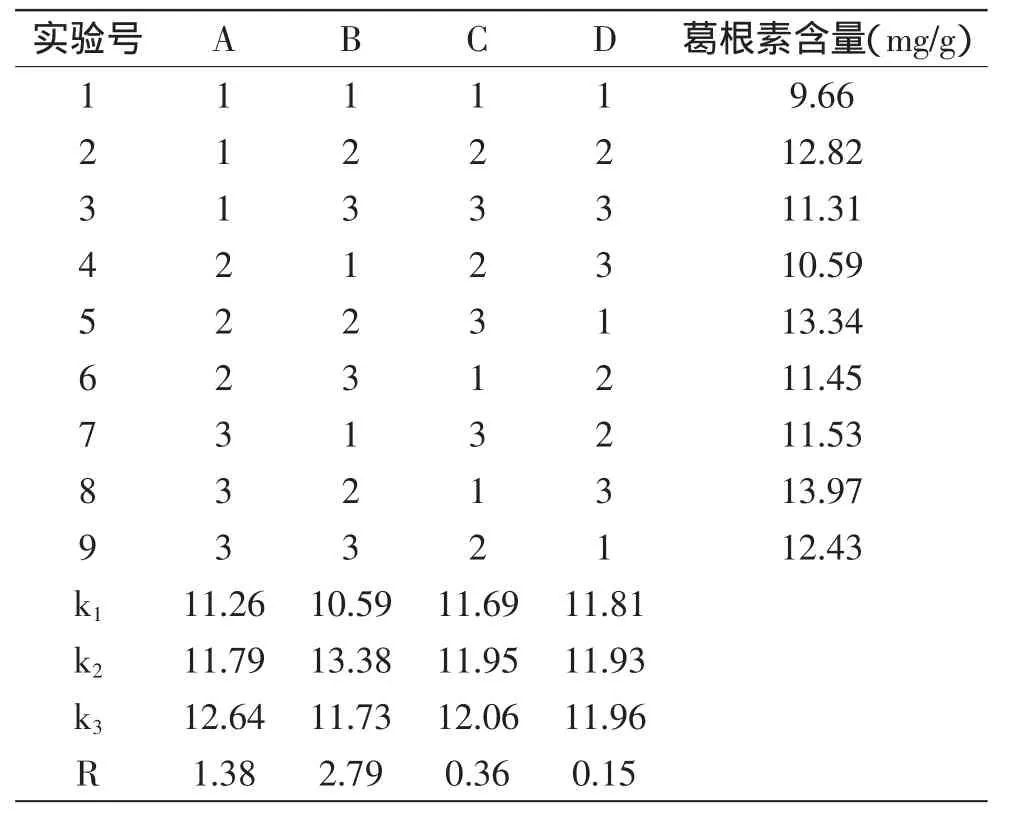
表3 正交实验表及结果分析Table3 Results of orthogonal test

表4 方差分析Table4 Analysis of variance

表5 实验结果Table5 Results of experiment
2.1.3 醇提工艺条件的验证 为验证醇提优选工艺的合理性和稳定性,放大200倍配方用量进行实验验证,并按照醇提优选工艺条件进行连续3个批次提取。虽然放大实验在制备过程中会受到一些因素影响,但放大实验数据基本达到醇提工艺的理想结果,且数据基本稳定。验证实验结果见表6。

表6 验证实验结果Table6 Results of confirmatory experiment
2.2 水提正交实验设计
2.2.1 粗多糖含量的计算 采用标准曲线性回归方程计算提取物中粗多糖的含量。线性回归方程:y=5.8057x-0.0006,R2=0.9986,结果表明在20.32~101.6μg·m L-1范围内呈良好的线性关。以线性回归方程计算提取物中粗多糖的含量,再以每克配方药材中粗多糖含量作为考察指标。
2.2.2 正交实验结果及分析 对实验结果选择进行直观分析和方差分析,结果见表7、表8。在上述表中,三因素对药材中粗多糖提取的影响程度依次为:B>C>A,其优选组合为A2B3C2。方差分析显示,提取次数和提取时间对提取粗多糖含量有显著的影响,溶剂倍数对提取粗多糖含量的影响不明显。结合极差和方差分析的结果,故确定枸杞子、黄芪、玉竹的优选提取工艺参数为:每次加水10倍量,提取3次,提取时间为每次1.5h。按照优选工艺进行2次平行提取实验,测得粗多糖含量平均值为4.45,提取工艺基本稳定并且优于正交实验表中的最优结果,实验结果见表9。

表7 正交实验表及结果分析Table7 Results of orthogonal test

表8 方差分析Table8 Analysis of variance

表9 实验结果Table9 Results of experiment
2.2.3 水提工艺条件的验证 为验证水提优选工艺的合理性和稳定性,放大200倍配方用量进行实验验证,并按照水提优选工艺条件进行连续3个批次提取。虽然放大实验在制备过程中会受到一些因素影响,但放大实验数据基本达到水提工艺的理想结果,且数据基本稳定。验证实验结果见表10。

表10 验证实验结果Table1 0 Results of confirmatory experiment
3 结论
根据配方中药材的主要成分和选择溶剂的极性大小,将以脂溶性成分为主的四味药材葛根、桑白皮、胡芦巴和丹参,用乙醇溶液提取[3-11]。将以多糖类为主的枸杞子、黄芪、玉竹,用纯净水提取[12-14]。分别对醇提部分和水提部分的提取液浓缩、干燥,得到干膏。
根据配方药材饮片有效成分的性质及药理作用,故采用醇提和水提分别提取,以葛根素和粗多糖为考察指标,通过正交设计法对葛根玉芪胶囊的配方药材提取工艺进行优选,优选提取工艺为:葛根、桑白皮、胡芦巴、丹参进行醇提,加10倍量60%乙醇,回流提取3次,每次2h;枸杞子、黄芪、玉竹进行水提,加10倍量水溶剂,回流提取3次,提取时间为每次1.5h。按优选工艺对醇提部分和水提部分进行放大实验验证,葛根素和粗多糖的含量测定结果基本平行,稳定性较为理想,可以作为工业化生产的参考依据。
[1]王天富.中药治疗糖尿病初探[J].中华养生保健,2004(4):9.
[2]国家药典委员会.中华人民共和国药典[S].一部,北京:中国医药科技出版社,2010:312,280,225,70,232,283.
[3]Xu X G,Lu FY,Sui X M,etal.Optimization of the extracting technology for Pueraria lobata by orthogonal test[J].Lishizhen Med Med Res,2000,11(9):780-781.
[4]张彤,徐莲英,陶建生,等.多指标综合评分法优选葛根提取工艺[J].中草药,2004,35(1):38-40.
[5]王琴芳.葛芎通脉颗粒乙醇提取工艺的研究[J].中国药业,2005,14(2):48-49.
[6]徐应淑,张景群.桑白皮中总黄酮的最佳提取工艺[J].贵州农业科学,2011,39(8):185-186.
[7]张蕾,王术光,李洪娟.正交设计法优选桑白皮总黄酮的提取工艺[J].滨州医学院学报,2009,32(4):290-292.
[8]石会丽,赵增强,李富贤,等.正交实验优选葫芦巴总黄酮提取工艺[J].西北药学杂志,2008,23(5):292-293.
[9]武尉杰,盛蓉,谭睿.正交实验法优选丹参药材中丹参酮ⅡA提取工艺的研究[J].川北医学院学报,2013,28(1):10-12.
[10]曾令菊,余桂清,罗云,等.正交设计优选丹参提取工艺[J].湖北中医药大学学报,2012,14(1):45.
[11]李绍林,张建军.丹参提取工艺优选[J].中国实验方剂学杂志,2011,17(12):45-47.
[12]乌兰托雅.枸杞山楂共水提取工艺研究[J].内蒙古医学杂志,2004,36(12):1040-1041.
[13]李万玉,李安荣,徐晓玉,等.黄芪多糖的提取方法[J].中国药业,2009,18(11):87-88.
[14]王强,李盛钰,王晶,等.玉竹多糖的提取工艺研究[J].长春师范学院学报:自然科学版,2010,29(6):54-56.
[15]王光亚.保健食品功效成分检测方法[M].北京:中国轻工业出版社,2002:15-17.

