康砖茶高效液相色谱指纹图谱建立初探
胡 燕,齐桂年
(四川农业大学园艺学院,四川雅安625014)
黑茶是我国的六大基本茶类之一,属于后发酵茶,生产历史悠久,主产区有四川、湖南、湖北、贵州、云南、广西等省,是我国边疆少数民族的日常生活必需品[1-2]。四川黑茶是我国黑茶类的一个重要组成部分,分为南路边茶和西路边茶,其中的南路边茶主要包括康砖茶和金尖茶[3]。康砖茶产于雅安,具有香气纯正,滋味尚浓醇,汤色红褐、尚明,叶底棕褐稍花的品质特点[4]。不同种类的茶叶由于加工方式不同,内含化学成分差异明显。组成康砖茶的原料复杂,经过一系列的加工工序后,内含物质如多酚类、咖啡碱、茶色素等的种类和含量均会发生变化;同时,原料拼配比例的不同也会对康砖茶成品的质量产生不同程度的影响;但目前对康砖茶质量的评价仍主要是测定水分、总灰分、水浸出物等理化指标并结合感官审评,难以全面反映其质量。
化学指纹图谱是一种从整体上研究复杂物质体系的技术工具,目前已广泛应用于中药的真伪鉴别、质量控制、新药开发等领域[5-6],能全面反映物质的整体化学特征,体现其内在的整体质量,但应用于茶叶尤其是黑茶的研究较少[7-16]。本文采用雅安市八家康砖茶生产企业不同年份的共计48批康砖茶成品样,优化了色谱条件和样品的提取条件,初步建立了康砖茶的HPLC指纹图谱,为康砖茶的鉴别和全面质量控制提供了一种新的思路。
1 材料与方法
1.1 材料与仪器
实验采用的康砖茶成品样 取自2010~2012年四川省雅安市八家主要的康砖茶生产企业,每家企业每年取2个成品样,连续取样3年,共计48个样品,样品来源及出厂日期见表1;作为对照的甘露、黄芽、毛峰、茉莉花茶 产地均为雅安市;1个金尖茶成品样 取自雅安市名山县明阳茶厂;甲醇、乙腈 色谱纯,美国Fisher公司;水 二次蒸馏水;无水乙醇、甲酸、乙酸、磷酸、三氟乙酸 分析纯,天津科密欧化学试剂开发中心;咖啡碱标准品 CAS号:58-08-2,购自中国标准物质中心。
LC-20A高效液相色谱仪 配有在线真空脱气装置、四元泵、自动进样器、二极管阵列检测器,日本岛津;LCsolution色谱工作站日本岛津;超声波清洗器 上海冠特超声波仪器有限公司;电子天平 德国赛多利斯股份公司;台式高速离心机 上海安亭科学仪器厂;电热恒温水浴锅 北京中兴伟业仪器有限公司;微型植物实验粉碎机 天津市泰斯特仪器有限公司。
1.2 色谱条件
流动相A:0.3%甲酸水溶液;流动相B:乙腈。色谱柱:Zorbax SB-C18色谱柱(5μm,4.6mm×250mm)。检测波长:190nm~400nm。柱温:35℃。流速:1.0m L/m in。分析时间:45min。梯度洗脱程序:0~3min,2%B~5% B;3~5m in,5%B~12%B;5~10m in,12%B~16%B;10~16min,16%B~23%B;16~25min,23%B~26%B;25~35m in,26%B~30%B;35~40min,30%B~50%B;40~45m in,50%B~2%B。系统平衡色谱柱时间:15m in。
1.3 样品前处理
称取2.000g粉碎茶样(康砖茶样品先用茶刀敲碎后用微型植物实验粉碎机打成粉末,过40目筛)于250m L具塞锥形瓶中,加入90℃蒸馏水,立即移入90℃水浴中浸提15m in,每隔5m in摇动一次。浸提完毕后冷却至室温,离心15m in(转速4000r/m in),取上清液用0.45μm水相滤膜过滤后上机分析。
2 结果与分析
2.1 方法学考察
2.1.1 精密度实验 取同一份供试品的水提取物溶液在1.2的色谱条件下连续进样6次,以19号峰(见图6)为参照峰,HPLC图谱中各共有峰的相对保留时间和相对峰面积的相对标准偏差(RSD)分别为0.37%~1.21%和0.58%~1.76%,表明仪器的精密度良好。
2.1.2 重复性实验 取同一康砖茶样品5份,按1.3的前处理方法平行制备,在1.2的色谱条件下分别进样检测,以19号峰为参照峰,测得各共有峰的相对保留时间和相对峰面积的RSD分别为0.83%~1.67%和0.79%~1.98%,表明该提取方法的重复性良好。
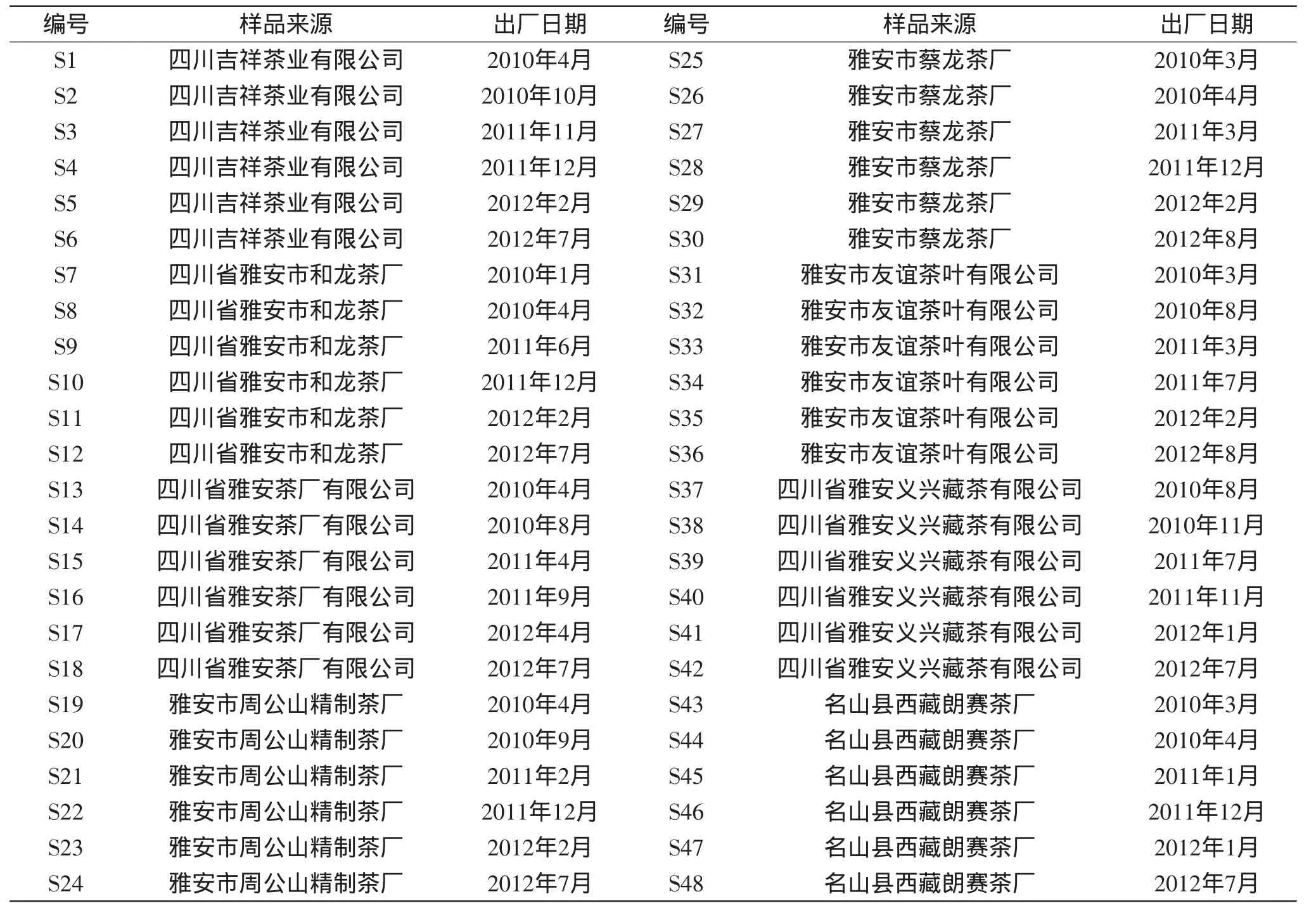
表1 康砖茶的样品来源及出厂日期Table1 Sample source of kang zhuan tea and delivery date
2.1.3 稳定性实验 取同一份康砖茶样品,按1.3的前处理方法获得水提取物溶液,分别在0、2、4、8、12、16、20、24h不同时间点,按1.2的条件进样检测,测得各共有峰的相对保留时间和相对峰面积的RSD分别为0.93%~1.81%和1.03%~2.27%,表明样品提取液在24h内稳定。
2.2 色谱条件的优化
2.2.1 流动相的选择 黑茶所含的化学成分复杂,在进行HPLC分析时只有选择合适的流动相才能提高样品中各色谱峰的分离度,增强响应值,降低基线噪声。有研究表明,在酸性体系下可防止茶叶中儿茶素类的氧化[17]。该实验选用不同浓度的甲酸、乙酸、三氟乙酸和磷酸水溶液分别作流动相A;选用乙腈、甲醇分别作流动相B,采用不同比例进行梯度洗脱。结果表明,当选用0.3%甲酸水溶液作流动相A,乙腈作流动相B,并以1.2所示梯度进行洗脱时样品色谱峰的分离度较好,基线平稳。
2.2.2 检测波长的选择 通过二极管阵列检测器在190~400nm波长范围内进行扫描,发现检测波长为230nm和280nm时色谱图中出现的色谱峰数量较多,其中280nm波长处各色谱峰的分离良好且基线平稳,因此在进行指纹图谱测定时选择280nm作为检测波长。
2.2.3 柱温和流速的选择 在其他实验条件不变的前提下,只改变色谱柱的温度,柱温分别设置为25、30、35、40℃。HPLC结果显示,随着柱温的升高出峰时间稍有提前,但对色谱图整体的出峰情况影响不大(图1)。结合各主要色谱峰的分离情况综合考虑,最终选择柱温为35℃。
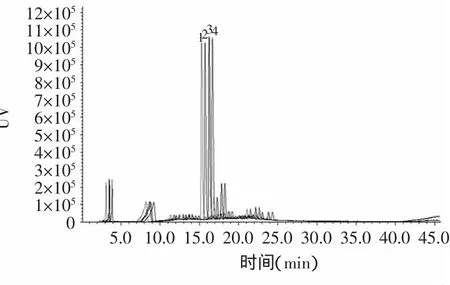
图1 康砖茶提取液在不同柱温下的HPLC图Fig.1 HPLC chromatograms of kang zhuan tea under different column temperature
在其他实验条件不变的前提下,只改变流动相的流速进行梯度洗脱,流速分别设置为0.4、0.6、0.8、1.0、1.2、1.5、1.8m L/min。HPLC结果显示,当流速较低时分析时间长,色谱峰变形和拖尾,分离度较低;随着流速的提高,各色谱峰的出峰时间逐渐提前;当流速为1.0m L/m in时,各色谱峰的分离度最好;之后随着流速的继续提高,柱压升高,各色谱峰的分离度逐渐下降(图2)。
2.2.4 梯度洗脱程序的选择 康砖茶内含成分复杂,不适合采用等度洗脱,该实验考察了不同的梯度洗脱程序对康砖茶样品各色谱峰分离度的影响。在充分保证基线稳定、色谱峰能达到较好分离并且节省分析时间的前提下,最终选择了1.2中所述的梯度洗脱程序进行HPLC指纹图谱测定。

图2 不同流速下的HPLC图Fig.2 The HPLC chromatograms under different flow velocity
2.3 样品提取条件的优化
2.3.1 提取溶剂的选择 选择不同浓度的乙醇、甲醇、乙腈以及二次蒸馏水共16种溶剂对同一份康砖茶样品进行提取,不同提取溶剂所得色谱图的总峰面积结果见图3。从图3可以看出,用二次蒸馏水作为提取溶剂时所得色谱图的总峰面积较大;同时,选用该溶剂提取康砖茶样品时所得的色谱峰数目较多,用水浴提取也更符合饮茶习惯。
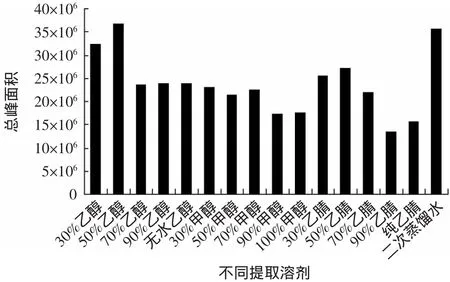
图3 不同提取溶剂的总峰面积Fig.3 The total peak area of different solvents
2.3.2 料液比与提取时间的选择 选取同一康砖茶样品在90℃水浴中浸提15min,分别考察了1∶50、1∶70、1∶100、1∶150、1∶200的料液比对提取效果的影响;结果表明,在满足良好分离度的前提下,当料液比为1∶70时得到的色谱图峰形好,色谱峰的响应值较高。考察了提取时间(5、10、15、20、25、30、35、40、50、60min)对提取效果的影响;结果表明,当浸提15m in时所得到的色谱峰数目较多,之后再延长浸提时间,某些色谱峰的响应值反而略微降低,分析原因可能是随着提取时间的延长,康砖茶中的某些化学成分发生了氧化分解。
2.4 康砖茶HPLC指纹图谱的构建
2.4.1 参照峰及共有峰的选择 选择出峰时间适中、与相邻峰的分离度较好、峰面积在色谱图中所占比例较大的19号峰作为参照峰。经用咖啡碱标准物质溶液进样分析,确认19号峰为咖啡碱。48批康砖茶成品样的指纹图谱见图4。
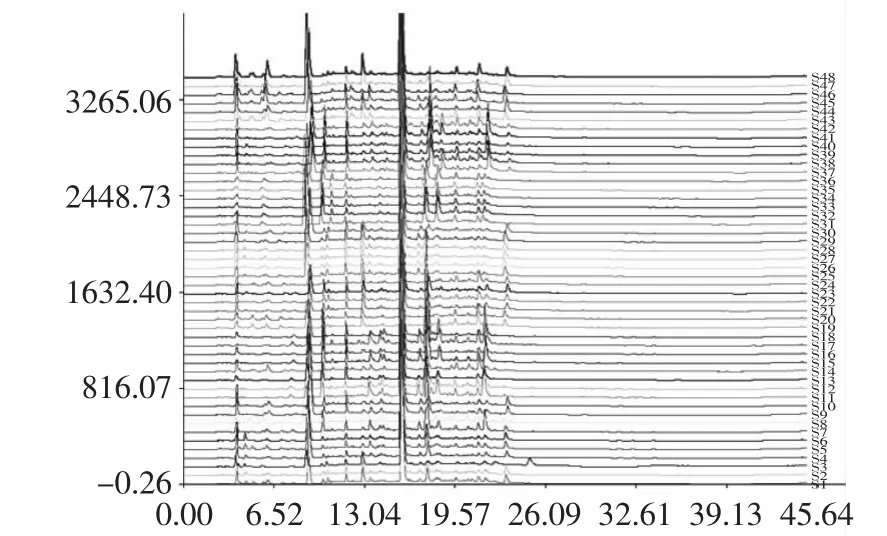
图4 48批康砖茶的HPLC指纹图谱Fig.4 HPLC fingerprints of 48 batches of kang zhuan tea
将各色谱峰的保留时间与同一图谱中参照峰的保留时间比较,其比值为各色谱峰的相对保留时间;各色谱峰按相对保留时间一一匹配后,选择90%以上样本共有的峰为样本集的共有峰。该实验最终选择了34个共有峰,各共有峰的平均相对保留时间见表2。基于友谊茶厂的康砖茶(编号:S31)色谱峰总面积较大,峰数较多,将其指定为参比样品,以求出其他样品中各色谱峰i的相对峰面积Ar,其计算公式为Ar=(Ari/Ars)×100%,其中Ari为某样品中某个色谱峰i的峰面积,Ars为参比样品的总峰面积值。对八家企业康砖茶平均相对峰面积的聚类分析结果表明,当临界值为15时,八家企业的样品聚为3类,友谊、朗赛、和龙和蔡龙的样品聚为一类,义兴藏茶单独为一类,吉祥、周公山和雅安茶厂的样品聚为一类(图5)。对48批康砖茶的指纹图谱进行拟合,建立了对照指纹图谱共有模式(图6)。
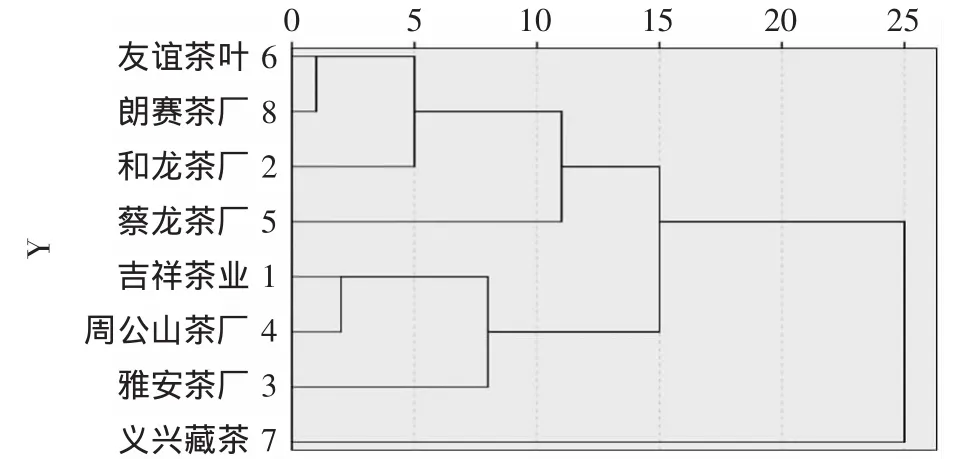
图5 八家生产企业康砖茶样品的系统聚类分析图Fig.5 Dendrogram of kang zhuan tea samples from eight production enterprises using cluster analysis
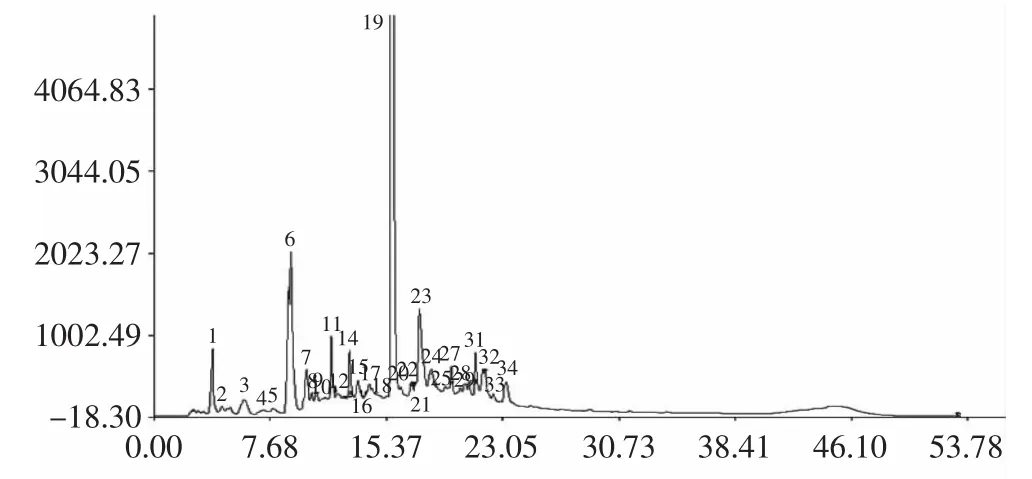
图6 康砖茶HPLC指纹图谱共有模式Fig.6 Common pattern simulated from HPLC fingerprints of kang zhuan tea samples
2.4.2 HPLC指纹图谱的相似度评价 将48批康砖茶样品的HPLC图通过Lcsolution工作站以AIA格式导出,然后分别导入《中药色谱指纹图谱相似度评价系统》(2004A版)软件中,先对同一企业不同生产年份的色谱图进行拟合,分别建立八个厂家指纹图谱的共有模式,再以48批样品的对照指纹图谱共有模式为参照,对八家企业的指纹图谱共有模式进行相似度评价,从表3可知,八家企业的康砖茶指纹图谱共有模式间的相似度在0.904~0.992之间,说明它们所含的化学成分极其相似,质量较稳定。而作为对照的甘露、黄芽、毛峰、茉莉花茶和金尖茶与康砖茶的相似度较低,说明不同原料和加工工艺对茶叶组分的影响较大。
3 结论
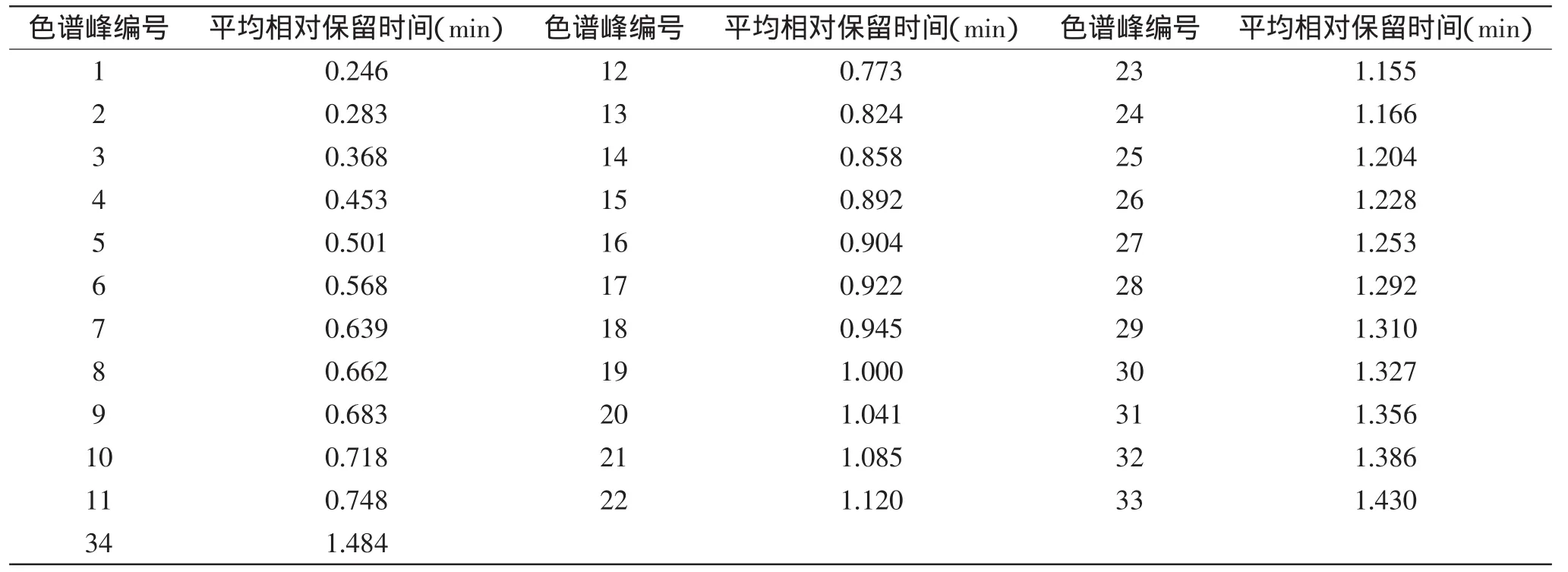
表2 48批康砖茶样品共有峰的平均相对保留时间Table2 The average relative retention time of common peaks of 48 batches of kang zhuan tea samples
本实验利用优化的色谱条件和样品提取条件对雅安市八家主要康砖茶生产企业2010~2012年的共计48批康砖茶样品进行了HPLC指纹图谱研究,确认19号峰为咖啡碱,选择其作为参照峰,建立了对照指纹图谱共有模式。八家企业的康砖茶样品与对照指纹图谱共有模式的相似度在0.901~0.992之间,该结果表明八家不同企业的样品中主要色谱峰的整体图貌基本一致,说明质量较稳定。对八家企业康砖茶平均相对峰面积的聚类分析结果表明,当临界值为15时,八家企业的样品可聚为3类。本实验所建立的HPLC指纹图谱能在一定程度上为康砖茶质量的客观评价和控制提供科学依据。

表3 不同厂家康砖茶样品的相似度Table3 The similarity of kang zhuan tea samples from different production enterprises
[1]胡绍德,陈畅畅,李大祥,等.黑茶中多酚组分和多酚总量分析[J].蚕桑茶叶通讯,2011(2):26-28.
[2]杨崇仁,陈可可,张颖君.茶叶的分类与普洱茶的定义[J].茶叶科学技术,2006(2):37-38.
[3]付润华.康砖茶渥堆微生物及不同渥堆处理品质成分变化的研究[D].雅安:四川农业大学,2008.
[4]吴锡端,骆少君,翁昆,等.紧压茶康砖茶[S].北京:中国标准出版社,2002.
[5]陈菊.中药HPLC指纹图谱的研究进展[J].新疆中医药,2008,26(2):85-87.
[6]范骁辉,叶正良,程翼宇.基于信息融合的中药多元色谱指纹图谱相似性计算方法[J].高等学校化学学报,2006,27(1):26-29.
[7]罗一帆,郭振飞,许旋,等.广东岭头单枞茶高效液相色谱指纹图谱的研究[J].食品科学,2005,26(4):206-209.
[8]宁井铭,张正竹,谷勋刚,等.基于高效液相色谱的普洱晒青毛茶指纹图谱识别方法[J].农业工程学报,2010,26(3):243-248.
[9]Liang Zhang,Ning Li,Yan-Yun Che,etal.Development of the fingerprints of crude Pu-erh tea and ripened Pu-erh tea by high-performance liquid chromatography[J].Journal of Chinese Pharmaceutical Sciences,2011,20:352-359.
[10]王丽鸳,成浩,周健,等.基于多元化学批纹图谱的武夷岩茶身份判别研究[J].茶叶科学,2010,30(2):83-88.
[11]成浩,王丽鸳,周健,等.基于化学指纹图谱的扁形茶产地判别分析研究[J].茶叶科学,2008,28(2):83-88.
[12]王丽鸳,成浩,周健,等.绿茶数字化多元化学指纹图谱建立初探[J].茶叶科学,2007,27(4):335-342.
[13]王丽鸳,成浩,周健,等.普洱茶的HPLC化学指纹图谱分类研究[J].浙江林业科技,2009,29(1):25-30.
[14]陈林,陈键,张应根,等.清香型乌龙茶品质形成过程中儿茶素类和嘌呤碱指纹图谱变化规律[J].茶叶科学,2011,31(6):493-503.
[15]康海宁.茶叶化学组成分析方法及指纹图谱研究[D].厦门:厦门大学硕士学位论文,2006.
[16]高俊.黄山毛峰茶指纹图谱的初步研究[D].合肥:安徽农业大学硕士学位论文,2008.
[17]康海宁,陈波,韩超,等.HPLC法测定茶叶水提液中五种儿茶素和咖啡碱及其用于茶叶分类的研究[J].分析测试学报,2007,26(2):211-215.

