吐温对不同精粗比底物体外发酵特性的影响
■李 林陈 勇
(1.新疆科技开发交流中心,新疆乌鲁木齐 830011;2.新疆农业大学新疆肉乳用草食动物营养重点实验室,新疆乌鲁木齐 830052)
如何提高反刍动物对粗饲料的利用对于提高反刍家畜的生产效率具有重要意义。研究表明,表面活性剂具有提高纤维降解的作用(Chun等,2003;Jo⁃han等,2003),吐温是表面活性剂的一种,是通过山梨醇与不同的脂肪酸酯化生成的多聚化合物,主要包括山梨醇酐单月桂酸酯(吐温20)、山梨醇酐单棕榈酸酯(吐温40)、聚氧乙烯山梨醇酐单硬脂酸酯(吐温60)、聚氧乙烯山梨醇酐单油酸酯(吐温80)。对吐温80的研究表明,它的作用主要表现在促进纤维素的水解、改变厌养真菌细胞膜的流动性(Reese等,1969)、促进真菌和细菌的生长、加快秸秆的发酵速度(Wang等,2003),这表明,吐温80可能是一种值得开发的新型反刍动物饲料添加剂,但是目前对吐温20、吐温40、吐温60的研究还未见报道,而且这4种吐温对不同精粗比发酵底物的研究也未见报道。因此,吐温20、吐温40、吐温60对不同精粗比发酵底物在人工瘤胃中发酵的影响有助于认识其对瘤胃发酵调控的作用,阐明其是否具有作为反刍动物瘤胃发酵调控剂的潜力。
1 材料与方法
1.1 试验设计
试验采用随机单位组试验设计。试验分为3种不同精粗比的发酵底物,底物组成见表1。

表1 不同精粗比的发酵底物组成(g DM/瓶)
每种发酵底物分别添加吐温20、40、60或80,使终浓度为0.2%。对照组不添加任何吐温。每种发酵底物设置4个重复。
1.2 人工唾液的配制
人工唾液的配制根据McDougall(1948)的配方配制,配好后再通入CO2使溶液澄清备用。
1.3 绵羊混合瘤胃液的制备
选用装有永久性瘤胃瘘管的羯羊4只,自由采食玉米秸秆,补饲精料200 g/(d·只)。于晨饲前用过瘤胃瘘管采集瘤胃内容物500 g/只左右,瘤胃液用四层纱布过滤于保温瓶中,混匀,在39℃下运回实验室备用。
1.4 体外培养方法与样品采集
根据表1准确称取发酵底物于125 ml培养瓶中,再量取50 ml过绵羊混合瘤胃液和50 ml人工唾液。轻轻混匀后,用橡胶塞密封培养瓶,置39℃培养箱中培养。体外培养采用许琴(2002)的方法,分别在培养后的3、6、9 h摇匀测pH值,并采样10 ml,于-20℃保存备用。
1.5 测定指标及方法
取出于-20℃保存的样品,室温解冻后用于测定还原糖、氨态氮、微生物蛋白。还原糖测定采用吴逊等(2001)的方法、氨态氮测定采用冯宗慈等(1993)的方法,微生物蛋白测定采用Makkar等(1981)的方法。
1.6 数据处理
试验数据均以平均值±标准差(x±s)表示。统计分析采用DPS5.02软件(唐启义等,2002)中的“随机区组设计分析”进行。
2 结果与分析
2.1 吐温对不同时间点培养液中pH值的影响(见表2)
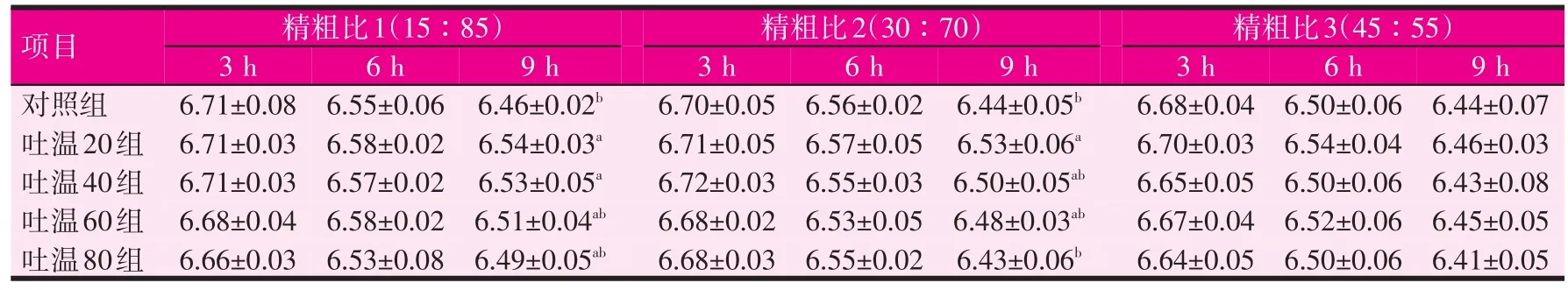
表2 吐温对不同时间点培养液中pH值的影响
随着发酵时间的延长,各组的pH值均呈现不同程度的下降。当发酵底物的精粗比为15∶85和30∶70时,添加吐温对发酵后的3 h和6 h均无显著影响,在发酵后的9 h,吐温20组的pH值显著高于对照组,吐温40组仅当精粗比为15∶85时显著高于对照组(P<0.05)。但3个吐温组间无显著差异。当精粗比为45∶55时,添加吐温对发酵后3、6、9 h的pH值均无显著影响。
2.2 吐温对不同时间点培养液中还原糖浓度的影响(见表3)
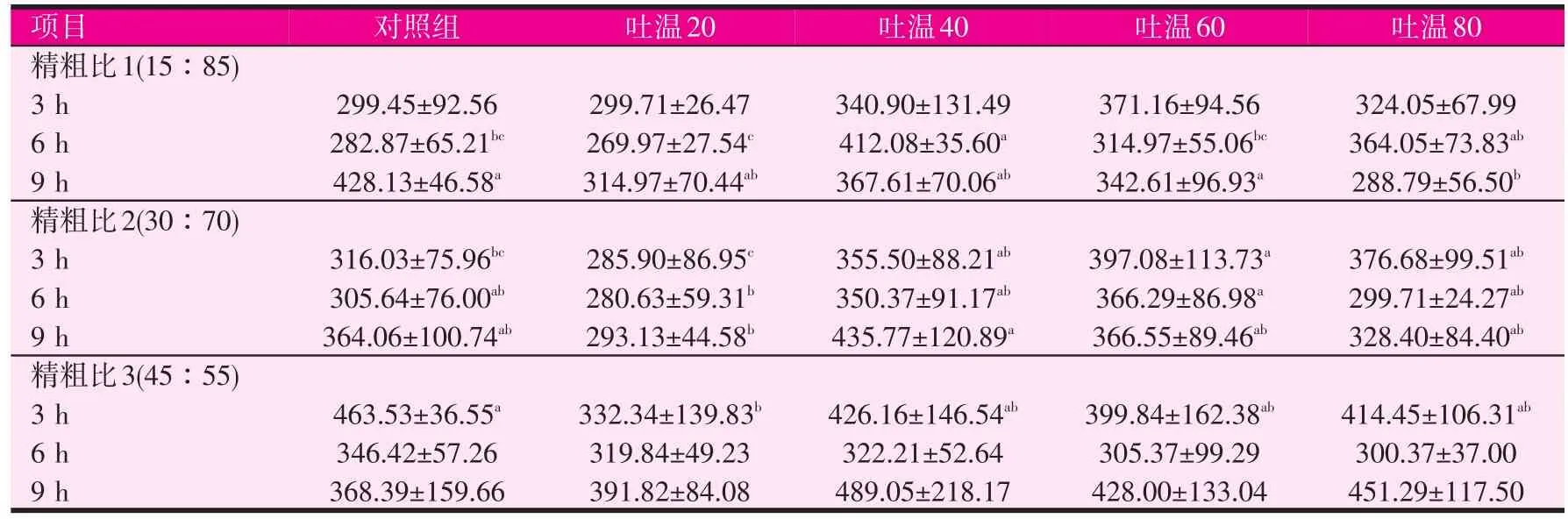
表3 吐温对不同时间点还原糖浓度的影响(μg/ml)
当精粗比为15∶85时,添加吐温对培养后3 h的还原糖水平无显著影响,在培养后6 h时吐温40组的还原糖水平最高,显著高于对照组、吐温20组和吐温60组(P<0.05),在培养后9 h时,添加吐温组的还原糖水平均较对照组有不同程度的下降,其中吐温80组的还原糖水平显著低于对照组和吐温60组(P<0.05)。当精粗比为30∶70时,吐温60组的还原糖水平在培养后的3 h和6 h均最高,并显著高于对照组和吐温20组(P<0.05)。在培养后9 h时,吐温40组的还原糖水平最高,并显著高于吐温20组(P<0.05)。当精粗比为45∶55时,对照组的还原糖水平在培养后的3 h和6 h均最高,其中3 h时,对照组显著高于吐温20组(P<0.05)。在培养后6 h和9 h时,各组间还原糖水平无显著差异。由此可见,吐温40最高可提高还原糖浓度为45.68%(P<0.05,精粗比1中的 6 h),吐温60最高可提高25.65%(P<0.05,精粗比2中的3 h),吐温80最高可提高28.70%(精粗比1的6 h),而吐温20对各时间点还原糖浓度均无显著影响。
2.3 吐温在各时间点对氨态氮浓度的影响(见表4)
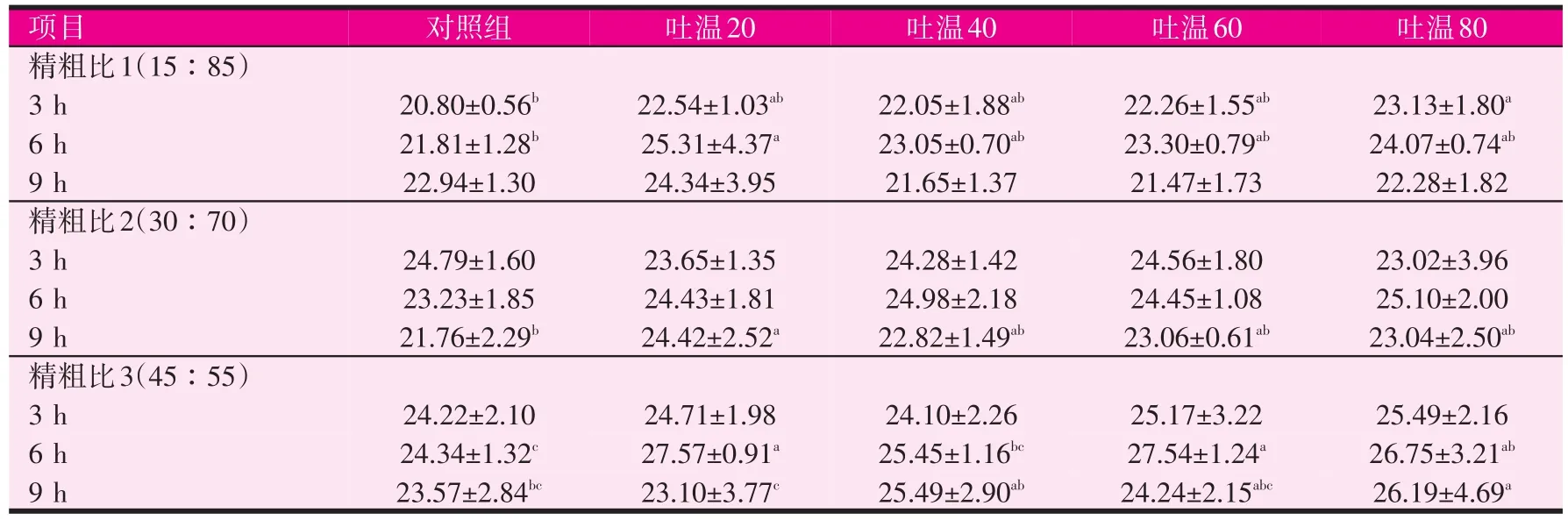
表4 吐温对不同时间点氨态氮浓度的影响(mg/100 ml)
当发酵底物的精粗比为15∶85时,在发酵后的3 h和6 h添加吐温均增加培养液中的氨态氮水平,其中吐温80组和吐温20组的氨态氮水平分别在3 h和6 h显著高于对照组(P<0.05),在9 h时,各组间的氨态氮水平无显著差异。当精粗比为30∶70时,在培养后的3 h和 6 h时,各组间的氨态氮均无显著性差异,在9 h时,添加吐温组均高于对照组,其中吐温20组显著高于对照组(P<0.05)。当精粗比为45∶55时,在培养后3 h时,各组间的氨态氮也无显著差异,但培养后6 h时,吐温20组、吐温60组和吐温80组的氨态氮水平均显著高于对照组(P<0.05),到培养后9 h时,吐温80组的氨态氮水平显著高于对照组(P<0.05)。综上,吐温20最高可提高氨态氮浓度为16.05%(P<0.05,精粗比1中的6 h),吐温40最高可提高8.15%(精粗比3的9 h),吐温60最高可提高7.02%(精粗比1的3 h),吐温80最高可提高11.20%(P<0.05,精粗比1的3 h)。
2.4 吐温在各时间点对微生物蛋白水平的影响(见表5)
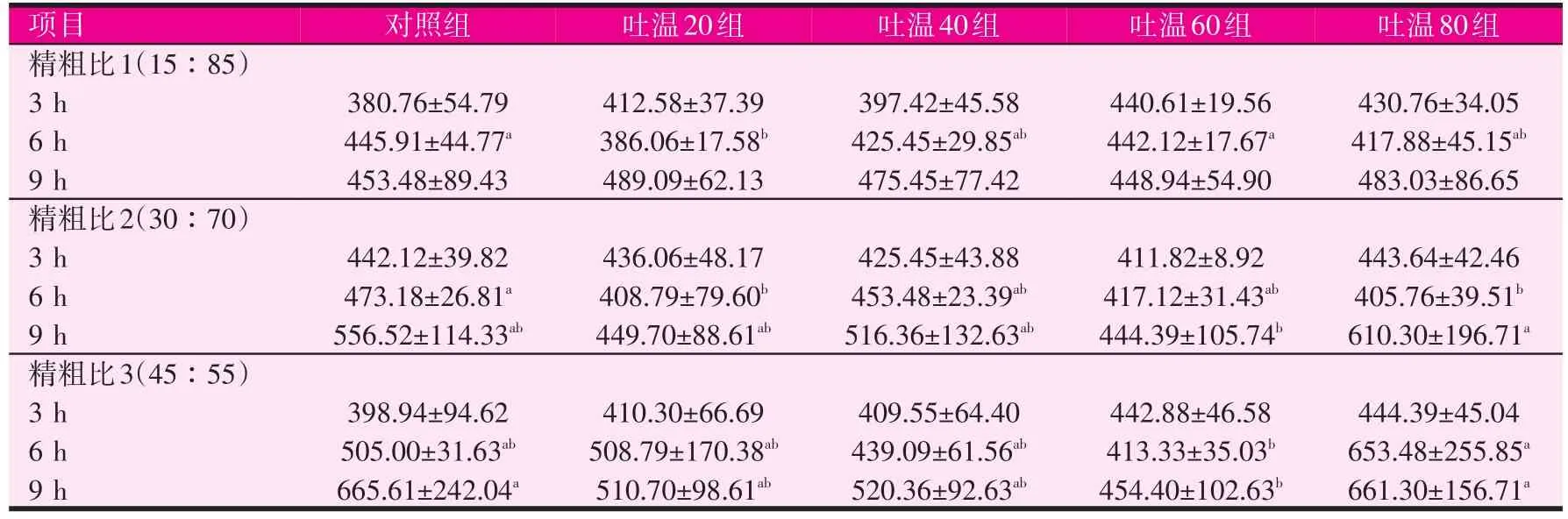
表5 吐温对不同时间点微生物蛋白水平的影响(mg/ml)
随着培养时间的延长,微生物蛋白水平总体呈增加趋势。在培养初期,无论底物精粗比如何,添加吐温对微生物蛋白水平均无显著影响。当精粗比为15∶85和30∶70时,培养后6 h的微生物蛋白水平均以对照组最高,并分别显著高于吐温20组以及吐温80组(P<0.05)。在培养9 h时,添加吐温对精粗比为15∶85的底物产微生物无显著影响;当精粗比为30∶70时,吐温80组显著高于吐温60组,其它各组间无显著差异;当精粗比为45∶55时,吐温60组显著低于对照组和吐温80组(P<0.05)。
3 讨论
研究发现,吐温80能促进瘤胃厌氧真菌和部分细菌的生长、刺激纤维素降解酶的释放、抑制酶活性下降、增加酶活性、促进底物与酶的附着(Re⁃ese,196;Chun等,2004;Johan等,2004)。在体外培养条件下,吐温80和吐温20对棉花秸秆的降解具有显著的促进作用(陈勇等,2005、2006),并且其最佳添加水平为0.2%。有关吐温在不同精粗比条件下对体外瘤胃发酵的影响还未见报道。
瘤胃pH值是瘤胃发酵的重要指标,对于粗饲料的消化有重要影响。一般情况下,瘤胃pH值为6.2~6.8。纤维分解菌对于pH值的变化比较敏感,当pH值较低时,其活性会受到影响,使粗饲料的消化率下降,瘤胃pH值的降低还使瘤胃微生物区系受到影响,从而抑制纤维素的分解(刁其玉等,2004)。本试验中,培养基中的pH值水平在6.4~6.8之间,均处于有利于纤维降解的范围内。随着发酵时间的延长,各组的pH值均呈现不同程度的下降。在发酵后期,吐温20和吐温40在低精粗比条件下有增加pH值的作用。
Lee等(2003)发现,添加吐温80显著提高胞外羧甲基纤维素酶(CMCase)和木聚糖酶活力(P<0.01),显著降低胞内羧甲基纤维素酶和木聚糖酶活力(P<0.01),其它胞外酶如蛋白酶、淀粉酶和大麦葡聚糖酶活性也显著提高(P<0.01)。但是,Hris⁃tov等(2000)报道,在动物试验中吐温对瘤胃羧甲基纤维素酶、木聚糖酶和淀粉酶没有显著影响(P>0.05)。当瘤胃中羧甲基纤维素酶和木聚糖酶活力提高后,必然导致培养液中还原糖水平的升高。在本试验中虽然没有对培养基中的酶活力进行研究,但是从还原糖水平看,吐温40和吐温60在培养前期可增加还原糖水平,表明这两种吐温对酶活力具有增强作用。有关吐温40和吐温60对瘤胃发酵的影响还鲜见报道。在本研究中吐温对体外发酵中还原糖产生不显著,这与已有的报道不同。这种差异可能是由于添加剂的剂量、孵育时间和动物种类不同等原因造成的。
在本试验中,添加吐温有增加氨态氮浓度的作用。这与Lee等(2003)的报道相似。氨态氮浓度的升高预示着灌注非离子表面活性剂能使更多的植物性蛋白在瘤胃内降解。这可能与吐温可增加瘤胃蛋白酶活力有关。
研究发现,吐温80显著刺激非纤维菌菌株的生长速度,同时最有效浓度为0.05%。吐温80也可促进纤维分解菌的生长,但0.1%的效果优于0.05%的效果。因此,添加吐温80刺激非纤维分解菌生长的效果要好于纤维分解菌(Lee等,2003)。在本研究中,从微生物蛋白水平看,添加吐温均没有表现出促进瘤胃微生物生长,相反在大多数时间里,添加吐温组的微生物蛋白水平均低于对照组,这可能与添加水平有关。吐温作为表面活性剂,具有增强微生物细胞膜流动性的作用,在高浓度条件下,可破坏细胞膜的完整性,导致微生物生长受阻。
4 结论
在不同精粗比底物条件下,添加吐温的作用不同。吐温通过提高瘤胃氨态氮和还原糖水平调节瘤胃发酵。

