大豆皂苷对四氯化碳致肝损伤小鼠肝脏氧化应激的干预作用
王玉娇, 赵文玺, 金梅花, 李 天, 全吉淑
(延边大学 医学院,吉林 延吉 133000)
大豆皂苷是大豆重要生物活性物质之一,主要分布于大豆胚轴中。大豆皂苷属于五环三萜类齐墩果烷型皂苷,由非极性的三萜苷元和低聚糖链组成。按苷元的不同可分为A类、B类、E类和DDMP皂苷,其中A类为双糖链皂苷,B类、E类和DDMP皂苷为单糖链皂苷[1]。大豆皂苷具有多种药理作用,如抗氧化、抗癌、防治心血管疾病及免疫激活等作用[2-4]。最近研究还表明,大豆皂苷及其衍生物对半刀豆球蛋白A所致肝损伤以及酒精性急性肝损伤具有保护作用[5-7]。作者通过建立四氯化碳(CCl4)致小鼠急性肝损伤模型,观察大豆皂苷对CCl4致急性肝损伤小鼠肝脏氧化应激的干预作用,探讨大豆皂苷的保肝作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 昆明小鼠,雄性,体重为18~22 g,由延边大学实验动物中心提供。
1.1.2 试剂和仪器 大豆皂苷(纯度≥80%):华北制药股份有限公司;CCl4:Sigma公司;水飞蓟素:沈阳东陵药业股份有限公司;白蛋白(Alb)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、总超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、还原型谷胱甘肽(GSH)、Na+-K+-ATP 酶 (Na+-K+-ATPase)、Ca2+-Mg2+-ATP 酶(Ca2+-Mg2+-ATPase)、Mn-超氧化物歧化酶 (Mn-SOD)、丙二醛(MDA)及蛋白质试剂盒:南京建成科技有限公司;3-30K型离心机:德国Sigma公司;S22PC型分光光度计:上海精密科学仪器有限公司产品。
1.2 方法
1.2.1 实验动物分组及处理 将50只小鼠按体重随机分为5组,即正常对照组、模型对照组、水飞蓟素组、大豆皂苷高、低剂量组。每日灌胃给药1次,连续7 d,水飞蓟素剂量为50 mg/kg,大豆皂苷高、低剂量分别为200、100 mg/kg,正常对照组及模型对照组小鼠则以等体积生理盐水灌胃。末次给药1 h后,除正常对照组腹腔注射等体积大豆油外,其余各组小鼠腹腔注射给予40 mg/kg CCl4(注射体积分数为0.5%的CCl4大豆油5 mL/kg)。造模期间禁食,不禁水。
1.2.2 血清生化指标的检测 造模16 h后,分离血清,检测小鼠血清Alb含量和ALT、AST、ALP活性,并按公式计算药物对Alb含量的提高率和对酶活性的抑制率。
提高率(%)=(治疗组模型-对照组)/(正常对照组-模型对照组)×100
抑制率(%)=(模型对照组-治疗组)/(模型对照组-正常对照组)×100
1.2.3 肝组织氧化应激及抗氧化指标的检测 常规方法制备肝匀浆和肝线粒体。按照各测试盒操作方 法 测 定 SOD、CAT、GPx、Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Mn-SOD、GSH、MDA 及蛋白质水平,并按上述公式计算各指标的提高率或抑制率。
2 结果与分析
2.1 大豆皂苷对肝损伤小鼠血清ALT、AST、ALP活性和Alb含量的影响
血清ALT、AST、ALP活性和Alb含量可反映肝功能损伤急性期改变以及肝细胞损伤程度[8-9],见表1。与正常对照组比较,模型对照组小鼠血清ALT、AST和ALP活性明显升高 (P<0.05),Alb含量明显减少(P<0.05),表明小鼠急性肝损伤模型制备成功;与模型对照组比较,大豆皂苷高、低剂量组小鼠血清ALT活性明显降低(P<0.05),大豆皂苷高剂量组血清 AST和ALP活性明显降低(P<0.05),Alb含量明显增高(P<0.05),提示大豆皂苷对CCl4所致肝损伤具有保护作用。大豆皂苷高剂量组对血清ALT、AST和ALP活性的抑制率分别为 76%、65%和67%,Alb含量的提高率为75%,接近或超过水飞蓟素组的85%、67%、59%和69%,说明其保肝活性基本接近水飞蓟素。
表1 大豆皂苷对血清 ALT、AST、ALP活性和 Alb含量的影响(±s,n=10)Table 1 Effects of soyasaponins on ALT,AST,ALP activities and Alb content of serum(±s,n=10)
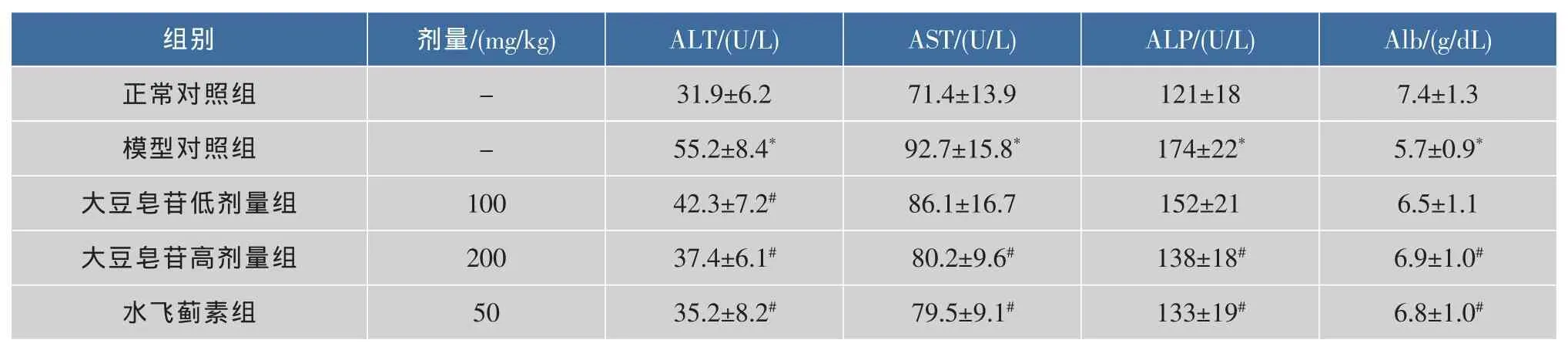
表1 大豆皂苷对血清 ALT、AST、ALP活性和 Alb含量的影响(±s,n=10)Table 1 Effects of soyasaponins on ALT,AST,ALP activities and Alb content of serum(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05。
组别正常对照组模型对照组大豆皂苷低剂量组大豆皂苷高剂量组水飞蓟素组剂量/(mg/kg)--100 200 50 ALT/(U/L)31.9±6.2 55.2±8.4*42.3±7.2#37.4±6.1#35.2±8.2#AST/(U/L)71.4±13.9 92.7±15.8*86.1±16.7 80.2±9.6#79.5±9.1#ALP/(U/L)121±18 174±22*152±21 138±18#133±19#Alb/(g/dL)7.4±1.3 5.7±0.9*6.5±1.1 6.9±1.0#6.8±1.0#
2.2 大豆皂苷对肝损伤小鼠肝组织抗氧化体系的影响
MDA是脂质过氧化的代谢产物。SOD、GPx和CAT是体内重要的抗氧化酶,可与GSH等抗氧化剂一起能有效清除体内脂质过氧化物,使机体免受自由基的损害[8-10]。注射CCl4明显降低模型对照组小鼠肝匀浆 SOD、GPx 和 GSH 水平(P<0.05),升高肝匀浆MDA含量(P<0.05),说明CCl4所致的急性肝损伤能引起典型脂质过氧化损伤。大豆皂苷治疗可回升小鼠肝匀浆SOD、GPx活性和GSH含量(P<0.05),降低 MDA 水平(P<0.05)。 大豆皂苷高、低剂量组小鼠肝匀浆MDA水平分别降低59%和72%,高剂量组MDA抑制率接近水飞蓟素组的74%。与正常对照组比较,模型对照组小鼠肝组织CAT水平没有显著性变化,但大豆皂苷和水飞蓟素干预则可明显增高小鼠肝组织CAT活性(P<0.05),见表2。
表 2 大豆皂苷对肝匀浆 SOD、CAT、GPx、GSH 及 MDA 水平的影响(±s,n=10)Table 2 Effects of soyasaponins on SOD,CAT,GPx,GSH and MDA of liver homogenates(±s,n=10)
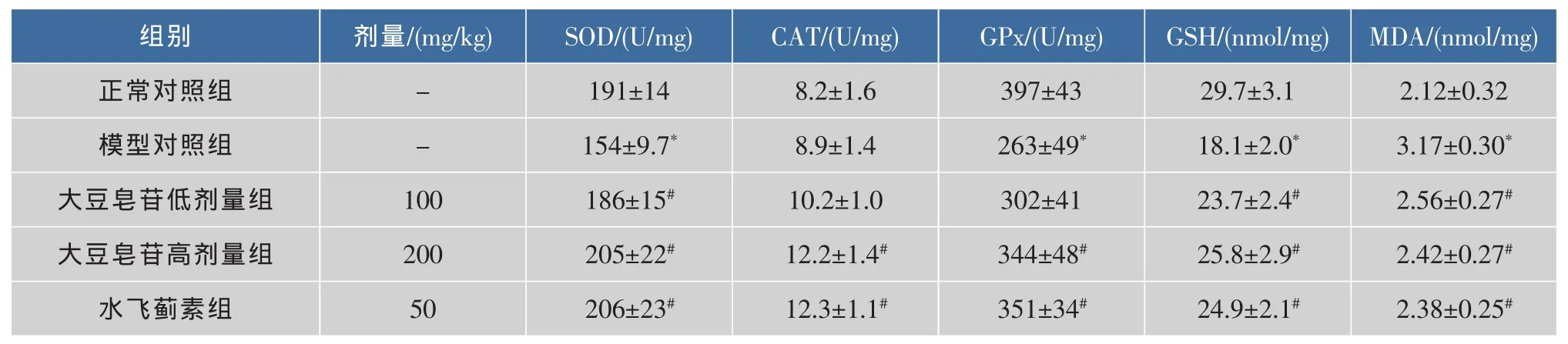
表 2 大豆皂苷对肝匀浆 SOD、CAT、GPx、GSH 及 MDA 水平的影响(±s,n=10)Table 2 Effects of soyasaponins on SOD,CAT,GPx,GSH and MDA of liver homogenates(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05。
组别正常对照组模型对照组大豆皂苷低剂量组大豆皂苷高剂量组水飞蓟素组剂量/(mg/kg)--100 200 50 SOD/(U/mg)191±14 154±9.7*186±15#205±22#206±23#CAT/(U/mg)8.2±1.6 8.9±1.4 10.2±1.0 12.2±1.4#12.3±1.1#GPx/(U/mg)397±43 263±49*302±41 344±48#351±34#GSH/(nmol/mg)29.7±3.1 18.1±2.0*23.7±2.4#25.8±2.9#24.9±2.1#MDA/(nmol/mg)2.12±0.32 3.17±0.30*2.56±0.27#2.42±0.27#2.38±0.25#
2.3 大豆皂苷对肝损伤小鼠肝线粒体氧化应激的影响
氧化应激的主要作用靶点之一是线粒体,而SOD是线粒体主要抗氧化酶,以Mn-SOD形式存在[11]。此外,线粒体功能障碍是肝细胞损伤的一个重要机制,它在细胞坏死和凋亡过程中都起着重要作用,已成为细胞存亡的控制中心。Na+-K+-ATPase和Ca2+-Mg2+-ATPase是存在于线粒体膜上的重要ATP酶,是反映细胞能量代谢及功能损伤的重要指标[10,12],见表 3。与正常对照组比较,模型对照组小鼠肝线粒体MDA含量增高(P<0.05),肝线粒体Na+-K+-ATPase、Ca2+-Mg2+-ATPase和 Mn-SOD活性降低(P<0.05),说明CCl4引起急性肝损伤小鼠肝线粒体氧化应激,线粒体功能受到损伤。大豆皂苷治疗可回升小鼠肝线粒体 Na+-K+-ATPase、Ca2+-Mg2+-ATPase和 Mn-SOD活性 (P<0.05), 降低线粒体MDA水平(P<0.05)。大豆皂苷高剂量组线粒体Na+-K+-ATPase、Ca2+-Mg2+-ATPase和Mn-SOD活性分别升高52%、83%和68%,接近水飞蓟素组的61%、82%和41%,肝线粒体MDA水平则降低85%,高于水飞蓟素组的83%。说明大豆皂苷可减轻肝损伤小鼠的肝线粒体氧化应激,提高线粒体抗氧化能力,有助于改善线粒体功能障碍。
表 3 大豆皂苷对肝线粒体 Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Mn-SOD 及 MDA 的影响(±s,n=10)Table 3 Effects of soyasaponins on Na+-K+-ATPase,Ca2+-Mg2+-ATPase,Mn-SOD and MDA of liver mitochondria(±s,n=10)
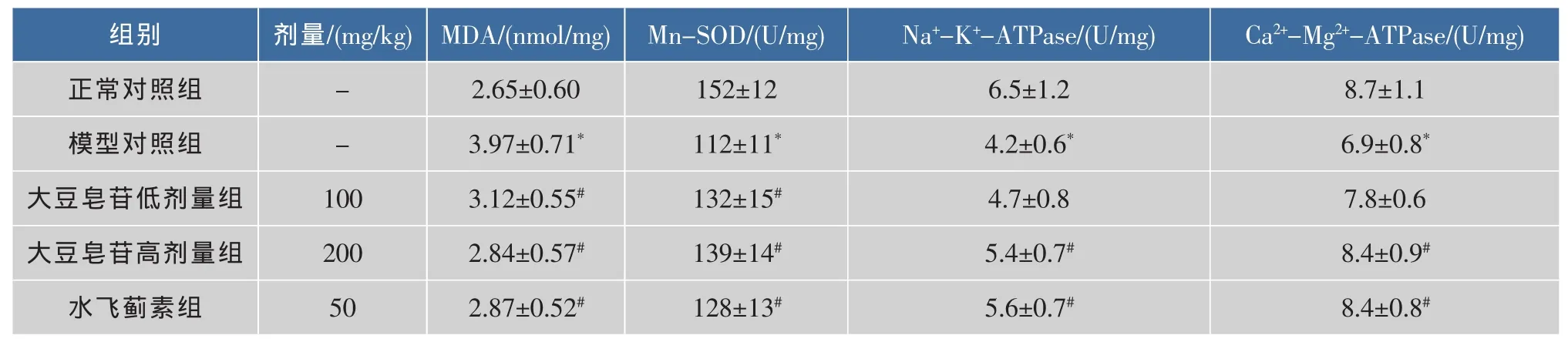
表 3 大豆皂苷对肝线粒体 Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Mn-SOD 及 MDA 的影响(±s,n=10)Table 3 Effects of soyasaponins on Na+-K+-ATPase,Ca2+-Mg2+-ATPase,Mn-SOD and MDA of liver mitochondria(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05。
组别 剂量/(mg/kg)MDA/(nmol/mg) Mn-SOD/(U/mg) Na+-K+-ATPase/(U/mg) Ca2+-Mg2+-ATPase/(U/mg)正常对照组 - 2.65±0.60 152±12 6.5±1.2 8.7±1.1模型对照组 - 3.97±0.71* 112±11* 4.2±0.6* 6.9±0.8*大豆皂苷低剂量组 100 3.12±0.55# 132±15# 4.7±0.8 7.8±0.6大豆皂苷高剂量组 200 2.84±0.57# 139±14# 5.4±0.7# 8.4±0.9#水飞蓟素组 50 2.87±0.52# 128±13# 5.6±0.7# 8.4±0.8#
3 结语
肝损伤是指在一系列理化因素的作用下,肝细胞发生不同程度的肿胀、变性、坏死和凋亡的病理状态。在肝细胞病变过程中,自由基、酶及脂质过氧化等均发挥主要作用[13]。CCl4所致急性肝损伤模型是最常用的经典模型之一,其机制为CCl4在肝内经微粒体细胞色素P450分解活化,生成活泼的三氯甲基自由基和氯自由基,导致肝微粒体的脂质过氧化增强而抗氧化能力下降,导致自由基增加,细胞膜脂质发生过氧化,使肝细胞结构和功能受到损害[14]。文献报道大豆皂苷具有较强的抗脂质过氧化活性,因而推测其可能具有保肝作用。作者选择血清ALT、AST、ALP和Alb等指标评价CCl4造成急性肝损伤的程度。本实验结果表明,大豆皂苷均可明显降低CCl4所致急性肝损伤小鼠血清ALT、AST和ALP活性,增高血清Alb含量,提示大豆皂苷可减轻CCl4诱导的肝细胞损伤和改善肝脏功能状况。
肝损伤是多种肝病共同的病理基础,而活性氧自由基引发的氧化应激是肝病发病的共同病理生理基础。氧化应激主要通过启动膜脂质过氧化改变生物膜功能、与生物大分子共价结合及破坏酶的活性等在细胞因子,如TNF-α、NF-κB等的共同作用下引起不同程度的肝损伤。因此,对氧化应激导致肝细胞损伤的研究便成为治疗肝脏疾病的一个重要途径[15]。机体内抗氧化酶类与其它酶类及抗氧化剂组成一个抗氧化防御系统,以清除体内过多的自由基。SOD消除单线态氧,是抗氧化的第一道防线;而CAT和GPx清除H2O2,从而减轻和阻断脂质过氧化反应的引发。GSH是一种低分子自由基清除剂,又是GPx的底物,且能稳定巯基的酶和防止血红蛋白及其它辅因子受氧化损伤[16]。本实验表明,模型对照组小鼠肝脏抗氧化酶活性降低,脂质过氧化水平升高,提示大豆皂苷可通过直接捕捉、清除自由基、阻断或终止自由基连锁反应链,抑制氧自由基反应和脂质过氧化反应,最终抑制脂质过氧化产物MDA的生成。
线粒体在细胞代谢和能量过程扮演着重要的角色,由于线粒体内膜的高选择性,线粒体较独立于外界环境,只有在能量吸收和转换过程中受到外界环境的影响,产生线粒体氧应激损伤。由于线粒体在细胞物质和能量代谢过程中的重要性,线粒体形成了自身的一套抗氧化防御体系,保证细胞的能量和物质代谢顺利进行。线粒体内的抗氧化物包括低分子量的活性氧清除剂,如GSH和催化降解过氧化物和氢过氧化物的有关的酶,包括Mn-SOD、GPx等[11]。此外,自由基与脂质过氧化反应还损伤线粒体膜,使其伴有ATP酶活性降低。本实验表明,模型对照组小鼠肝线粒体Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性降低,Mn-SOD活性降低,MDA水平升高,表明急性肝损伤小鼠肝细胞线粒体能量代谢障碍及钙泵活性降低,存在一定程度的线粒体氧应激和功能损伤,这与文献报道相一致[10,12]。CCl4进入机体后产生大量自由基,自由基与脂质过氧化反应损伤线粒体膜,导致线粒体水肿和ATP合成减少,并伴有ATP依赖性酶的活性降低,而后者又能加重线粒体的损伤[10,12]。大豆皂苷可增高肝损伤小鼠肝线粒体抗氧化能力,减轻自由基对线粒体的损伤和改善线粒体功能障碍,从而对线粒体起到保护作用。
综上所述,大豆皂苷降低CCl4致急性肝损伤小鼠肝脏及其线粒体氧化应激,对肝损伤具有保护作用。该研究结果对大豆皂苷在保肝方面的开发利用具有一定的参考价值。
[1]孙权,刘淑萍,金爱花,等.大豆皂甙体外抗氧化活性研究[J].食品科技,2010,35(3):72-74.SUN Quan,LIU Shu-ping,JIN Ai-hua,et al.In vitro antioxidantive effects of soyasaponins[J].Food Science and Technology,2010,35(3):72-74.(in Chinese)
[2]裴迎新,赵焕焕,杜晓燕,等.大豆皂甙Bb对食管癌细胞凋亡的影响及其机制研究[J].卫生研究,2010,39(4):444-446.PEI Ying-xin,ZHAO Huan-huan,DU Xiao-yan,et al.Apoptosis effects on human esophageal cancer cells by soyasaponin Bb and its mechanism[J].Journal of Hygiene Research,2010,39(4):444-446.(in Chinese)
[3]Zhang W,Popovich D G.Effect of soyasapogenol A and soyasapogenol B concentrated extracts on Hep-G2 cell proliferation and apoptosis[J].Journal of Agricultural and Food Chemistry,2008,56(8):2603-2608.
[4]Rodrigues H G,Diniz Y S,Faine L A,et al.Antioxidant effect of saponin:potential action of a soybean flavonoid on glucose tolerance and risk factors for atherosclerosis[J].International Journal of Food Sciences and Nutrition,2005,56(2):79-85.
[5]Kuzuhara H,Nishiyama S,Minowa N,et al.Protective effects of soyasapogenol A on liver injury mediated by immune response in a concanavalin A-induced hepatitis model[J].European Journal of Pharmacology,2000,391(1-2):175-181.
[6]Sasaki K,Minowa N,Kuzuhara H,et al.Preventive effects of soyasapogenol B derivatives on liver injury in a concanavalin A-induced hepatitis model[J].Bioorganic&Medicinal Chemistry,2005,13(16):4900-4911.
[7]杨修仕.大豆皂苷对急性酒精性肝损伤的保护作用研究[D].太原:山西大学,2011.
[8]QUAN Ji-shu,YIN Xue-zhe,XU Hui-xian.Boschniakia rossica prevents the carbon tetrachloride-induced hepatotoxicity in rat[J].Experimental and Toxicologic Pathology,2011,63:53-59.
[9]刘小玲,李艳,赵鹏,等.仙草提取物对CCl4致小鼠肝损伤的保护作用[J].食品与生物技术学报,2009,28(6):1-5.LIU Xiao-ling,LI Yan,ZHAO Peng,et al.Protective effects of extracts of Mesona blumes on carbon tetrachloride induced liver injury in mice[J].Journal of Food Science and Biotechnology,2009,28(6):1-5.(in Chinese)
[10]宋军,赵军宁,王晓东,等.芍甘多苷对四氯化碳亚急性肝损伤大鼠肝细胞线粒体保护作用[J].中国中药杂志,2011,36(7):931-937.SONG Jun,ZHAO Jun-ning,WANG Xiao-dong,et al.Protective effects of Shaoganduogan on hepatocyte mitochondria in subacute liver injury rat induced by carbon tetrachloride[J].China Journal of Chinese Materia Medica,2011,36(7):931-937.(in Chinese)
[11]邱小忠,陈瑗,周玫.线粒体氧应激损伤的防御体系[J].生命的化学,2001,21(2):141-143.QIU Xiao-zhong,CHEN Yuan,ZHOU Mei,et al.Defense system for oxidative stress-associated damage of mitochondrion[J].Chemistry of Life,2001,21(2):141-143.(in Chinese)
[12]黄玉军,陈霞,顾瑞霞,等.嗜热链球菌grx02发酵乳对大鼠酒精性肝损伤保护作用的实验研究[J].营养学报,2012,34(2):164-167,171.HUANG Yu-jun,CHEN Xia,GU Rui-xia,et al.The protective effects of streptococcus thermophilus grx02 fermented milk on alcoholic liver injury in rats[J].Acta Nutrimenta Sinica,2012,34(2):164-167,171.(in Chinese)
[13]陈伟平,谢园沁,胡金鹿,等.紫心甘薯对四氯化碳、卡介苗加脂多糖诱发小鼠肝损伤的保护作用[J].食品与生物技术学报,2011,30(6):887-893.CHEN Wei-ping,XIE Yuan-qin,HU Jin-lu,et al.Protective effect of purple sweet potato on hepatic injury mice[J].Journal of Food Science and Biotechnology,2011,30(6):887-893.(in Chinese)
[14]闫冰,丁安伟,张丽.二至丸提取物对小鼠四氯化碳急性肝损伤的保护作用[J].中国中药杂志,2010,35(22):3080-3083.YAN Bing,DING An-wei,ZHANG Li.Liver protection of Erzhi Wan extract on acute hepatic injury induced by CCl4in mice[J].China Journal of Chinese Materia Medica,2010,35(22):3080-3083.(in Chinese)
[15]Turrens J F.Mitochondrial formation of reactive oxygen species[J].The Journal of Physiology,2003,552(2):335-344.
[16]汪霞,周微,李天,等.草苁蓉环烯醚萜对肝癌前病变大鼠血清标志酶及抗氧化活性的影响[J].食品科技,2010,35(7):242-245.WANG Xia,ZHOU Wei,LI Tian,et al.Effect of iridoid glucosides from Boschniakia rossica on serum marker enzymes and antioxidative activities of rat with hepatic preneoplasia[J].Food Science and Technology,2010,35(3):72-74.(in Chinese)

