米曲霉木聚糖酶N端引入二硫键对其热稳定性的影响
陈忠法, 唐存多, 汪俊卿, 吴 静, 邬敏辰*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡 214122)
木聚糖是植物细胞壁的主要结构多糖物质之一,在自然界中含量极为丰富。木聚糖酶是可将木聚糖降解成低聚木糖和木糖的一类酶的总称,能从木聚糖分子主链的内部水解β-1,4糖苷键,产物为不同长度的木寡糖和少量木糖,为木聚糖降解酶系中最关键的酶[1]。通过酶分子一级结构的序列比对和疏水簇分析,大多数木聚糖酶属于糖苷水解酶10和11家族[2]。木聚糖酶在造纸、食品、能源、饲料以及环境等领域里都有着重要的应用价值,但由于一些工艺过程如食品、饲料制粒加工等需要较高工作温度[1],而天然酶往往难以满足其生产要求,因此,如何提高木聚糖酶的热稳定性已成为广泛关注的焦点。
影响木聚糖酶热稳定性的因素很多,主要有疏水作用、氢键、离子键、二硫键、包装效应、螺旋结构等多种因素[3]。目前对于11家族木聚糖酶热稳定性提高的报道有很多是关于酶的N端的改造,例如,Duman等对一种11家族木聚糖酶的N端进行了7个定点突变,突变酶比野生酶的Tm值提高了约25℃[4];Xiong等在一种里氏木霉木聚糖酶的N端和中部β折叠处引入二硫键,突变酶DB1比野生酶在65℃时的半衰期提高约112倍[5];高树娟等把一种超耐热木聚糖酶N端前42个氨基酸替代了一种米曲霉木聚糖酶前37个氨基酸,突变酶比野生酶在70℃时的半衰期提高约197倍[6]。
作者已克隆和表达了一个来自Aspergillus oryzae的11家族常温木聚糖酶基因Aoxyn11A,该酶在常温条件下酶活性比较高,但温度大于50℃时热稳定性差[7],存在应用上的不足。通过同源建模和分子动力学模拟分析评估的基础上,采用定点突变技术,期望获得一株表达高热稳定性木聚糖酶的工程菌。
1 材料与方法
1.1 菌株、质粒和培养基
含有原始基因的重组质粒pUCm-TAoXyn11A,pPIC9KM-Aoxyn11A由作者所在实验室构建和保存;Escherichia coli DH5α、Pichia pastoris GS115和表达质粒pPIC9KM由作者所在实验室保藏;pUCm-T质粒:购自上海 Sangon公司;LB、YPD、MD、BMGY和 BMMY培养基参见 Multi-Copy Pichia Expression Kit(Invitrogen 公司)操作手册。
1.2 主要试剂
rTaq酶、T4 DNA连接酶、各种限制性内切酶、250 bp DNA Ladder Marker和低相对分子质量蛋白质Marker:购于大连TaKaRa公司;Tryptone、Yeast Extract、YNB、G418 和 EZ-10 Spin Column Plasmid Mini-Preps Kit:购自上海Sangon公司;标准木糖、榉木木聚糖、桦木木聚糖和考马斯亮蓝R-250:Sigma公司产品;其它试剂均为国产或进口分析纯。
1.3 野生型酶AoXyn11A和超耐热木聚糖酶EvXyn11TS序列的对比
超耐热酶EvXyn11TS是属于木聚糖酶11家族中热稳定性最高的酶之一[4]。作者所在实验室登录NCBI将其进行密码子优化,选择Pichia pastoris GS115偏爱型的密码子,然后人工合成了这段序列(Syxyn11,GenBank accession No.JX459567), 该优化基因在Pichia pastoris GS115中表达,测其最适温度在反应时间为15 min时为85℃,其最高酶活达到17.74 U/mL;在80℃保温60 min后,保留未热处理原酶85.9%的活性,进一步证实了该酶有很高的热稳定性[8]。本研究拟采用DNAMAN程序对木聚糖酶AoXyn11A(GenBank accession No.JQ326257)和超耐热酶EvXyn11TS进行N端氨基酸序列同源比对,希望找出与酶分子热稳定性相关的氨基酸残基。
1.4 计算机同源建模和分子动力学模拟
在Protein Data Bank数据库中进行同源搜索,寻找到3个与AoXyn11A一级结构同源性较高的、分别来源于绳状青霉菌Penicillium funiculosum(1TE1)、E.coli (2VUL) 和红褐 肉座菌 Hypocrea jecorina(1ENX)的11家族木聚糖酶晶体结构,作为同源建模的模板。同源建模在蛋白质结构服务器(http:/swissmodel.expasy.org/) 和 程 序 MODELLER 9.9(http://salilab.org/modeller/)上完成[9]。
分子动力学(MD)模拟使用GROMACS 4.0软件,采用GROMOS96力场,该力场中蛋白的立场参数数据均给予实验值拟合模拟温度为500 K,溶剂采用TIP3P水模型。对于每个模拟体系,均在溶质外围加上1.5 nm的水分子层。MD模拟之前,对体系分别进行了两次能量优化,首先约束溶质,用最陡下降法优化800步,再用共轭梯度法优化1 200步。然后去约束后再进行800步最陡下降法优化,1200步共轭梯度法优化。MD模拟分为两步:首先进行20 ps的约束溶质分子的MD模拟,此时温度从0 K逐步升高到500 K;接着进行500 ps的无约束恒温MD模拟,最后分别得到野生型酶和突变酶的均方根偏差(RMSD)值。
1.5 定点突变引入N端二硫键
1.5.1 引物的突变 根据木聚糖酶基因Aoxyn11A和目的突变位点设计引物(表1)。
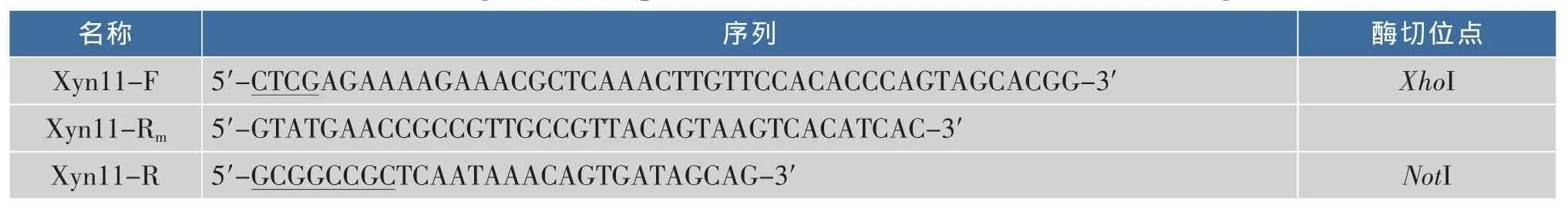
表1 引入二硫键的引物Table 1 Oligonucleotide primers for the introduction of a disulfide bridge
1.5.2 定点突变程序 (1)大引物PCR程序按照相关文献[10]的步骤操作。(2)两步PCR程序,第一步PCR:质粒pUCm-T-AoXyn11A为PCR模板,用引物Xyn11-F和Xyn11-Rm进行扩增,扩增条件:94℃预变性 5 min;94℃变性 30 s,55 ℃退火 30 s,72℃延伸30 s,30个循环;72℃延伸10 min,产物为含突变位点的N端前108个碱基。第二步PCR:取以上PCR产物,以割胶回收物为N端大引物,Xyn11-R为C端引物进行扩增。扩增条件:94℃预变性5 min;94 ℃变性 30 s,45 ℃退火 30 s,72 ℃延伸 60 s;72℃延伸10 min。回收目的基因,连接到pUCm-T载体上,获得重组质粒pUCm-T-Aoxyn11AM,对其进行测序验证。
1.6 突变酶基因表达质粒的构建
pPIC9K载体在毕赤酵母表达时,许多情况下Stel13切割Glu-Ala重复片段效率不高,Glu-Ala重复序列就留在了表达目的蛋白的N端,作者采用pPIC9KM(专利号 201110410391.0)载体,在其 N 端引入Kex2裂解位点,以保证表达目的蛋白具有天然N端[11]。将质粒pUCm-T-AoXyn11A用XhoⅠ和NotⅠ进行双酶切,回收目的片段,与经同样双酶切的质粒pPIC9KM连接,转化Escherichia coli DH5α感受态细胞,经通用引物PCR验证后,测序正确的重组质粒命名为pPIC9KM-Aoxyn11A。
1.7 野生型酶和突变酶基因在Pichia pastoris中的表达
将质粒pPIC9KM-Aoxyn11A和pPIC9KMAoxyn11AM用SacⅠ线性化后,电击转化毕赤酵母,挑取阳性转化子。电转化及筛选方法参见Invitrogen公司的操作手册。重组酵母的培养、诱导表达和检测的具体方法见文献。
1.8 木聚糖酶的活性测定
采用改进的DNS法测定木聚糖酶活性。2.4 mL质量分数0.5%榉木木聚糖溶液 (pH 5.5)加入0.1 mL适当稀释的酶液,50℃下反应10 min后,加入2.5 mL DNS试剂,沸水中显色7 min,定容后测定A540nm。在上述反应条件下,每分钟产生1 μmol还原糖所需的酶量定义为一个酶活性单位 (U)。
1.9 酶学性质分析
1.9.1 酶的最适反应温度和热稳定性 取适当稀释酶液于40~75℃水浴条件下进行酶解反应,每隔5℃测定酶活性,以最高者为100%,作温度-相对酶活性曲线;将酶液于不同温度下保温30 min后,按常规方法测定残余酶活性,以未保温处理酶液的活性定义为100%,作温度-相对酶活性曲线。反应所用的缓冲液为0.1 mol/L柠檬酸-磷酸缓冲液(pH 5.5)。
1.9.2 酶的最适pH和pH稳定性 取适当稀释酶液,温度为最适反应温度,在pH 3.0~8.5的条件下进行酶解反应,每隔0.5个pH单位测定酶活性,以最高者为100%,作pH-相对酶活性曲线;将酶在不同的pH值条件下于40℃保温1 h,再分别测定残留酶活性,以最高者为100%,作pH-相对酶活性曲线。反应所用的缓冲液为:0.1 mol/L柠檬酸-磷酸缓冲液(pH 3.5~8.0)和 0.05 mol/L 甘氨酸-氢氧化纳缓冲液(pH 8.5)。
1.9.3 酶动力学参数的测定 底物为不同浓度的桦木木聚糖溶液 (0.1 mol/L柠檬酸-磷酸缓冲液配置,pH 5.5),在酶的最适温度下测定其活性,按Lineweaver-Burk法作图,求出酶的Km和Vmax值。
2 结果与分析
2.1 米曲霉木聚糖酶和超耐热酶氨基酸序列的比对
图1序列比对显示它们的N端氨基酸残基序列相似性为43.5%,EvXyn11TS含有二硫键和糖基化位点(见图1),而后面的氨基酸残基序列的相似性在70%以上。作者拟以AoXyn11A为母本,在对应于EvXyn11TS的位置上对这两个基因进行同源建模和分子动力学模拟分析
图2显示突变酶AoXyn11AM和野生型酶AoXyn11A相比较,其N端增加一个二硫键 (C5和C32,蓝色标识),但是它的三维结构和活性中心并没有受到影响。

图1 AoXyn11A和EvXyn11TS的N端同源序列比对Fig.1 N-terminal amino acid homology alignment of AoXyn11A with EvXyn11TS
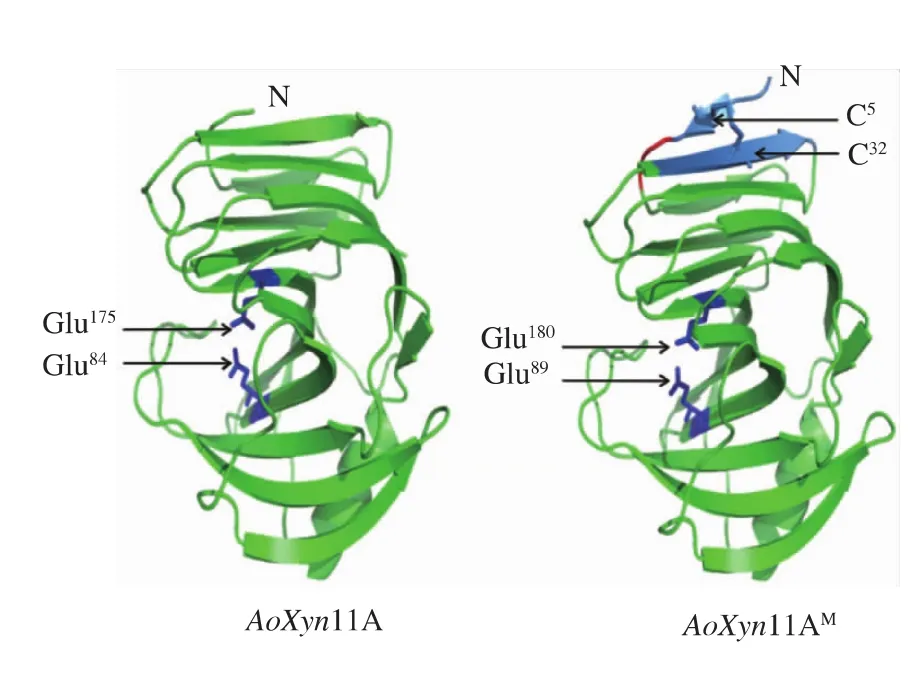
图2 通过同源建模预测的AoXyn11A和AoXyn11AM分子结构Fig.2 Predicted molecular structures of AoXyn11A and AoXyn11AMby homology modeling
分子动力学模拟显示(图3),随着模拟高温时间的延长,突变酶的RMSD值在各个时间点都低于野生型酶,预示着突变酶在模拟高温环境中变形小于野生型酶,具有更好的热稳定性。
2.2 原基因的定点突变
以原基因为模板、N端引物Xyn11-F、C端引物Xyn11-Rm经大引物PCR法扩增获得含有突变位点(Cys5-Cys32)的片段,该片段和理论长度(120 bp,图4a)相符。以该片段为N端引物,C端引物为Xyn11-R进行PCR,获得目的片段Aoxyn11AM与理论长度(602 bp,图4b)相符。把目的片段克隆进pUCm-T载体,挑选阳性克隆子经测序验证,证明重组质粒pUCm-T-Aoxyn11AM含有目的基因。
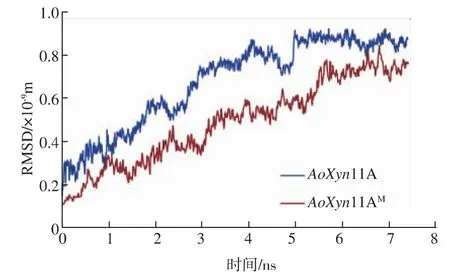
图3 AoXyn11A和AoXyn11AM的RMSDFig.3 RMSD values of AoXyn11A and AoXyn11AM
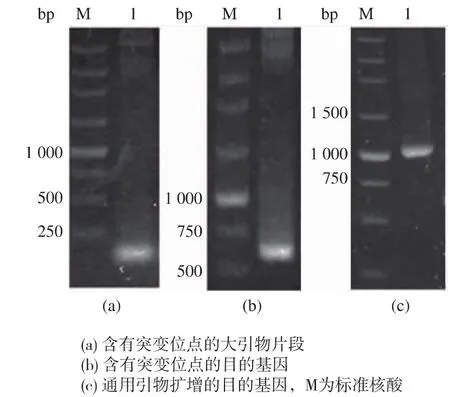
图4 定点突变过程Fig.4 Process of site-directed mutagenesises
2.3 重组表达质粒pPIC9KM-Aoxyn11AM的构建
按照1.6的方法构建重组表达质粒,经通用引物PCR扩增,目的条带与理论长度 (1 076 bp,图4c)相符,测序正确的重组质粒命名为pPIC9KMAoxyn11AM。
2.4 野生型酶和突变酶基因在Pichia pastoris中的表达
野生型酶和突变酶的理论相对分子质量分别为20 700和21 200,与图5显示的蛋白质相对分子质量大致相符,表明野生型酶和突变酶基因在毕赤酵母中得到了精确的表达。
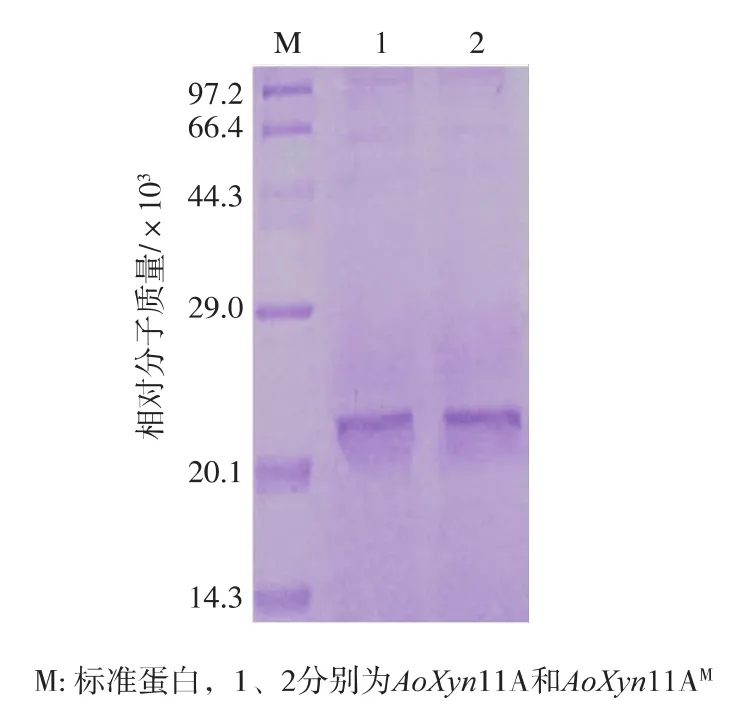
图5 AoXyn11A和AoXyn11AM在毕赤酵母中表达后的SDS-PAGE分析Fig.5 SDS-PAGE analysis of AoXyn11A and AoXyn11AM expressed in Pichia pastoris GS115
2.5 重组木聚糖酶酶学性质
2.5.1 最适反应温度与热稳定性 在1.9描述的方法和条件下,反应时间为10 min时,图6显示野生型酶的最适反应温度为55℃,此时该酶的最大酶活性为333 U/mL;突变酶的最适反应温度为60℃,此时该酶的最大酶活性为250 U/mL。随着温度升高,高温使酶蛋白逐渐变性而失活,引起酶反应速率下降,在55~75℃这一区间,由于N端引入了二硫键,其形成对构象起稳定作用,使突变酶表现出较好的稳定性,其变性慢于野生型酶,因而表现出相对较高的相对酶活性,这一结果和分子模拟比对是一致的。
把这两种酶置于不同的温度中保温30 min后,由图7显示,随着温度的升高,突变酶的相对酶活性一直高于野生型酶,表明该二硫键使突变酶具有更好的热稳定性。
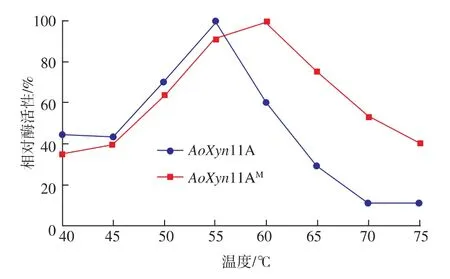
图6 温度对AoXyn11A和AoXyn11AM活性的影响Fig.6 Effectsoftemperatureson theactivitiesof AoXyn11 and AoXyn11AM
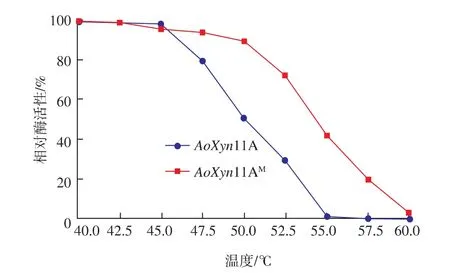
图7 温度对AoXyn11A和AoXyn11AM热稳定性的影响Fig.7 Effects of temperatures on the thermostability of AoXyn11A and AoXyn11AM
2.5.2 酶的最适pH与pH稳定性 图8显示这两种酶的最适pH集中在pH 5~6之间,pH稳定性测试结果也大致相同,说明突变酶的酸碱耐受性变化不大。
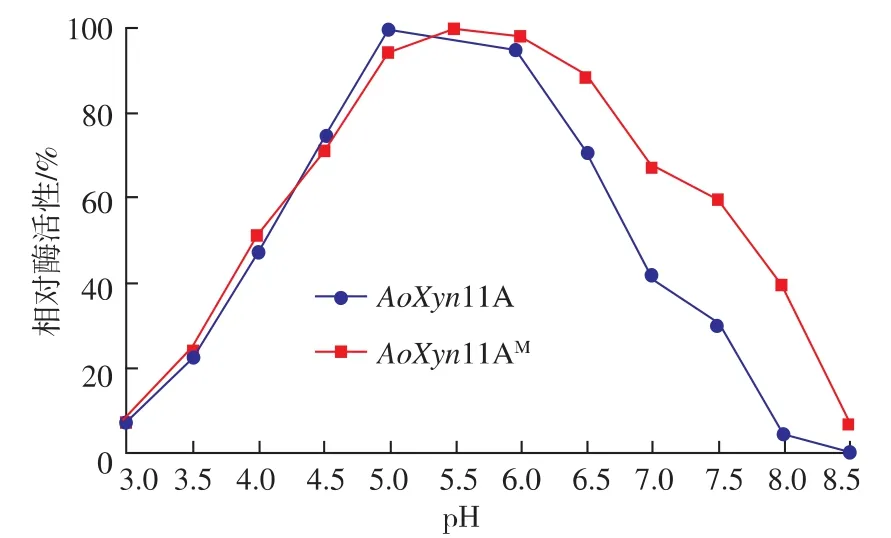
图8 pH对AoXyn11A和AoXyn11AM活性的影响Fig.8 Effects of pH on the activities of AoXyn11A and AoXyn11AM
2.5.3 酶的比酶活和Km在1.9的方法和条件下,测得野生型酶的比酶活为3 490 U/mg,Km为7.67 mg/mL;突变酶的比酶活为2480 U/mg,Km为2.75 mg/mL。对这一现象的推测是由于突变酶引入了二硫键而具有较好的稳定性,在适量的底物浓度时,和底物结合更加紧密和快速,表现出低的Km值;当底物浓度超过一定量时,野生型酶由于整体柔性较好,能够随着底物量的增多而舒展结构,结合更多的底物并参加反应,表现出高的Vmax。
3 结语
自然界酶的种类虽然比较多,但是全球飞速发展的经济对生物催化提出各不相同的要求。分析某个催化过程,利用基因工程手段对酶进行定点突变,从而改变酶的特定的酶学性质,使目的催化过程以最经济、最环保的方式完成,这对于我国加快经济结构转型,抢占技术至高点具有重要意义。通过目的酶和耐热酶的序列比对能够有效的确定具有“热稳定效应”的氨基酸残基和相关的模式结构,提示了生物大分子对温度的进化适应,但是通常情况下只有一小部分的氨基酸的突变能够提高热稳定性,绝大部分的突变仅仅是“基因漂移”的结果。依靠计算机辅助设计,如同源建模、分子模拟等方法可以使我们更有效的预测出与酶热稳定性相关的那部分氨基酸,从而使实验设计更具针对性。
通过计算机分析为先导再开展实验,分析和实验结果的一致性表明了作者实验方法的有效性。突变酶比酶活虽有一定的下降,但是具有更高的热稳定性和较好的底物亲和力(低的Km值),有很大的应用潜力。
[1]Collins T,Gerday C,Feller G.Xylanases,xylanase families and extremophilic xylanases[J].FEMS Microbiol Rev,2005,29:3-23.
[2]Polizeli M L T M,Rizzatti A C S,Monti R,et al.Xylanases from fungi:properties and industrial applications[J].Appl Microbiol Biotechnol,2005,67:577-591.
[3]Kumar S,Tsai C J,Nussinov R.Factors enhancing protein thermostability[J].Protein Eng,2000,13:179-191.
[4]Dumon C,Varvak A,Wall M A,et al.Engineering Hyperthermostability into a GH11 Xylanase Is Mediated by Subtle Changes to Protein Structure[J].Biol Chem,2008,283:22557-22564.
[5]Xiong H R,Fenel F,Leisola M,et al.Engineering the thermostability of Trichoderma reesei endo-1,4-b-xylanase II by combination of disulfide bridges[J].Extremophiles,2004,8:393-400.
[6]Gao S J,Wang J Q,Wu M C,et al.Engineering hyperthermostability into a mesophilic family 11 xylanase from Aspergillus oryzae by in silico design of N-terminus[J].Biotechnol Bioeng,2013,110:1028-1038.
[7]高树娟,汪俊卿,邬敏辰,等.N端二硫键对11家族木聚糖酶热稳定性的影响[J].生物工程学报,2012,28:1441-1449.GAO Shu-juan,WANG Jun-qing,WU Mmin-chen,et al.Effect of the N-terminal disulfide bridge on the thermostability of family 11 xylanases[J].Chin J Biotech,2012,28:1441-1449.(in Chinese)
[8]张慧敏,李剑芳,邬敏辰,等.耐热木聚糖酶基因在毕赤酵母中的表达及酶学性质[J].食品与生物技术学报,2013,32:124-128.ZHANG Hui-min,LI Jian-fang,WU Min-chen,et al.Expression of a thermostable xylanase gene in Pichia pastoris and its enzymatic characterization[J].J Food Sci Biotechnol,2013,32:124-128.(in Chinese)
[9]Eswar N,Eramian D,Webb B,et al.Protein structure modeling with Modeller[J].Methods Mol Biol,2008,426:145-159.
[10]朱玉贤,李毅.现代分子生物学(第二版)[M].北京:高等教育出版社,2006.
[11]申艳敏,魏建超,尚书文,等.人源抗菌肽LL-37在毕赤酵母中的高效表达及其活性检测[J].微生物学通报,2008,35:539-544.SHEN Yan-min,WEI Jian-chao,SHEN Shu-wen,et al.High expression of the human antibacterial peptide LL-37 in Pichia pastoris and the detection of its activity[J].Microbiology,2008,35:539-544.(in Chinese)
[12]王鹏,赵颖,朱平,等.人β-分泌酶(BACE1)在毕赤酵母中分泌表达及纯化[J].生物工程学报,2011,27:1655-1666.WANG Peng,ZHAO Yin,ZHU Pin,et al.Expression and purification of human β-secretase (BACE1) in Pichia pastoris[J].Chin J Biotech,2011,27:1655-1666.(in Chinese)

