手性蒽基苯酚醚的合成及其分子开关研究
彭丽芝, 刘文杰, 周子群, 何雪玉, 陈燕榆, 郭煜林
(广东药学院 医药化工学院, 广东 广州 510006)
0 引言
手性光开关材料由于在信息存储、分子光学器件等方面的应用而引起了人们的重视[1-5].蒽及其衍生物的光化学反应做为光开关材料已被广泛地研究[6-8].曹德榕等[9,10]首次报道了蒽环与3,5-二烷基苯通过-CH2OCH2-连接的化合物,在光照下可以发生蒽环与苯环的光致可逆环加成反应,而且反应是定量进行的,这种光致可逆反应是典型的分子光开关过程,可以用作分子开关器件的研究.
非手性的分子光开关材料在信息的存储过程中会破坏信息的读取,而手性分子光开关材料通过检测光关过程手性的变化,从而实现了信息无破坏读取[1].为进一步研究蒽环和苯环光反应在有机合成和材料科学中的应用,我们合成了含有手性源的苯基蒽环衍生物,研究了可逆光致环加成反应,及其光开关过程中NMR的变化,并对光致环加成机理进行了讨论.
1 实验部分
1.1 试剂和仪器
仪器:熔点用Tektronix X4 显微熔点仪测定(温度计未经校正);1H NMR (400 MHz)和13C NMR (100 MHz)谱图用Bruker DRX-400核磁共振仪测定(内标TMS);Philips中压汞灯(400 w);Duran样品管.
试剂:S-(+)-2-甲基-1-溴丁烷(Aldrich),9-氯甲基蒽及其它试剂均为分析纯.
1.2 合成步骤
1.2.1 3-羟基-5-苄氧基苄醇(2)的合成[11]
参考文献[11]的合成方法,将2.8 g(20 mmol)3,5-二羟基苄醇溶于50 mL丙酮中,加入2.74 g(20 mmol)无水K2CO3,30 mg(0.1 mmol) 18-crown-6,缓慢滴加含有2.66 g(21 mmol)氯化苄的20 mL丙酮溶液,氮气保护下加热回流12 h, 冷却至室温,过滤,滤饼用丙酮洗涤,减压蒸除溶剂后,经柱层析分离纯化[V(石油醚)∶V(乙酸乙酯)=2∶1],得到1.74 g化合物2,收率38%.
1.2.2 3-((S)-2-甲基丁氧基)-5-苄氧基苄醇(3)的合成
1.38 g (6 mmol)3-羟基-5-苄氧基苄醇溶于20 mL DMF,加入0.41 g(82%,6 mmol)KOH, 25 mg(0.15 mmol)碘化钾,1 g(6.6 mmol)S-(+)-2-甲基-1-溴丁烷,氮气保护下60 ℃反应24 h,冷却至室温,加入20 mL 水,用乙酸乙酯萃取,分液,有机相用饱和食盐水洗涤,无水硫酸钠干燥.蒸除溶剂,粗产物经柱层析分离纯化[V(石油醚)∶V(乙酸乙酯)=4∶1],得到无色粘稠液体1.21 g, 收率67%.

1.2.3 9-(3-((S)-2-甲基丁氧基)-5-苄氧基苄基氧甲基)蒽(4)的合成
330 mg (1.1 mmol)3-((S)-2-甲基丁氧基) 5-苄氧基苄醇和226 mg(1 mmol)9-氯甲基蒽溶于10 mL氯苯,加入50 mgn-Bu4NBr,0.5 mL水,75 mg (82%,1.1 mmol)KOH,氮气保护下60 ℃反应48 h,冷却至室温,加入二氯甲烷和水,分液,水层用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥.蒸除溶剂,残余物经柱层析分离纯化[V(石油醚)∶V(乙酸乙酯)=15∶1],得到白色固体381 mg, 收率78%.
1.2.4 环加成产物5和5′的合成
在Duran样品管中,15 mg(0.03 mmol, 3.1×10-3mol/L)9-(3-((S)-2-甲基丁氧基)-5-苄氧基苄基氧甲基)蒽(4)溶于10 mL 苯,通氩气20 min,冰水浴控温5 ℃,氩气氛下紫外光(λ≥ 300 nm)照射1 min,蒸除溶剂后定量地得到光致环加成产物7-苄氧基-22-((3S)-3-甲基丁氧基)-3-氧杂六环[7.6.6.25,8.01,5.010,15.016,21]二十三6,10,12,14,16,18, 20,22-辛烯((5S,8S,3′S)-5和(5R, 8R, 3′S)-5′).
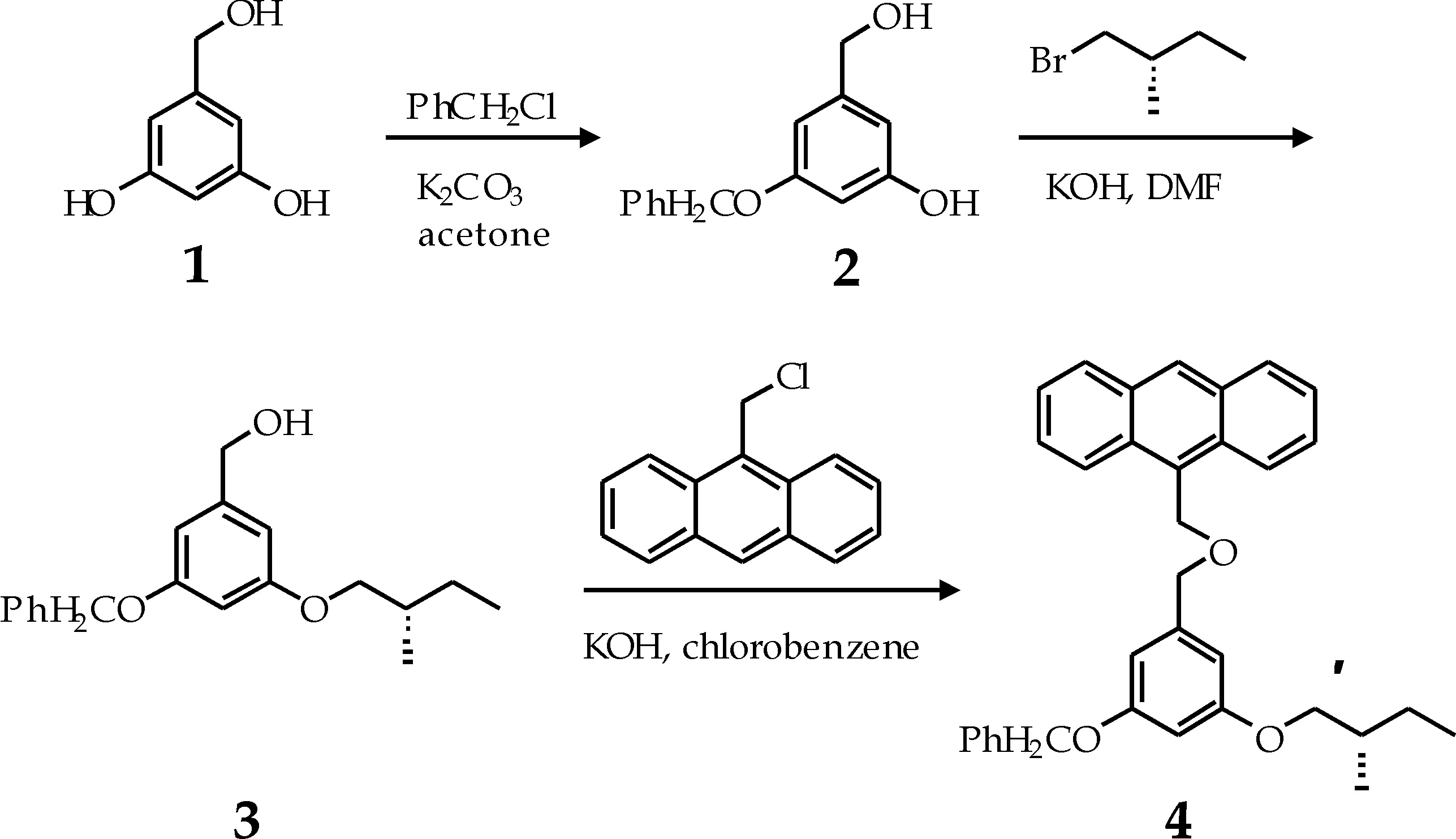
图1 化合物4的合成路线
2 结果与讨论
如图1所示,从3,5-二羟基苄醇出发,经过对两个酚羟基的不对称醚化,引入手性源S-(+)-2-甲基-1-溴丁烷,再和9-氯甲基蒽在相转移催化剂存在下反应,生成手性的苯基蒽环化合物4.化合物4在稀的苯溶液中(c≈10-3mol/L),在紫外光(λ≥ 300 nm)照射下没有发生蒽环与蒽环之间的二聚体,也没有发生蒽环与苯环之间的分子间环加成反应,而是定量地得到蒽环与苯环之间的分子内光致环加成产物.蒽环与苯环的环加成反应可能是朝两个不同的方向合环(如图2所示),由于受到手性源的作用产生了两种化合物.因为朝两个方向合环的几率是相等的,所以化合物5和5'的量也是1∶1,经过核磁共振测试也验证了此结果.

图2 化合物45(5′)可逆的光致环加成过程
化合物5和5′破坏了蒽环和苯环的芳香性,是富能量的,在波长λ= 254 nm的紫外光照射或热的作用下(T > 60 ℃)发生逆反应,定量地转变成低能量的原料.在这种分子内光致可逆反应过程中,化合物的旋光度发生了变化,可以用作光开关过程的输出信号,实现信息的无破坏读出,这是典型的手性光开关过程,可以用于光开关材料的研究和制备.
可以推测其光致环加成反应为光致电子转移的过程(photo-electron-transfer).光致电子转移是指电子给体或者电子受体首先受光激发,激发态的电子给体与电子受体之间或者电子给体与激发态的电子受体之间的电子转移反应[12].如图3所示,化合物4中,苯环在3,5-位有供电子的烷氧基取代,使得苯环4-位的电子云密度大大增加,受到365 nm紫外光的激发后,苯环作为电子给体(D)和电子受体(A)蒽环形成分子内的激基复合物,或再形成具有偶极共价的中间体,通过分子内的电子转移而形成相对稳定的环加成产物.
3 结论
通过Williamson醚化反应引入手性源S(+)-2-甲基-1-溴丁烷,合成了手性蒽基苯酚醚化合物4.研究发现,化合物4在稀苯溶液中,经过365 nm紫外光照射后,发生了蒽环与苯环的分子内[4π+4π]光致环加成反应,富能量的光致环加成产物在254 nm紫外光或热的作用下(T> 60 ℃)开环,可以利用NMR和旋光度的变化检测化合物45(5′)的光开关过程,这种分子内可逆的光致环加成反应可用于手性光开关材料的研究和制备.
[1] Feringa B.L.,Van Delden R.A.,Koumura N.,et al.Chiroptical molecular switches[J].Chem.Rev.,2000,100(5):1 789-1 816.
[2] Canary J.W.,Mortezaei S.,Liang J.Transition metal-based chiroptical switches for nanoscale electronics and sensors[J].Coord.Chem.Rev.,2010,254(19-20):2 249-2 266.
[3] Chen W.C.,Lee Y.W.,Chen C.T.Diastereoselective,synergistic dual-mode optical switch with integrated chirochromic helicene and photochromic bis-azobenzene moieties[J].Org.Lett.,2010,12(7),1 472-1 475.
[4] Takaishi K,Kawamoto M,Tsubaki K,et al.Helical chirality of azobenzenes induced by an intramolecular chiral axis and potential as chiroptical switches[J].Chem.Eur.J.,2011,17(6):1 778-1 782..
[5] Takaishi K.,Muranaka A.,Kawamoto M.,et al.Photoinversion of cisoid/transoid binaphthyls[J].Org.Lett.,2012,14(1),276-279.
[6] Bouas-Laurent H.,Castellan A.,Desvergne J.P.,et al.Photodimerization of anthracenes in fluid solution:structural aspects[J].Chem.Soc.Rev.,2000,29(1):43-55.
[7] Bouas-Laurent H.,Castellan A.,Desvergne J.P.,et al.Photodimerization of anthracenes in fluid solutions:(part 2) mechanistic aspects of the photocycloaddition and of the photochemical and thermal cleavage[J].Chem.Soc.Rev.,2001,30(4):248-263.
[8] Wang C.,Zhu L.Y.,Xiang J.F.,et al.Chiral molecular switches based on binaphthalene molecules with anthracene moieties:CD signal due to interchromophoric exciton coupling and modulation of the CD spectrum[J].J.Org.Chem.,2007,72(12):4 306-4 312.
[9] Cao D.R.,Dobis S.,Meier H.Intramolecular photocycloaddition of anthracene and benzene ring systems[J].Tetrahedron Lett.,2002,43(38):6 853-6 855.
[10] Cao D.R.,Dobis S,Gao C.M.,et al.Optical switching and antenna effect of dendrimers with an anthracene core[J].Chem.Eur.J.,2007,13(13):9 317-9 323.
[11] Nantalaksakul A.,Dasari R.R.,Ahn T.S.,et al.Dendrimer analogues of linear molecules to evaluate energy and charge-transfer properties[J].Organic Letters,2006,8(14):2 981-2 984.
[12] 樊美公.光化学基本原理与光子学材料科学[M].北京:科学出版社,2001:187-259

