杉木炭疽病拮抗菌HY32的筛选及其应用
路宗岩 周国英 陈玉华 闫法领 闫瑞坤 伍南
(中南林业科技大学林学院,长沙 410004)
杉木(Cunninghamia lanceolata)是我国南方主要的丰产速生用材树种,在江西、湖南、四川等多个省(区)均有种植[1]。炭疽菌是一种地理位置分布广泛、寄主繁多的真菌,可侵害多种树木,尤其对一些丰产速生林可以造成严重危害[2,3]。杉木炭疽病是杉木种植区主要发生病害,几乎有杉木的地方就有炭疽病发生,且以低山丘陵地区人工幼林更严重,常大面积发生。病轻时会导致杉木幼苗的针叶或嫩梢变褐枯萎,严重时常会造成杉木幼林成片的枯黄、枯死,对其造成了毁灭性的损害[1-3]。该病菌的抗药性很强,目前防治杉木炭疽病的化学杀菌剂都很难防治该病[4,5]。因此需要寻找一种高效安全的防病方法,来控制和预防该病在杉木上的扩散。利用生防细菌或其代谢产物防治植物病害,使寄主植物周围的有益和有害微生物达到平衡,从而起到防病增产目的,已经成为国内外在生物防治研究中的热点话题[6,7]。本课题组在湖南攸县杉木生产基地分别采集感病和健康的杉枝,分离获得杉木炭疽病病原菌,筛选出一株高效防治杉木炭疽病的拮抗菌,旨在为杉木炭疽病的防治提供菌种资源,并为其有效的生物防治打下基础。
1 材料与方法
1.1 材料
病原菌取自攸县发病杉木枝条,典型病状的新鲜杉木炭疽病枝。
1.2 方法
1.2.1 病原菌的分离与鉴定
1.2.1.1 病原菌的分离与形态特征观察 从攸县采集发病杉木枝条,取典型症状的新鲜杉木炭疽病枝,用组织分离法进行病原菌的分离,采用常规法进行纯化和保存。将保存菌种接种在PDA平板上,28℃培养,观察菌落形态和颜色及其显微形态,照相记录。参照真菌形态学鉴定手册[8],初步判断分离所得菌的种类。
1.2.1.2 病原菌的致病性测定 使用科赫法则对分离菌株进行致病性测定[9]。
1.2.1.3 病原菌rDNA-ITS的扩增与序列分析 采用常规CTAB法[10]用DNA提取试剂盒(北京天根生化科技有限公司)提取病原菌基因组DNA。将DNA产物送至南京金斯瑞生物科技有限公司进行纯化测序。并把测序结果与GenBank数据库中已知序列进行blast同源性检测分析。利用MEGA5软件以rDNA-ITS相似序列构建系统发育树。
1.2.2 炭疽病拮抗细菌的分离与筛选
1.2.2.1 叶表细菌的分离与纯化 采集健康杉枝,用无菌水过夜浸泡杉叶,用稀释法分离杉叶表面细菌,28℃培养、48 h 后记录菌量,并根据菌落形态、颜色和大小选取,并进行纯化,共分离6个批次细菌。采用常规法进行纯化和保存。
1.2.2.2 拮抗细菌的筛选 初筛:采用平板对峙法[4],将培养6 d的病原菌菌丝块(d=6 mm)接种于PDA平板中央,采用十字交叉法在离菌块中心30 mm处接种待测内生菌,每菌株接种4点,以接种灭菌培养基为对照。每次试验设置3次重复。28℃恒温培养36 h后,测量病原菌菌落直径和抑菌带宽度,计算拮抗菌对病菌菌丝生长的抑菌率。
复筛:采用发酵法[11]进行复筛。将初筛选出的拮抗菌株分别在NA培养基(牛肉膏蛋白胨固体培养基)上培养 2 d后,接种到50 mL NB培养液(牛肉膏蛋白胨液体培养基)的三角瓶中(250 mL),28℃、180 r/min摇床振荡培养 48 h。发酵液用0.22 μm细菌过滤器过滤得到发酵滤液,将滤液与约50℃ PDA 培养基按 1∶19混匀倒入平板,冷却后在平板中央放入d=6 mm的炭疽菌菌饼,4 d后测量病菌菌落直径,以无菌水为对照。每次试验设置3次重复。
1.2.2.3 拮抗细菌抗菌谱的测定 采用平板对峙法[4],在离病原菌菌块中心3 cm处接待测拮抗细菌,接种4点;以中央只接病原菌,周围不接生防菌做对照;28℃培养6 d。每处理3次重复。记录拮抗菌对各供试病菌的抑菌效果。供试4种病原菌,即油茶炭疽病、油茶软腐病菌、油茶根腐病和油茶叶枯病菌(由经济林培育与保护教育部重点实验室提供)。
1.2.2.4 室内盆栽试验 对杉木幼苗进行室内盆栽试验。取拮抗菌发酵液(菌体浓度>6.0×1010CFU/mL),用无菌水稀释成100倍、500倍、1 000倍3个梯度,用喷洒的接种方法进行杉木炭疽病的防治试验。先在保湿条件下接种供试病原菌,48 h后在植株上喷施拮抗菌的发酵液,25℃保湿条件下培养。设置2个对照,CK1用无菌水,CK2用75%多菌灵500倍稀释液作为对照。每处理3株,重复3次。逐株记录病情,并计算发病率和病情指数。杉木炭疽病病情的分级标准参照曾大鹏等[12]的报道。
2 结果
2.1 炭疽病病原菌的鉴定结果
2.1.1 病原菌的分离与形态特征观察 从感病针叶的病健交界处分离纯化到一株明显优势菌落,命名为CSUFTCC F0101。该菌于28℃培养6 d后,菌落呈圆形,直径达70.00 mm左右,正面为灰白色,背面呈浅墨绿色并有同心轮纹;随菌龄增加颜色逐渐加深;菌丝疏松绒毛状,气生菌丝发达,菌落表面有桔红色的分生孢子堆(图1)。在显微镜下观察其孢子形态:分生孢子梗短,基部色较深,厚壁,有分隔。孢子无色,单细胞,椭圆形,两端钝圆。初步判定该菌是杉木炭疽病的病原菌。
2.1.2 病原菌致病性测定 接种5 d后,杉枝均开始出现不规则的病斑,开始较小呈橙黄色,随后病斑自烫伤处向针叶四周扩展,颜色也变成暗褐色,且针叶上有子实体和分生孢子堆产生。切断针叶后,叶尖端先变黄枯死,然后向下方逐渐扩展到茎,最
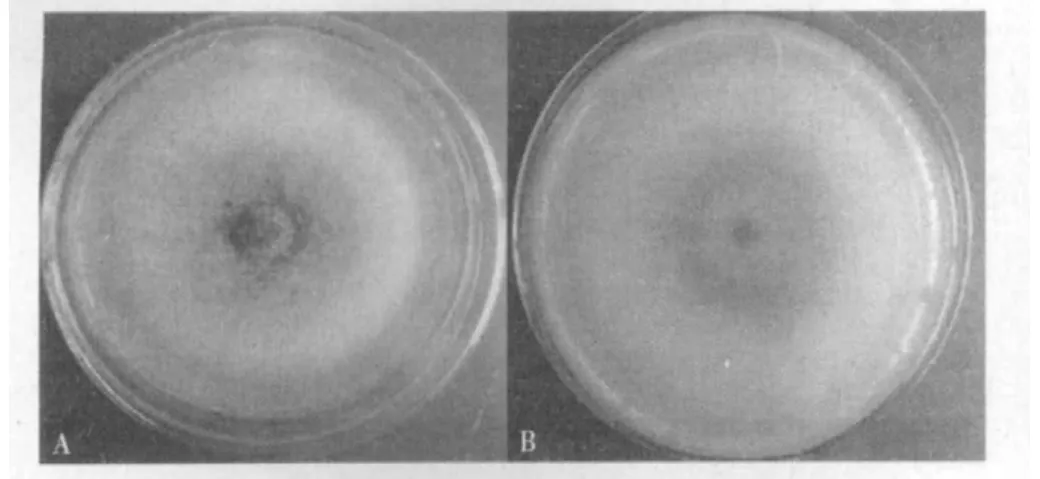
图1 杉木炭疽病病原菌菌落特征
2.1.3 病原菌rDNA-ITS的扩增和序列分析结果 用rDNA-ITS的通用引物对ITS1/ITS4对病原菌总DNA进行PCR扩增,将测得的ITS序列与GenBank上的序列进行blast比对,结果表明,CSUFTCC F0101菌株的rDNA-ITS序列与菌株Cg-210(GenBank登录号HQ264179)的相似性高达100%。下载GenBank等数据库中同源性的ITS序列,然后与本试验所测的ITS序列进行对位排列,利用MEGA5软件以rDNAITS 相似序列构建系统发育树(图3)。从系统发育树中可以看出,CSUFTCC F0101菌株与菌株Cg-210(GenBank 登录号HQ264179)和菌株M-50(GenBank登录号JX258798)以95%的置信度聚在一支上,亲缘关系最近。确证该病菌是杉木炭疽病的病原菌,即胶孢炭疽菌(Colletotrichum gloeosporioides)。
2.2 拮抗细菌的筛选结果
2.2.1 拮抗细菌的初筛 试验结果表明,从湖南攸县杉木叶表上共分离获得45株细菌。以杉木炭疽病病原菌为指示菌,筛选出抑菌带宽度≥4 mm 的菌 株 有 10株, 依 次 为 HY2、HY6、HY10、HY13、HY24、HY27、HY30、HY32、HY41 和 HY43(表 1)。
2.2.2 拮抗细菌的复筛 结果(表2)表明,初筛获得的抑菌带宽度≥4 mm 的10株菌经发酵法复筛,其发酵液对供试病原菌的抑制率均>60%,其中以HY32菌株的抑制率最高为81.7%,能够明显抑制病菌的生长。可以看出,在固体培养基与液体培养基中,10株拮抗菌产生的代谢物质的量是不一样的,二者后使整个嫩茎枯死(图2)。其发病症状与自然条件下相同。对照组未出现发病症状。由此推断,该病菌是引起杉木炭疽病的致病菌。间没有对应关系。菌体本身的拮抗活性明显比拮抗菌的无菌滤液高,因为拮抗菌HY32不论是菌体本身还是菌株培养物的无菌滤液,都能有效抑制杉木炭疽菌的生长,故将HY32作为杉木炭疽病的拮抗菌株,进行下一步的试验。

图 2 接种 5 d 后杉木枝条的发病症状
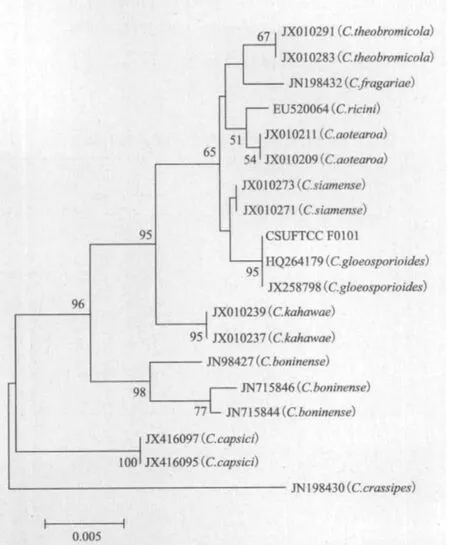
图3 CSUFTCC F0101的rDNA-ITS系统发育树
2.2.3 拮抗菌HY32的形态特征 拮抗菌HY32菌株在牛肉膏蛋白胨培养基上生长,菌落呈乳白色,圆形或近圆形,边缘较整齐,表面湿润,且有金属光泽,菌落直径一般2-3 mm,培养初期菌落中央有褶皱产生,随着菌龄的增加,褶皱逐渐消失,最后变成液体状。在显微镜下观察发现,菌体杆状,芽孢端生,革兰氏染色阴性(图4)。

表1 拮抗细菌对杉木炭疽病菌的抑制作用
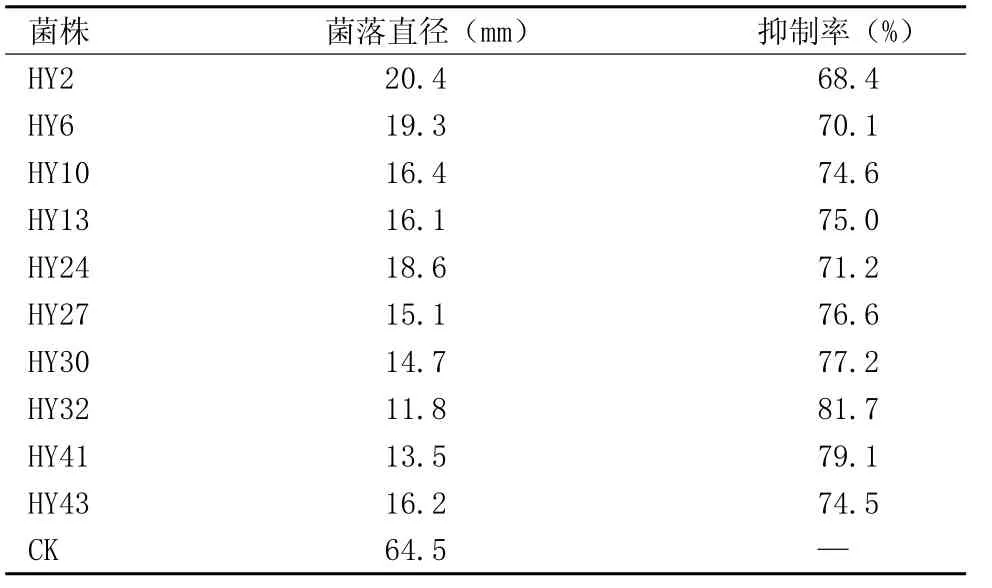
表2 拮抗细菌发酵液对杉木炭疽病菌的抑制作用
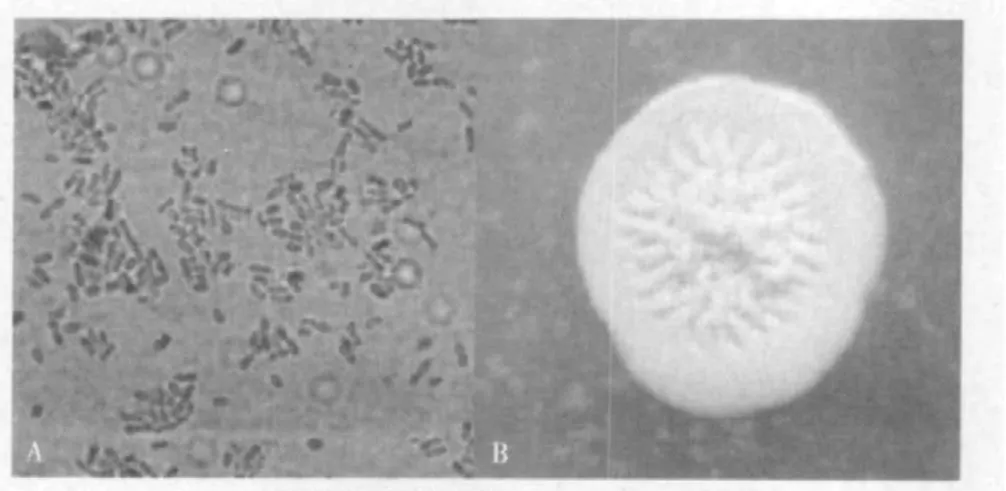
图4 HY32的形态特征
2.2.4 抗菌谱试验结果 表3表明,拮抗菌HY32对供试的4种植物病原真菌,即油茶软腐病、油茶炭疽病、油茶根腐病及油茶叶枯病均有抑制作用,菌丝生长抑制率为58.2%-71.4%。其中,对油茶炭疽病菌、油茶软腐病菌的抑菌效果较好,抑制率分别为71.4%和65.9%。可见,拮抗菌HY32对植物病原真菌具有较广谱的拮抗活性,有很好的生物防治应用前景。

表3 拮抗菌HY32对不同植物病原菌的抑制作用
2.2.5 室内盆栽试验结果 盆栽试验结果(表4)表明,通过初筛、复筛得到的潜在生防菌株HY32,实现了预期的生防效果,对杉木炭疽病有较好的防治效果,使其病情指数明显降低。发酵液100倍稀释液的防治效果比化学农药多菌灵好,500倍稀释液的治疗效果是61.7%,100倍稀释液的防治效果是65.4%。与对照多菌灵比,拮抗菌HY32的发酵液对杉木炭疽病的防治效果有明显优势。
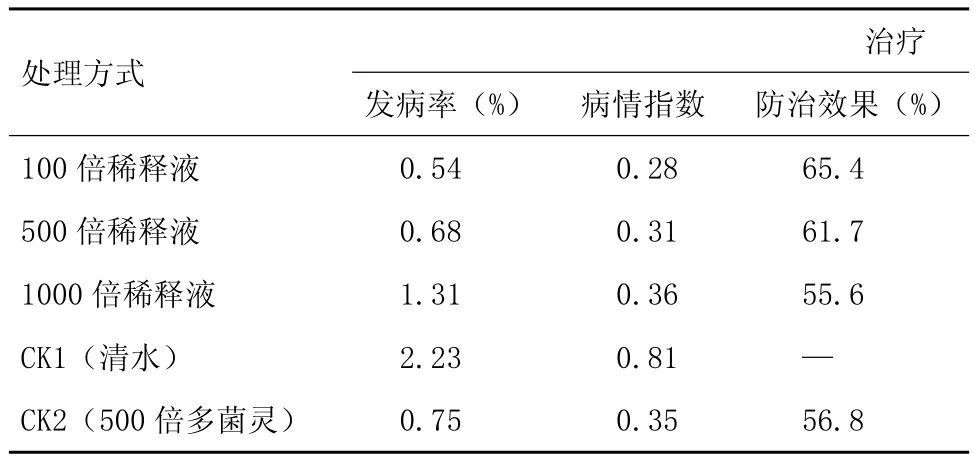
表4 HY32发酵液对杉木炭疽病的盆栽防治效果
3 讨论
随着环境恶化和致病菌耐药性的增强,从自然界中分离筛选植物病害生防菌,具有广阔的研究及应用价值,应进一步的加强研究。拮抗菌活性一般以抑菌带的宽度作评价指标,但抑菌带并不能很好地反应拮抗菌的抑菌效果,因为拮抗菌的抑菌效果和抑菌带宽窄不完全成正相关,所以本试验利用平板对峙法和发酵液法筛选拮抗菌株,并在杉木幼苗上进行测试。
笔者从杉木叶片表面分离到的生防菌HY32对杉木炭疽菌有较强的拮抗活性,初步鉴定该菌株为芽孢杆菌。芽孢杆菌是植物微生态中的优势种群,有较强的防病抗菌作用,分布广泛、易分离与培养,且其芽孢对酸碱度、高温等外界因素的抗逆性较强,所以在加工微生物菌剂和选择剂型上,产芽孢细菌比非产芽孢细菌(如假单胞菌)有更多优势,更适于生产加工和贮藏[14-16]。在试验过程中特别注意了生防菌HY32发酵液的使用,发现新鲜发酵液具有较稳定的防治效果;反之,将其放置一段时间后,防治效果则不理想,这可能是发酵液的活菌数、菌活力及其代谢物质会随时间发生变化,从而影响其防治效果。该菌株发酵液原液的防病效果要比其他浓度的好,因此其优化培养条件尚待研究。另外,拮抗细菌用作控制病原菌的方式大致有拮抗作用、竞争作用、寄生作用、诱导系统抗性等[17],生防菌HY32的抑菌结果是造成病原菌菌丝扭曲、断裂、膨大、抑制孢子萌发等,与卢丽俐等[11]对油茶炭疽病,郝华坤等[19]对棉花黄、枯萎病的抑菌结果基本一致。虽然该菌对杉木炭疽病具有一定的防治效果,但是不太稳定,是否能应用于生产,还需要对该菌的作用机制、定殖能力等作进一步的系统研究。
4 结论
本试验从杉木炭疽病叶分离到了CSUFTCC F0101菌株,通过科赫法则与分子鉴定,结果表明,该菌株为杉木炭疽病的致病菌(胶孢炭疽菌)。以该病菌作为指示菌,将从杉木叶片表面分离到的45株细菌,经过平板对峙初筛,筛选到10株对杉木炭疽菌有较强抑菌活性的菌株,在进一步的发酵液复筛,筛选到一株对杉木炭疽菌具有明显拮抗效果的菌株HY32,其发酵液对杉木炭疽菌的抑制率为81.7%,通过培养形状和形态观察,初步鉴定该菌株属于芽孢杆菌。在室内盆栽试验中,HY32菌株的防治效果达到60%以上。另外,该菌具有一定的广谱抗性,对油茶炭疽病菌、油茶软腐病菌、油茶根腐病菌、油茶叶枯病菌均有较强抑制作用,尤其对油茶炭疽病菌的作用显著,抑菌率达到71.4%。
[1] 王霞, 尹士海, 李改英, 等.杉木炭疽病及细菌性叶枯病的诊断与防治[J].现代农村科技, 2012(8):32-33.
[2] 靳爱仙, 周国英, 李河.油茶炭疽病的研究现状、问题与方向[J].中国森林病虫, 2009, 2(28):27-31.
[3] 李传道, 朱熙樵, 石峰云.杉木炭疽病的研究Ⅰ、病原菌的鉴定[J].南京林产工业学院学报, 1980(3):28-33.
[4] 朱宏建, 欧阳小燕, 周倩, 等.一株辣椒尖孢炭疽病菌拮抗菌株的分离鉴定与发酵条件优化[J].植物病理学报, 2012, 4(42):418-424.
[5] 许彦君, 刘海龙, 刘新晶.细菌对植物病害生物防治研究进展[J].大豆科技, 2011(5):18-23.
[6] Babu BK, Saxena AK, et al. Identification and detection ofMacrophomina phaseolinaby using species-specific oligouncleotide primers and probe[J]. Mycologia, 2007, 99(6):797-803.
[7] Crous PW, Slippers B, et al. Phylogenetic lineages inBotryosphaeriaceae[J]. Studies in Mycology, 2006, 55(1):235-253.
[8] 陆家云.植物病原真菌学[M].北京:中国农业出版社,2001:450-533.
[9] 方中达.植病研究方法[M].北京:中国农业出版社, 1998:122-124.
[10] Hillis DM, Moritz CM, Mable BK. Molecular systematics [M].Massachusetts:Sinauer Associates, 1990:411-501.
[11] 卢丽俐.油茶炭疽病拮抗内生细菌的筛选、发酵及抑菌机理研究[D].长沙:中南林业科技大学, 2009.
[12] 曾大鹏, 刘开玲, 贺正兴, 等.杉木炭疽病的研究[J]. 林业科学, 1981(3):250-255.
[13] Brady SF, Singh MP, Janso JE, et al. Cytoskyrins A and B, new BIA active bisanthraquinones isolated from an endophytic fungus[J].Organic Letters, 2002, 2(25):4047-4049.
[14] 黄云.植物病害生物防治学[M].北京:科学出版社, 2010.
[15] 宋光桃, 周国英, 刘君昂, 等.油茶根腐病拮抗内生细菌的筛选及鉴定[J].植物保护学报, 2010, 2(37):137-142.
[16] Fravel DR. Commereialization and implemeniation of biocontrol[J]. Annual Review of Phyto Pathology, 2005, 43:337-359.
[17] 程亮, 游春平, 肖爱萍.拮抗细菌的研究进展[J].江西农业大学学报, 2003, 5(25):732-736.
[18] 刘振华.多粘类芽孢杆菌和海洋类芽孢杆菌可湿性粉剂的研制及其加工工艺的优化与放大[D].上海:华东理工大学,2011.
[19] 郝华昆, 韩俊华,等.棉花黄、枯萎病拮抗菌株B110的鉴定及其抑菌作用方式[J].植物保护, 2007, 2(33):77-80.

