正交优选超声波辅助提取三明药用植物金线莲中总氨基酸的工艺研究
张茶妹,周文富
(三明学院化学与生物工程系,福建 三明365004)
金线莲又名金线兰、树草莲、金线虎头蕉、金线入骨消,属于兰科开唇兰属多年生矮小草本植物[1],是我国民间珍稀药材,其药用成分倍受人们青睐[2-5]。但由于自然环境的恶化,野生金线莲锐减,其有效成分的高效提取成为近年研究的热点[6-15]。
氨基酸类化合物广泛存在于动植物体中,是构成植物蛋白的基本物质单元。分析植物中氨基酸含量对研究植物中氨基酸、蛋白质的代谢和干旱、盐分、病菌对植物的影响以及植物的食用、药用价值都具有十分重要的意义[16-18]。已有文献报道金线莲中的微量元素、总氨基酸以及8种人体必需氨基酸的含量均高于国产西洋参和野生参[19-21]。作者在此采用超声波辅助提取工艺对三明药用植物金线莲中总氨基酸进行提取分离,运用茚三酮显色法和分光光度法对金线莲样品进行含量测定[22],在通过单因素实验和正交实验优化金线莲中总氨基酸提取工艺的基础上,采用HPLC法测定了金线莲中总氨基酸的组成,拟为高效提取金线莲中总氨基酸提供依据。
1 实验
1.1 原料、试剂与仪器
金线莲,由三明生物科技有限公司提供。
L-酪氨酸标准品,北京天宇祥瑞科技有限公司;无水乙醇、95%乙醇、石油醚、2%茚三酮溶液、磷酸盐缓冲溶液(pH=6.70),分析纯;异硫氰酸苯酯、三乙胺,化学纯;甲醇、乙腈,色谱纯;超纯水。
YF系列高速中药粉粹机,瑞安市永历制药机械有限公司;DHG-9070A型电热恒温鼓风箱,上海基玮实验仪器设备有限公司;KQ-300DB型超声反应器,昆山市超声仪器有限公司;SHB23型循环水式多用真空泵,郑州杜甫仪器厂;RE-52B型旋转蒸发仪,上海博经经贸公司;UV-1100型紫外可见分光光度计,北京瑞利仪器有限公司;722S型可见分光光度计,上海精密科学仪器有限公司;1200型高效液相色谱仪,美国安捷伦公司。
1.2 方法
1.2.1 金线莲中总氨基酸的提取
将金线莲置于80℃烘箱干燥6h,粉碎,过60目筛。准确称取1.00g金线莲粉末于三角锥瓶中,按一定比例加入一定体积分数的乙醇溶液,摇匀,将瓶口用保鲜膜覆盖,浸泡1h后,置超声波提取器中提取。冷却至室温,抽滤,将滤液移至梨形分液漏斗中加石油醚除去脂溶性物质。再移至100mL容量瓶中,定容,摇匀,作为样品溶液,备用。
1.2.2 标准溶液的配制和最大吸收波长的确定[16,17]
标准溶液的配制:将L-酪氨酸标准品于100℃下干燥至恒重,精密称取10.2mg置于容量瓶中,加入10mL 0.02mol·L-1的氢氧化钠,全溶后加蒸馏水定容至刻度,得到浓度为0.1mg·mL-1的L-酪氨酸标准溶液。
最大吸收波长的确定:分别准确吸取L-酪氨酸标准溶液、样品溶液各1.0mL置于25mL容量瓶中,加入2%茚三酮溶液1mL和磷酸盐缓冲溶液(pH=6.70)2mL,摇匀,置于水浴锅中加热15min后取出,迅速用冷水冷却至室温,加蒸馏水稀释至刻度,摇匀,显色(氨基酸的显色反应在沸水浴中进行,一般水浴温度控制在90~100℃)。以不加样品溶液、不加L-酪氨酸标准溶液、只加显色剂溶液作空白对照。用紫外可见分光光度计于500~700nm波长范围进行扫描,结果显示标准溶液和样品溶液在566nm处均有最大吸收峰。因此,确定本实验的最大吸收波长为566 nm。
1.2.3 标准曲线及线性回归方程的建立
准确吸取L-酪氨酸标准溶液0.00mL、1.00mL、2.00mL、3.00mL、4.00mL、5.00mL于25mL容量瓶中,于566nm处测定吸光度。以L-酪氨酸浓度(x)为横坐标、吸光度(y)为纵坐标,绘制标准曲线。结果发现L-酪氨酸在2~10μg·mL-1范围内线性关系良好,拟合线性回归方程为y=0.0344x-0.0676,R=0.9998。
1.2.4 金线莲中总氨基酸提取率的测定
精密吸取样品溶液1.0mL,置于50mL容量瓶中,按1.2.2方法显色并测定吸光度。依下式计算金线莲中总氨基酸的提取率(M):

式中:c为样品中氨基酸的质量浓度,μg·mL-1;W为样品的质量,g。
1.2.5 金线莲中总氨基酸的组成分析
样品的处理:参照文献[23]进行。
衍生化反应:精密量取样品溶液1mL,置于5mL离心管中,干燥。加入乙醇-水-三乙胺(2∶2∶1)溶液1mL、异硫氰酸苯酯-甲醇-三乙胺-水(1∶7∶1∶1)衍生剂溶液2mL,超声处理后静置20min,干燥。再加入10mL样品稀释液,超声溶解,经0.45μm滤膜过滤,备用(密闭4℃)。
色谱条件[23]:色谱柱采用Agilent Zorbax Eclipse XDB-C18(4.6mm×150mm,5μm);流动相A为水,流动相B为乙腈,流动相C为0.1mol·L-1乙酸钠溶液(冰醋酸调pH值为6.5);检测波长254nm;柱温36℃;进样量10μL;流速1.0mL·min-1;按表1进行梯度洗脱,洗脱总时间为21min。

表1 流动相洗脱梯度/%Tab.1 Mobile phase gradient elution/%
2 结果与讨论
2.1 单因素实验
单因素实验基础条件:乙醇体积分数为70%、料液比为1∶40(g∶mL,下同)、超声波功率为60W、提取温度为60℃、超声提取2次、每次40min。
2.1.1 提取温度的影响(图1)

图1 提取温度对金线莲中总氨基酸提取率的影响Fig.1 The effect of extraction temperature on extraction rate of total amino acids fromAnoectochilus roxburghii
由图1可知,随着提取温度的升高,金线莲中总氨基酸提取率先升高后降低,在提取温度为60℃时,提取率达到最高。这是因为,温度会影响分子运动的剧烈程度,蛋白质水解、肽键断裂都需要能量,温度越高,水解越彻底,氨基酸从金线莲中溶出的量就越多;但温度过高时乙醇的挥发速度加快、浓度降低,从而影响了氨基酸的溶出,且随着温度的升高杂质溶出量也会增加。综合考虑,选择提取温度为60℃左右进行正交实验。
2.1.2 乙醇体积分数的影响(图2)
由图2可知,随着乙醇体积分数的增大,金线莲中总氨基酸提取率先升高后降低,在乙醇体积分数为60%时,提取率达到最高。这是因为,乙醇体积分数偏低时,金线莲中极性小的氨基酸溶出量少;而乙醇体积分数过高时,又会降低极性氨基酸的溶出量,使植物细胞中的蛋白质很快凝结,从而阻碍乙醇向植物细胞内渗透,进一步影响氨基酸的浸出,同时,使提取液中带入色素和脂溶性物质的量增加,导致总氨基酸提取率降低。实验中还发现,当乙醇体积分数为40%或更低时,提取液变得粘稠,难以过滤,可能是金线莲中多糖类成分溶出所致。因此,选择乙醇体积分数为60%左右进行正交实验。

图2 乙醇体积分数对金线莲中总氨基酸提取率的影响Fig.2 The effect of ethanol volume fraction on extraction rate of total amino acids fromAnoectochilus roxburghii
2.1.3 料液比的影响(图3)
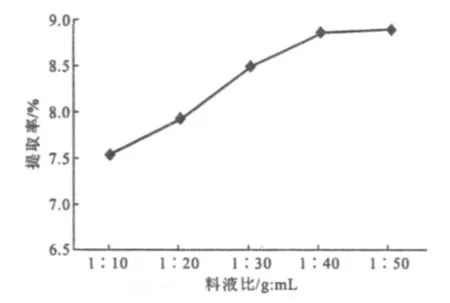
图3 料液比对金线莲中总氨基酸提取率的影响Fig.3 The effect of solid-liquid ratio on extraction rate of total amino acids fromAnoectochilus roxburghii
由图3可知,金线莲中总氨基酸提取率随溶剂量的增加而升高,在料液比达到1∶40时,提取率基本趋于稳定。这是因为,当溶剂量过少时,植物细胞内的氨基酸易与溶液中的氨基酸达到浓度动态平衡,导致总氨基酸提取率下降;而溶剂量过多时,氨基酸的溶出量降低,提取率升幅不明显。因此,选择料液比为1∶40左右进行正交实验。
2.1.4 提取时间的影响(图4)
由图4可知,随着提取时间的延长,金线莲中总氨基酸提取率先升高后降低,在提取时间为40min时,提取率达到最高。这是因为,短时间的超声处理对细胞的破坏作用较大,总氨基酸的溶出量较多,提取率上升较快;但长时间的超声作用会使植物组织中大量的细胞破裂,导致细胞内大量的不溶物及较多的粘液质等溶出,使溶液中的杂质增多,传质阻力增大,影响了氨基酸的溶出,并且长时间处于较高的温度下,乙醇的挥发量增多,氨基酸的氧化分解也会加剧。因此,选择提取时间为40min左右进行正交实验。

图4 提取时间对金线莲中总氨基酸提取率的影响Fig.4 The effect of extraction time on extraction rate of total amino acids fromAnoectochilus roxburghii
2.1.5 超声波功率的影响(图5)

图5 超声波功率对金线莲中总氨基酸提取率的影响Fig.5 The effect of ultrasonic power on extraction rate of total amino acids fromAnoectochilus roxburghii
由图5可知,金线莲中总氨基酸提取率随着超声波功率的增大逐渐升高,当超声波功率大于60W后,提取率基本趋于稳定。这是因为,随着超声波功率的增大,分子运动加快,对细胞的破坏程度也加大,氨基酸的溶出量增多。因此,选择超声波功率为60W左右进行正交实验。
2.2 正交实验
根据单因素实验结果,以乙醇体积分数、料液比、提取时间、超声波功率为考察因素,以总氨基酸提取率为考核指标,进行正交实验,其结果与分析见表2。
由表2可知,各因素对金线莲中总氨基酸提取率的影响大小依次为:乙醇体积分数>料液比>提取时间>超声波功率,最佳提取工艺条件为:乙醇体积分数60%、料液比1∶40、超声波功率60W、提取2次、每次提取40min。

表2 正交实验结果与分析Tab.2 Results and analysis of orthogonal experiment
2.3 验证实验
按照筛选出的优化工艺进行了3次重复性实验,总氨基酸提取率分别为9.86%、9.82%、9.89%,平均达到9.86%,高于正交实验的结果,从而证明所确定的最佳提取条件是合理、稳定的。
2.4 金线莲中总氨基酸组成的HPLC分析(图6)

图6 金线莲中总氨基酸的高效液相色谱Fig.6 HPLC Chromatogram of total amino acids fromAnoectochilus roxburghii
由图6可知,金线莲中每种氨基酸都可以正常出峰,分离效果良好,且各个峰的保留时间与文献[24]对照品溶液基本一致。根据HPLC色谱及各种氨基酸的极性分析,三明产金线莲含有16种可检出的氨基酸,其中非必需氨基酸9种、必需氨基酸7种,按对应峰的保留时间由短到长(2.818~20.525min)依次为门冬氨酸、谷氨酸、丝氨酸、甘氨酸、精氨酸、组氨酸、苏氨酸、丙氨酸、脯氨酸、酪氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸。
3 结论
通过单因素实验和正交实验确定超声波辅助提取三明药用植物金线莲中总氨基酸的最佳工艺条件为:乙醇体积分数60%、料液比1∶40(g∶mL)、超声波功率60W、提取温度60℃、提取2次,每次提取40min,在此条件下,总氨基酸提取率达到9.86%。该方法与传统的醇溶剂浸提法相比,具有操作简单、快速、高效、无需加热、提取率高等优点。
[1]张以忠,邓琳琼,董丽华,等.金线莲研究的现状与展望[J].贵州科学,2007,25(2):81-84.
[2]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究Ⅲ[J].天然产物研究与开发,2005,17(3):259-262.
[3]Shyur L F,Chen C H,Lo C P,et al.Induction of apoptosis in MCF-7human breast cancer cells by phytochemicals fromAnoectochilus formosanus[J].J Biomed Sci,2004,11(6):928-939.
[4]黄立峰,卢若艳,苏志敏,等.福建金线莲提取物对GCl所致小鼠急慢性肝损伤的保护作用[J].解放军药学学报,2007,23(4):278-281.
[5]李春艳,阮冠宇,倪碧莲,等.正交优化超声-微波协同萃取金线莲中阿魏酸的工艺研究[J].光明中医,2009,24(12):2261-2263.
[6]曹扬远.金线莲中化学成分的研究[D].福州:福建医科大学,2008.
[7]罗晓青,吴明开,查兰松,等.贵州药用植物野生金线莲资源调查[J].西南农业学报,2011,24(2):826-828.
[8]罗庆国,叶炜,江金兰,等.金线莲组培快繁技术研究[J].南方农业:园林花卉版,2011,5(5):43-44.
[9]Wang S Y,Kuo Y H,Chang H N,et al.Rofiling and characterization antioxidant activities in AnoectochilusformosanusHayata[J].J Agri Food Chem,2002,50(7):1859-1865.
[10]Huang L Y,Zhong T H,Chen T W,et al.Identification ofβ-sitosterol,stigmasterol and ergosterin in A.roxburghii using supercritical fluid extraction followed by liquid chromatography/atmospheric pressure chemical ioneization ion trap mass spectrometry[J].Rapid Commun Mass Spectrom,2007,21(18):3024-3032.
[11]Sharma B,Viswanath G,Salunke R,et al.Effects of flavonoidrich extract from seeds of Eugenia jambolana(L.)on carbohydrate and lipid metabolism in diabetic mice[J].Food Chemistry,2008,110(3):697-705.
[12]Pinho O,Ferreira I M P L V O,Mendes E,et al.Effect of temperature on evolution of free amino acid and biogenic amine contents during storage of Azeitao cheese[J].Food Chemistry,2001,75(3):287-291.
[13]王晓雪.福建金线莲粗提取物多组分的快速质谱分析方法及NMR/RRLC-MS相关谱分析方法研究[D].北京:北京协和医学院,2011.
[14]关璟,王春兰,郭顺星,等.高效液相色谱法测定金线莲中黄酮含量[J].药物分析杂志,2008,28(1):9-11.
[15]顾慧芬,庄意丽,梅其春.野生与组培金线莲有效成分的比较及RAPD分析[J].中成药,2011,33(8):1364-1367.
[16]魏长庆,肖婧,刘文玉.超声波辅助提取罗布麻茶氨基酸的工艺
[7]Singh R,Kissling R M,Letellier M A,et al.Transesterification/acylation of secondary alcohols mediated by N-heterocyclic carbene catalysts[J].Journal of Organic Chemistry,2004,69(1):209-212.
[8]Grasa G A,Guveli T,Singh R,et al.Efficient transesterification/acylation reactions mediated by N-heterocyclic carbene catalysts[J].Journal of Organic Chemistry,2003,68(7):2812-2819.
[9]Connor E F,Nyce G W,Myers M,et al.First example of N-heterocyclic carbenes as catalysts for living polymerization:Organocatalytic ring-opening polymerization of cyclic esters[J].Journal of the American Chemical Society,2002,124(6):914-915.
[10]Nyce G W,Glauser T,Connor E F,et al.In situ generation of carbenes:A general and versatile platform for organocatalytic living polymerization[J].Journal of the American Chemical Socie-ty,2003,125(10):3046-3056.
[11]Schossler W,Regitz M.Stabile dipole aus 1,1′,3,3′-tetrapheny-2,2′-bimidazolidinyliden und acyliso-bzw.Acylisothiocyanaten[J].Chemische Berichte,1974,107(6):1931-1948.
[12]Kliegman J M,Barnes R K.Glyoxal derivatives(Ⅱ):Reaction of glyoxal with aromatic primary amines[J].Journal of Organic Chemistry,1970,35(9):3140-3143.
[13]Arduengo A J,Krafczyk R,Schmutzler R,et al.Imidazolylidenes,imidazolinylidenes and imidazolidines[J].Tetrahedron,1999,55(51):14523-14534.
[14]Duong H A,Tekavec T N,Arif A M,et al.Reversible carboxylation of N-heterocyclic carbenes[J].Chemical Communications,2004,7(1):112-113.

