人类免疫缺陷病毒1型慢性感染者B细胞表型分析及抗反转录病毒治疗的修复作用
闫静静,仇超,2,3,李亮助,2,邱趁丽,傅卫辉,2,孙俊,徐建青,2,3,张晓燕,2,3
1. 复旦大学附属公共卫生临床中心,上海 201508; 2. 复旦大学生物医学研究院,上海 200032; 3. 复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032
人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)慢性持续感染的重要特征是随着病毒的持续复制,CD4+T细胞数目逐渐减少,免疫系统功能紊乱,进而造成严重的细胞免疫损伤。与此同时,免疫系统的另一重要免疫应答——体液免疫也出现多种缺陷。最早关于HIV-1感染引起B细胞异常的报道是在1983年[1],其主要表现为免疫球蛋白血症和对B细胞丝裂原的反应性低,揭示了获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)患者B细胞异常活化和免疫失调等损伤现象。此外,HIV-1感染后机体不能产生有效的抗体应答,最早出现的抗体只是针对HIV-1膜蛋白的非中和表位,而其中和抗体的产生总是滞后于病毒的突变[2,3],致使病毒不能被有效控制。HIV-1抗体应答的缺陷可能与B细胞的发育过程、分化状态及生发中心的异常变化有关[4-6]。
20世纪90年代,抗反转录病毒治疗(antiretroviral therapy,ART)的临床应用为HIV感染者带来了福音,有效的ART可较好地降低HIV-1病毒载量,增加外周血B细胞数目,并使凋亡敏感B细胞亚群减少而初始B细胞增加,但记忆B细胞数目不能回升[7],提示ART并不能完全修复HIV-1感染造成的B细胞损伤。因此,明晰ART治疗者的免疫失调状态,可为建立有效的免疫干预策略提供理论依据。
本研究选取中国1995~1996年因有偿献血而集中形成的HIV-1慢性感染人群为研究对象,该人群的人口学特征、遗传背景和病毒分子特征均相近,是研究HIV-1感染与B细胞亚群和表型变化及ART与B细胞亚群和表型修复的极好素材。
1 材料与方法
1.1 研究对象
HIV-1慢性感染者均因1995~1996年有偿献血而感染。分子病毒学分析显示感染的HIV-1毒株是B’亚型,且具有高度同源性。本研究共有66例HIV-1感染者,其中34例经过ART治疗。HIV-1血清学阴性的对照标本来自12名健康志愿者。所有研究对象均按照知情同意原则签署了知情同意书。
1.2 仪器和试剂
人淋巴细胞分离液购自GE Healthcare公司,RPMI 1640培养基和胎牛血清为HyClone产品。荧光抗体无蜕化蛋白同源物(果蝇)〔ecdysoneless homolog (Drosophila),ECD〕-抗人CD19购自Beckman Coulter公司,PE-Cy7-抗人CD10、PerCp-抗人CD20、PE-抗人CD21、APC-Cy7-抗人CD27、FITC-抗人CD38、Pacific Blue-抗人CD95和 APC-抗人PD-1购自BioLegend公司,APC-抗人CD21 和 FITC-抗人CD40购自eBioscience公司,PE-抗人CD70、V450-抗人Bcl-2购自BD Biosciences公司。固定/穿膜缓冲液为BD Pharmingen产品。淋巴细胞绝对计数管为BD Bioscience公司产品。流式细胞仪购自BD Bioscience公司,型号为FASCAria Ⅱ。
1.3 实验方法
1.3.1标本采集采集HIV阳性患者静脉血,用无菌乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝管收集,共 40 ml。采集后低温运送至实验室用于检测。健康对照组采集静脉血后即刻进行检测。
1.3.2外周血淋巴细胞的绝对计数应用BD Bioscience公司全血淋巴细胞绝对计数管进行外周血CD4+T细胞、CD8+T细胞和CD19+B细胞的绝对计数,操作方法按照说明书进行。
1.3.3 B细胞亚群及表型分析EDTA抗凝全血用于分离外周血单核细胞(peripheral blood mononuclear cell, PBMC),其原理是应用Ficoll密度梯度离心法。分离的PBMC重悬于RPMI 1640培养基中并计数。取1×106个PBMC进行B细胞染色,染色分为3部分,每部分的染色步骤为先加入CD19抗体,室温避光静置20 min;再加入其他表面抗体混合物,室温避光静置20 min。用含2%新生牛血清(newborn calf serum,NCS)的磷酸缓冲液(phosphate buffered saline,PBS)洗细胞。胞内分子染色需先固定穿膜,再加入抗体,按照试剂盒说明书进行。同时做荧光扣除对照(fluorescent minus one,FMO)和单染。流式细胞仪收集的数据用FlowJo 7.6.5版本(Tree Star Inc., Ashland, OR, USA)进行分析。
1.4 统计学分析
采用GraphPad Prism 5.0进行分析,组间比较采用2组独立样本非参数Mann-WhitneyUtest方法,P<0.05为有统计学意义。
2 结果
2.1 HIV-1慢性感染者外周血淋巴细胞绝对计数的变化
将66例HIV-1慢性感染者分为2组:未接受ART(ART-naïve)组(n=32)和接受ART(ART-treated)组(n=34)。另设HIV-1阴性健康对照组(n=12)。HIV-1感染者均有有偿献血史,感染毒株是HIV-1 B’亚型,6个月以上ART可将病毒载量控制在检测线以下(HIV RNA<50 copies/ml)。HIV-1感染后外周血CD4+T细胞和B细胞绝对数都显著低于健康对照组,而CD8+T细胞显著高于健康对照组(表1)。有效的ART仅能部分恢复外周血淋巴细胞的数目。
表1参与者的基本特征
Tab.1 Baseline characteristics of participants

Healthy controlHIV-1 infectedART-naïveART-treatedCase (n)123234Age (year) #25 (21-32)47.5 (34-66)50.5 (33-70)Male sex (%)505368CD4+ T cell count (cells/μ l)#756 (508-1181)390 (128-950)∗∗390 (73-1 020)∗∗CD8+ T cell count (cells/μ l)#624 (289-913)1 112 (306-3 154)∗∗855 (377-2 516)∗B cell count (cells/μ l)#190 (98-508)125 (26-428)∗180 (40-794)Duration of infection (month)#N/A89 (60-178)89 (13-166)Duration of treatment (month)#N/AN/A29.5 (6-94)HIV RNA (copies/ml)#N/A5 600 (60-110 000)LDL
#Median (range).*P<0.05,**P<0.01 compared with healthy control. LDL, lower than detection level; N/A, not available.
2.2 HIV-1慢性感染者B细胞亚群的异常变化
HIV-1感染后外周血B细胞总数减少,但B细胞各亚群的变化并不一致。为深入探究B细胞亚群的异常变化,根据B细胞表面分子将其分为6个细胞亚群[5](图1A),通过流式细胞术检测各亚群在外周血中的变化。
健康对照组外周血中的主要B细胞亚群是初始B细胞(naïve B cell)和静息记忆B细胞(resting memory B cell);HIV-1感染后,其比例显著降低(P<0.05)。此外,未成熟B细胞(immature B cell)和浆母细胞(plasmablast)的比例在HIV感染后也显著减少(P<0.01)。相反,健康对照组外周血中仅少量存在的组织样记忆B细胞(tissue-like memory B cell)在HIV-1感染后比例显著上升(P<0.01)。活化记忆B细胞(activated memory B cell)也显示轻微增加,但无统计学意义(P>0.05)(图1B)。

T1/T2&3, immature/transitional B cell; Naïve, naïve B cell; RM, resting memory B cell; AM, activated memory B cell; TLM, tissue-like memory B cell; PB, plasmablast.
图1 HIV-1慢性感染者B细胞亚群的变化及ART的修复
Fig.1 Distribution of B cell subpopulations in chronic HIV-1 infection and the restoration of ART
比较ART-naïve与RT-treated组发现,ART使初始B细胞比例显著增加(P<0.01),且异常增加的组织样记忆B细胞比例显著减少(P<0.01),但静息记忆B细胞仍维持较低水平,未能有效恢复(图1B)。
2.3 HIV-1慢性感染者B细胞表型的变化
2.3.1 HIV-1感染者B细胞中活化分子的表达
高丙种球蛋白血症(hypergammaglobuli-nemia)[1]和多克隆活化(polyclonal activation)[8]是HIV-1感染后B细胞活化的显著特征,但对B细胞各亚群活化分子的表达仍缺乏研究。活化分子CD38表达在HIV-1感染者B细胞中显著增加(P<0.01)(图2A),且主要表现在未成熟B细胞、初始B细胞、静息记忆B细胞和组织样记忆B细胞中(P<0.01)(图2B)。ART可显著降低未成熟B细胞和初始B细胞中的CD38表达(P<0.01)。

*P<0.05,**P<0.01.
图2 HIV-1慢性感染者、慢性感染治疗者与健康对照者中B细胞及其亚群中CD38的表达
Fig.2 Expression of CD38 on B cells and subpopulations among HIV-1-infected ART-naïve and ART-treated patients, as well as healthy controls
2.3.2 HIV-1感染者B细胞中凋亡相关分子的表达
HIV-1感染造成B细胞部分亚群数目减少,但B细胞不是HIV-1感染的靶细胞,B细胞中凋亡相关分子的表达可能调控感染者B细胞数目的耗损。HIV-1慢性感染者B细胞上调凋亡分子CD95的表达(P<0.01)(图3A中),同时下调抗凋亡分子Bcl-2的表达(P<0.01)(图3A右)。B细胞各亚群中CD95表达水平均显著升高(P<0.01),且静息记忆B细胞、活化记忆B细胞和浆母细胞中CD95高水平表达(图3D),提示这3类细胞可能对CD95-CD95L介导的外源性凋亡途径更敏感。ART可降低静息记忆B细胞和活化记忆B细胞中CD95的表达(P<0.01、P<0.05),但该表达仍高于健康对照组。抗凋亡分子Bcl-2的表达在初始B细胞、组织样记忆B细胞及浆母细胞中显著下调(P<0.01,图3C),其表达水平不能经ART恢复。
猴免疫缺陷病毒(simian immunodeficiency virus,SIV)感染恒河猴的实验已证明PD-1在调节B细胞数目和功能中起重要作用[9]。在HIV-1感染者中,PD-1在B细胞中有上调表达的趋势,但没有统计学差异(P>0.05),ART也不能降低PD-1的表达(图3A左)。有趣的是,HIV-1感染者静息记忆B细胞和浆母细胞中PD-1的表达水平显著高于健康对照组(P<0.01),而组织样记忆B细胞中的PD-1表达显著降低(P<0.01)。ART不能修复PD-1的异常表达(图3B)。
2.3.3 HIV-1感染者B细胞中共刺激分子的表达
B细胞的活化需B细胞与T细胞之间相互作用以提供共刺激信号,从而刺激B细胞增殖和分泌抗体;然而有报道称HIV-1感染后B细胞对T细胞依赖疫苗的反应性很低[10],提示B细胞与T细胞之间的相互作用受到损伤。B细胞中共刺激分子CD40和CD70与CD4+T细胞中的配体CD40L和CD27相互作用,为B细胞活化和分泌抗体提供必要的共刺激信号[11,12]。HIV-1感染者B细胞中的CD40表达上调(P<0.01),且各亚群中的CD40表达水平均显著高于健康对照组(P<0.01)(数据未显示)。值得注意的是,CD40的表达若以单细胞水平的平均荧光强度(mean fluorescent intensity, MFI)来衡量,HIV-1感染者B细胞及其亚群中CD40的表达水平显著低于健康对照组(P<0.01)。然而,CD40的表达不能经ART修复(图4A)。CD70的表达在HIV-1感染者B细胞中下调(P<0.01),主要表现在初始B细胞、静息记忆B细胞、活化记忆B细胞和组织样记忆B细胞中(P<0.05、P<0.01、P<0.01和P<0.01),而ART可上调未成熟B细胞、活化记忆B细胞和组织样记忆B细胞中CD70的表达(P<0.05、P<0.01和P<0.01)(图4B)。

*P<0.05,**P<0.01.
图3慢性感染者、慢性感染治疗者与健康对照者中HIV-1凋亡相关分子在B细胞及其亚群中的表达
Fig.3 Profiles of apoptosis-associated molecules on B cells and subpopulations among HIV-1-infected ART-naïve and ART-treated patients, as well as healthy controls
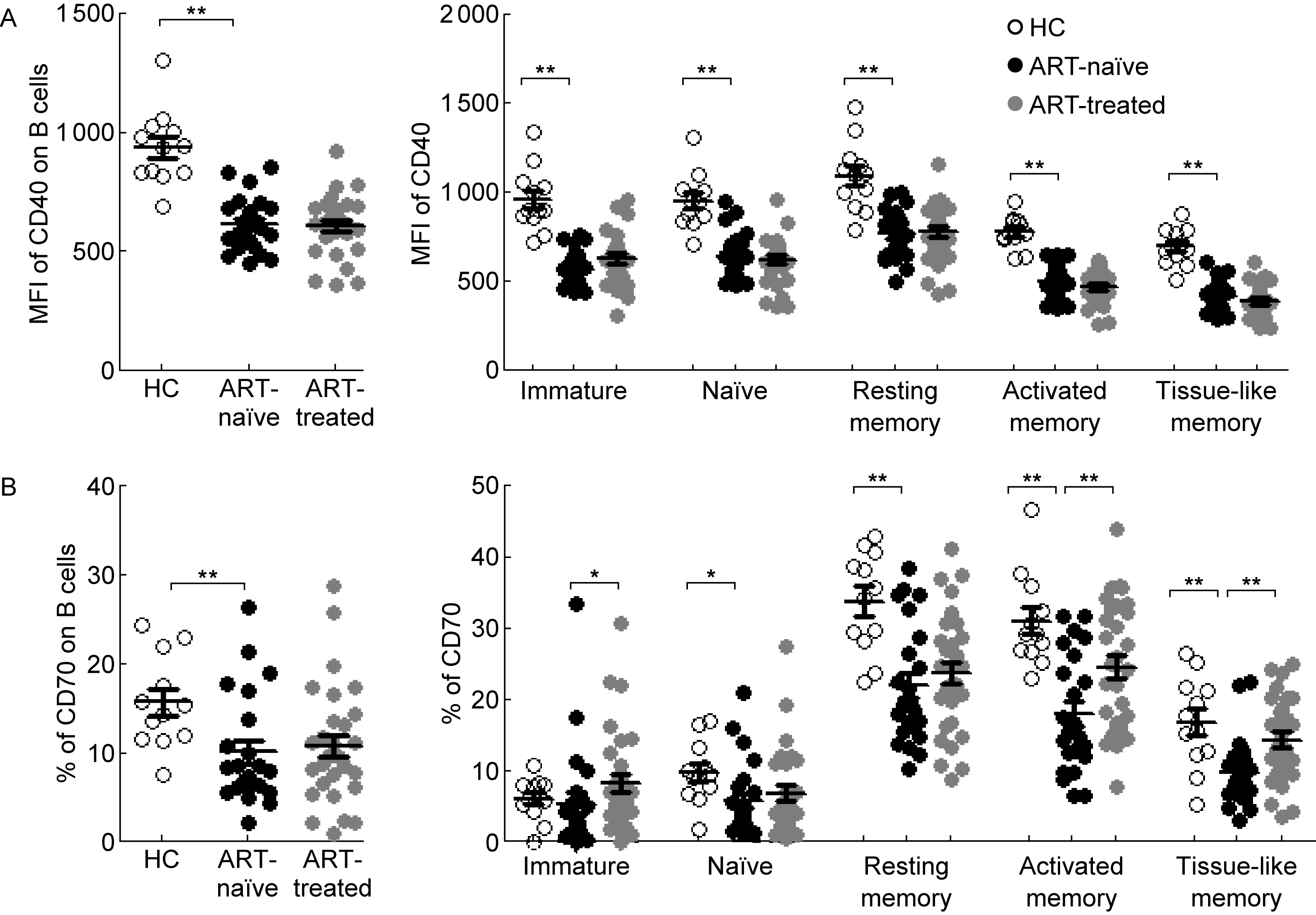
*P<0.05,**P<0.01.
图4 HIV-1慢性感染者、慢性感染治疗者与健康对照者中B细胞及其亚群中共刺激分子CD40和CD70的表达
Fig.4 Expressions of costimulatory molecules CD40 and CD70 on B cells and subpopulations among HIV-1-infected ART-naïve and ART-treated patients, as well as healthy controls
3 讨论
HIV-1在机体内建立慢性持续感染,致使免疫系统重要功能损伤。随着病毒的持续复制,CD4+T细胞逐渐减少,造成严重的细胞免疫损伤;同时体液免疫系统包括B细胞的功能与抗体产生也出现异常。B细胞在介导抗病毒体液免疫中发挥重要作用,其数目和功能紊乱直接影响有效的抗病毒免疫应答。
初始B细胞和静息记忆B细胞是在体液免疫应答中发挥最重要作用的细胞,然而HIV-1感染造成其数目显著减少。初始B细胞数目的减少可能与病毒载量相关,在ART降低病毒载量后,其数目可恢复至正常水平。静息记忆B细胞可产生针对疫苗抗原(如麻疹、肺炎链球菌和霍乱毒素)的特异性抗体,维持机体的长期血清学记忆。但HIV-1感染者体内这些特异性抗体的水平降低,且与静息记忆B细胞数目减少间接相关[13],提示HIV-1感染引起机体血清学记忆损伤。然而,静息记忆B细胞数目减少的原因可能与其凋亡敏感性增加有关,本研究发现该亚群中凋亡分子CD95的表达上调使其易经CD95-CD95L介导的外源性凋亡途径发生凋亡;同时,PD-1的高表达造成其数目减少。静息记忆B细胞中CD95和PD-1的高表达可能对其凋亡水平起累加效应[14]。静息记忆B细胞中归巢受体的异常表达使其归巢至淋巴组织[15]及分化发育成浆细胞[16]等都可能是其数目减少的机制,但静息记忆B细胞经ART后仍不能恢复。有报道称早期治疗也能较好地恢复其数目[17],但一旦形成慢性感染,即使长期治疗也不能恢复其数目。与此同时,外周血中显著增加的一群细胞是组织样记忆B细胞,这类细胞被认为是耗竭型B细胞[18],其增殖能力低,表位多样性低,抑制性受体表达较高,提示B细胞亚群倾向于终末耗竭状态分化。然而,干扰抑制性受体(如FcRL4和Siglec-6)的表达可提高B细胞增殖及分泌细胞因子的能力[19],证实HIV-1感染造成B细胞耗竭。ART可显著降低组织样记忆B细胞的数目,但仍高于健康对照组,提示存在病毒载量以外的因素影响该亚群数目。
未成熟B细胞在外周血中是一群过渡型B细胞,其数目与HIV-1疾病进展期外周血CD4计数呈负相关[20]。但本研究发现未成熟B细胞在HIV-1感染后显著降低,这可能与不同研究队列的HIV-1疾病进展阶段不同有关,只有CD4计数严重下降后未成熟B细胞数目才增加[21]。
浆母细胞是终末分化细胞,在感染和疫苗接种时短暂增加并循环于外周血中。有研究报道HIV-1感染后浆母细胞显著增加,并长期维持在高水平,但这些浆母细胞中仅有很少一部分是HIV特异性的,其数目增加可能是高免疫球蛋白血症的机制之一[22]。本研究并未发现浆母细胞增加,可能与疾病进展阶段有关。而且ART不能增加未成熟B细胞和浆母细胞数目。
HIV-1慢性感染不仅造成B细胞亚群比例紊乱,也影响各亚群的活化和凋亡状态。CD38在未成熟B细胞中表达较高,随着B细胞成熟其表达水平逐渐降低,并在B细胞活化后表达重新上调[23]。本研究发现HIV-1感染者B细胞及多数亚群中CD38的表达上调,提示B细胞及其亚群处于过度活化状态。凋亡分子CD95在HIV-1感染者CD21lowCD27+B细胞中高表达[24],造成该亚群对外源性凋亡途径敏感;而抗凋亡分子Bcl-2在CD10+B细胞中低表达[25],使其易发生内源性凋亡。SIV感染快速进展的恒河猴中PD-1在记忆B细胞中高表达[9],降低该亚群数目并影响其分泌抗体能力。本研究发现,HIV-1感染者所有B细胞亚群中CD95的表达均显著上调;所有亚群中Bcl-2的表达都有下调趋势,并在初始B细胞、组织样记忆B细胞及浆母细胞中呈显著性差异;PD-1的表达在静息记忆B细胞和浆母细胞中显著上调,提示CD95、Bcl-2和PD-1的异常表达可能影响所有B细胞亚群的稳态,而不是局限于个别亚群。但ART仅能部分修复CD38和CD95的异常表达,对Bcl-2和PD-1的表达没有显著作用,提示ART不足以修复HIV-1感染造成的B细胞损伤,有效的免疫干预策略亟待开发。
共刺激信号对B细胞的活化和抗体分泌有至关重要的作用,而HIV-1感染后大部分B细胞及其亚群都表达CD40,但CD40的MFI降低,即HIV-1感染造成B细胞及其亚群中共刺激分子CD40的表达降低。有研究表明,HIV-1感染引起T细胞中CD40L的表达降低[26],CD40和CD40L的表达缺陷可能是造成B细胞与T细胞之间相互作用受损的机制之一。CD70仅表达于活化的B细胞、T细胞和自然杀伤细胞(natural killer ,NK细胞)。体外实验表明,T细胞中CD70可与B细胞中CD27相互作用产生共刺激效应,增强IgG分泌和浆母细胞分化[27]。利用合成的人源可溶性CD27刺激记忆B细胞,发现CD27可与CD70作用,促进转录因子Blimp-1和XBP-1的活化,加快向浆母细胞的分化[28]。本研究结果显示,成熟B细胞亚群包括初始B细胞、静息记忆B细胞、活化记忆B细胞和组织样记忆B细胞中CD70的表达在HIV-1感染后均降低,从而削弱CD70-CD27信号通路,B细胞得不到足够的共刺激信号,影响其功能发挥。
综上所述,HIV-1长期慢性感染造成外周血B细胞数目减少及B细胞亚群异常,且B细胞及其亚群出现过度活化、极易发生凋亡及与T细胞相互作用受损等多种缺陷。ART仅能部分修复B细胞损伤,但无病毒血症患者仍处于免疫失调状态,其体液免疫应答仍不完全,可能增加机会感染和二次感染的易感性。因此,建立有效的免疫干预策略以弥补ART未能修复的B细胞损伤可更好改善体液免疫应答。本研究为免疫干预策略的制订提供了一定线索,首先通过改善初始B细胞和记忆B细胞的凋亡状态,增强其存活能力;其次通过增强CD70的共刺激效应,以提高B细胞产生抗体尤其是特异性抗体的能力。
[1] Lane HC, Masur H, Edgar LC, Whalen, G, Rook AH, Fauci AS. Abnormalities of B-cell activation and immunoregulation in patients with the acquired immunodeficiency syndrome [J]. N Engl J Med, 1983, 309(8): 453-458.
[2] Richman DD, Wrin T, Little SJ, Petropoulos CJ. Rapid evolution of the neutralizing antibody response to HIV type 1 infection [J]. Proc Natl Acad Sci USA, 2003, 100(7): 4144-4149.
[3] Wei X, Decker JM, Wang S, Hui H, Kappes JC, Wu X, Salazar-Gonzalez JF, Salazar MG, Kilby JM, Saag MS, Komarova NL, Nowak MA, Hahn BH, Kwong PD, Shaw GM. Antibody neutralization and escape by HIV-1 [J]. Nature, 2003, 422(6929): 307-312.
[4] Amu S, Ruffin N, Rethi B, Chiodi F. Impairment of B-cell functions during HIV-1 infection [J]. AIDS, 2013 [Epub ahead of print].
[5] Moir S, Fauci AS. Insights into B cells and HIV-specific B-cell responses in HIV-infected individuals [J]. Immunol Rev, 2013, 254(1): 207-224.
[6] Cubas RA, Mudd JC, Savoye AL, Perreau M, van Grevenynghe J, Metcalf T, Connick E, Meditz A, Freeman GJ, Abesada-Terk G Jr, Jacobson JM, Brooks AD, Crotty S, Estes JD, Pantaleo G, Lederman MM, Haddad EK. Inadequate T follicular cell help impairs B cell immunity during HIV infection [J]. Nat Med, 2013, 19(4): 494-499.
[7] Moir S, Malaspina A, Ho J, Wang W, Dipoto AC, O′ Shea MA, Roby G, Mican JM, Kottilil S, Chun TW, Proschan MA, Fauci AS. Normalization of B cell counts and subpopulations after antiretroviral therapy in chronic HIV disease [J]. J Infect Dis, 2008, 197(4): 572-579.
[8] Shirai A, Cosentino M, Leitman-Klinman SF, Klinman DM. Human immunodeficiency virus infection induces both polyclonal and virus-specific B cell activation [J]. J Clin Invest, 1992, 89(2): 561-566.
[9] Titanji K, Velu V, Chennareddi L, Vijay-Kumar M, Gewirtz AT, Freeman GJ, Amara RR. Acute depletion of activated memory B cells involves the PD-1 pathway in rapidly progressing SIV-infected macaques [J]. J Clin Invest, 2010, 120(11): 3878-3890.
[10] Ballet JJ, Couderc LJ, Rabian-Herzog C, Duval-Roy C, Janier M, Danon F, Clauvel JP, Seligmann M. Impaired T-lymphocyte-dependent immune responses to microbial antigens in patients with HIV-1-associated persistent generalized lymphadenopathy [J]. AIDS, 1988, 2(4): 291-297.
[11] Noelle RJ, Ledbetter JA, Aruffo A. CD40 and its ligand, an essential ligand-receptor pair for thymus-dependent B-cell activation [J]. Immunol Today, 1992, 13(11): 431-433.
[12] Kobata T, Jacquot S, Kozlowski S, Agematsu K, Schlossman SF, Morimoto C. CD27-CD70 interactions regulate B-cell activation by T cells [J]. Proc Natl Acad Sci USA, 1995, 92(24): 11249-11253.
[13] Titanji K, De Milito A, Cagigi A, Thorstensson R, Grutzmeier S, Atlas A, Hejdeman B, Kroon FP, Lopalco L, Nilsson A, Chiodi F. Loss of memory B cells impairs maintenance of long-term serologic memory during HIV-1 infection [J]. Blood, 2006, 108(5): 1580-1587.
[14] Rethi B, Sammicheli S, Amu S, Pensieroso S, Hejdeman B, Schepis D, Hong TP, Chiodi F. Concerted effect of lymphopenia, viremia and T cell activation on Fas expression of peripheral B cells in HIV-1 infected patients [J]. AIDS, 2013, 27(2): 155-162.
[15] Cagigi A, Mowafi F, Phuong Dang LV, Tenner-Racz K, Atlas A, Grutzmeier S, Racz P, Chiodi F, Nilsson A. Altered expression of the receptor-ligand pair CXCR5/CXCL13 in B cells during chronic HIV-1 infection [J]. Blood, 2008, 112(12): 4401-4410.
[16] Vinuesa CG. HIV and T follicular helper cells: a dangerous relationship [J]. J Clin Invest, 2012, 122(9): 3059-3062.
[17] Moir S, Buckner CM, Ho J, Wang W, Chen J, Waldner AJ, Posada JG, Kardava L, O′ Shea MA, Kottilil S, Chun TW, Proschan MA, Fauci AS. B cells in early and chronic HIV infection: evidence for preservation of immune function associated with early initiation of antiretroviral therapy [J]. Blood, 2010, 116(25): 5571-5579.
[18] Moir S, Ho J, Malaspina A, Wang W, DiPoto AC, O′ Shea MA, Roby G, Kottilil S, Arthos J, Proschan MA, Chun TW, Fauci AS. Evidence for HIV-associated B cell exhaustion in a dysfunctional memory B cell compartment in HIV-infected viremic individuals [J]. J Exp Med, 2008, 205(8): 1797-1805.
[19] Kardava L, Moir S, Wang W, Ho J, Buckner CM, Posada JG, O′ Shea MA, Roby G, Chen J, Sohn, HW, Chun TW, Pierce SK, Fauci AS. Attenuation of HIV-associated human B cell exhaustion by siRNA downregulation of inhibitory receptors [J]. J Clin Invest, 2011, 121(7): 2614-2624.
[20] Malaspina A, Moir S, Ho J, Wang W, Howell ML, O′ Shea MA, Roby GA, Rehm CA, Mican JM, Chun TW, Fauci AS. Appearance of immature/transitional B cells in HIV-infected individuals with advanced disease: correlation with increased IL-7 [J]. Proc Natl Acad Sci USA, 2006, 103(7): 2262-2267.
[21] Fogli M, Torti C, Malacarne F, Fiorentini S, Albani M, Izzo I, Giagulli C, Maggi F, Carosi G, Caruso A. Emergence of exhausted B cells in asymptomatic HIV-1-infected patients naïve for HAART is related to reduced immune surveillance [J]. Clin Dev Immunol, 2012, 2012: 829584.
[22] Buckner CM, Moir S, Ho J, Wang W, Posada JG, Kardava L, Funk EK, Nelson AK, Li Y, Chun TW, Fauci AS. Characterization of plasmablasts in the blood of HIV-infected viremic individuals: evidence for nonspecific immune activation [J]. J Virol, 2013, 87(10): 5800-5811.
[23] Savarino A, Bottarel F, Malavasi F, Dianzani U. Role of CD38 in HIV-1 infection: an epiphenomenon of T-cell activation or an active player in virus/host interactions [J]? AIDS, 2000, 14(9): 1079-1089.
[24] Moir S, Malaspina A, Pickeral OK, Donoghue ET, Vasquez J, Miller NJ, Krishnan SR, Planta MA, Turney JF, Justement JS, Kottilil S, Dybul M, Mican JM, Kovacs C, Chun TW, Birse CE, Fauci AS. Decreased survival of B cells of HIV-viremic patients mediated by altered expression of receptors of the TNF superfamily [J]. J Exp Med, 2004, 200(7): 587-599.
[25] Ho J, Moir S, Malaspina A, Howell ML, Wang W, DiPoto AC, O′ Shea MA, Roby GA, Kwan R, Mican JM, Chun TW, Fauci AS. Two overrepresented B cell populations in HIV-infected individuals undergo apoptosis by different mechanisms [J]. Proc Natl Acad Sci USA, 2006, 103(51): 19436-19441.
[26] Wolthers KC, Otto SA, Lens SM, Van Lier RA, Miedema F, Meyaard L. Functional B cell abnormalities in HIV type 1 infection: role of CD40L and CD70 [J]. AIDS Res Hum Retroviruses, 1997, 13(12): 1023-1029.
[27] Nagumo H, Agematsu K. Synergistic augmentative effect of interleukin-10 and CD27/CD70 interactions on B-cell immunoglobulin synthesis [J]. Immunology, 1998, 94(3): 388-394.
[28] Dang LV, Nilsson A, Ingelman-Sundberg H, Cagigi A, Gelinck LB, Titanji K, De Milito A, Grutzmeier S, Hedlund J, Kroon FP, Chiodi F. Soluble CD27 induces IgG production through activation of antigen-primed B cells [J]. J Intern Med, 2012, 271(3): 282-293.

