小肠出血性间质瘤的影像学诊断比较分析
倪志华 嵇 鸣 宋 恬 孙荣跃 吴堪华 殷士蒙
小肠出血病因中,肿瘤占首位(44.6%~62.1%),主要是间质瘤[1]。小肠一般指Treitz韧带至回盲瓣之间的肠道。胃肠道间质瘤一般极少出现肠梗阻症状,临床多表现为急性或间歇性、隐匿性出血,部分患者仅表现为慢性贫血。由于解剖及生理的原因,加之检查方法的局限性,胃镜和结肠镜检查难以抵达其病变部位,快速而准确找到出血的部位及发病原因成为临床工作的关键与难点。目前诊断小肠出血的方法较多,但各有优缺点[2-3]。本研究的目标是进一步比较分析DSA、CT、小肠稀钡造影在小肠间质瘤出血中的诊断价值。
方 法
1.临床资料
2010年2月至2013年2月我院住院病人中,临床经胃肠镜排除十二指肠球部以上、回盲瓣以下出血,疑诊小肠出血行DSA、小肠CT及小肠钡餐检查、并经病理诊断确诊为间质瘤的患者17例。男性11例,女性6例,年龄33~75岁,中位年龄55岁。临床主要表现为便血,其中大量出血、血流动力学不稳定者[收缩压< 90mmHg(1 mmHg= 0.1333 kPa) ,休克指数> 1] 7例。
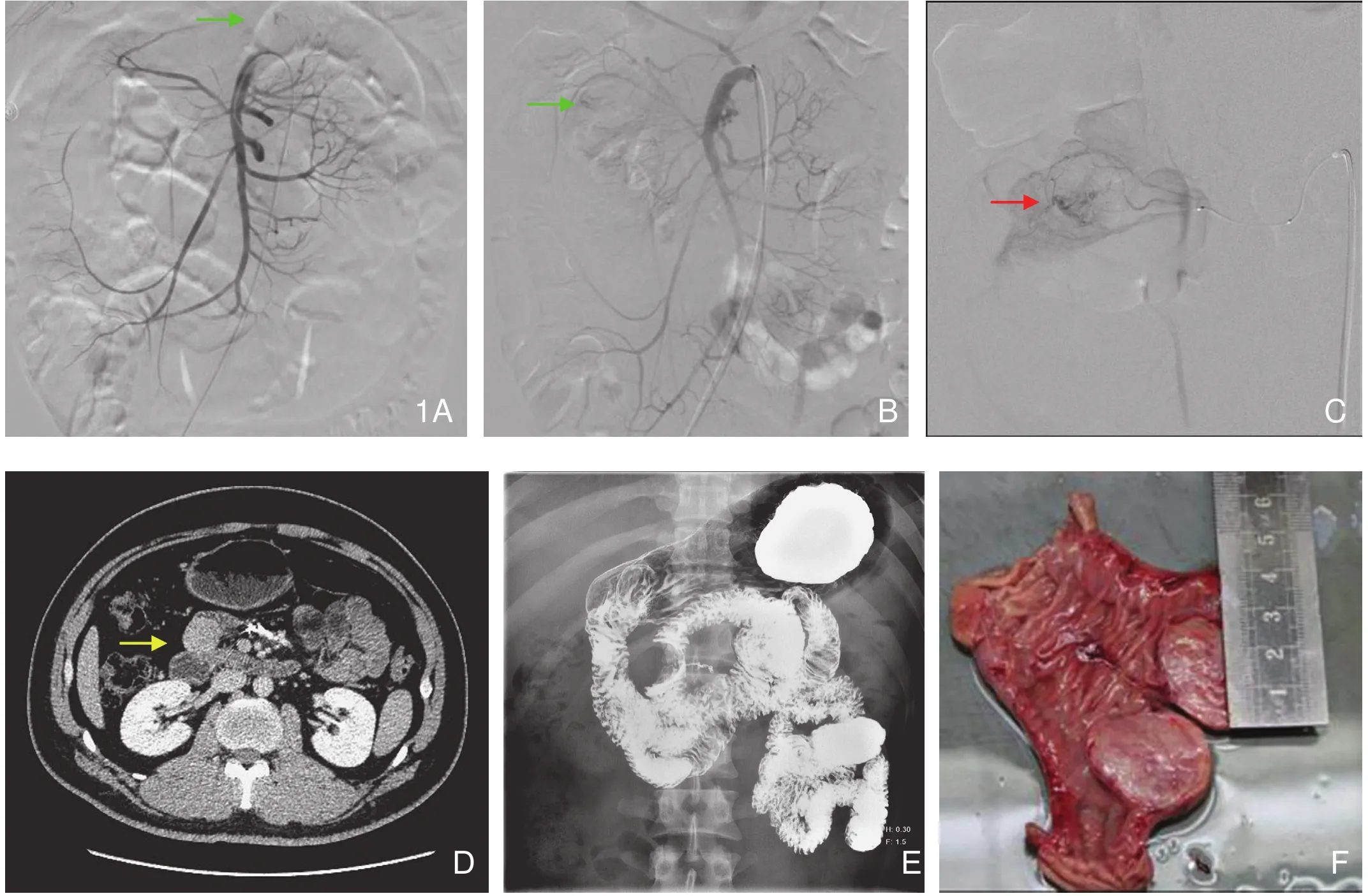
图1 小肠间质瘤。 A.肠系膜上动脉造影见左上腹早现的异常血管,肠系膜上动脉根部发出空肠动脉第2支供血(箭头)。B.PVA颗粒栓塞2天后再次出血,造影显示肿瘤染色(绿箭)位于右上腹,小肠病变移动度较大。C.微导管造影显示肠腔内有对比剂渗出(红箭)。D.弹簧圈栓塞后见弹簧圈金属伪影;小肠CT增强延迟期空肠近段见圆形强化结节。E.小肠稀钡造影见空肠鹅卵石征,大致判断十二指肠及近段空肠走形。F.病例标本示肿瘤长径3cm,突向腔内生长。
2.技术方法
2.1 DSA 的术前准备:全面了解病情尤其是重要脏器功能及碘过敏史,危重病人需进行心电监护,休克患者予补充血容量, 会阴部备皮,DSA术前半小时停用止血药物。所有患者均签DSA 诊疗知情同意书。
2.2 DSA 的操作方法:采用Seldinger 法穿刺股动脉,将5F 导管插至肠系膜上动脉,用西门子数字减影血管造影机行常规造影, 对比剂采用碘比乐(流速:6 ml/s,18 ml),发现可疑病变用3F 微导管(SP) 行超选择造影;若第一次肠系膜上动脉造影阴性,可调整导管的深度、对比剂的流速再次造影,以及再行肠系膜下动脉及腹腔干造影,必要时经导管灌注山莨菪碱10 mg 扩张血管及抑制肠蠕动、减少肠蠕动所致伪影对病灶显示的影响,以提高病灶显示率。DSA 阳性表现为直接和(或)间接征象。直接征象为对比剂外溢,表现为肠腔内对比剂聚集,出血量大时,显示肠道黏膜像;间接征象为导致出血的基础病变的异常血管,如异常对比剂涂染、浓聚,畸形血管团,血管增多、杂乱等。直接征象及间接征象均未发现则为DSA 阴性。
2.3 CT 的操作方法:患者生命体征平稳后(大量便血止血成功后,血色素上升至10g以上),扫描前12h 开始禁食,检查前1h内口服2.5% 甘露醇水对比剂1500 ml,扫描前15min 肌注山莨菪碱 10mg 。患者行(GE Discovery CT 750 HD)宝石CT 5mm 层厚平扫(扫描范围包括右膈顶至耻骨联合平面)以及多期增强扫描,即经肘静脉将75~100ml碘海醇团注法注射,流速3~3.5ml/s,延迟30~35s 进行动脉期扫描,60~65s 进行静脉期扫描,延迟期90~100s扫描;扫描参数:100kV,100~120mA,层厚均小于5mm,准直16×1.25mm,螺距1375:1,重建层厚1mm,间隔0.625mm,数据传至ADW4. 4 工作站,在薄层重建及冠状位重建图像上,仔细观察分析判断肠管有无异常密度影及异常强化影,并对病变行定位及定性分析。
2.4 小肠稀钡造影的操作方法:患者生命体征平稳后(大量便血止血成功后,血红蛋白上升至10g以上),检查前12h开始禁食,患者行钡餐检查,口服稀钡对比剂100ml,直接注意跟随钡头的前进位置,不断的调整患者的体位,观察小肠肠腔内有无可疑充盈缺损及肠黏膜破坏征象。
3.统计学处理
应用Stata 7.0 统计软件进行处理。
结 果
1.DSA表现(图1)
17例患者中,16例表现为阳性,1例表现为阴性。所有阳性病例出血均定位于小肠。3例表现为肿瘤染色伴有对比剂外渗,10例见早现的异常血管,2例见肿瘤染色,1例有早现的异常血管伴有肿瘤染色。
2.CT表现
所有17例病例CT都有阳性征象:肠壁增厚伴有强化占位3例,强化占位性病变14例。
3.小肠稀钡造影表现
发现小肠鹅卵石征10例,肠黏膜纹理紊乱、肠壁僵硬各1例,其余均阴性。
三种检查方法的阳性率比较见表1。
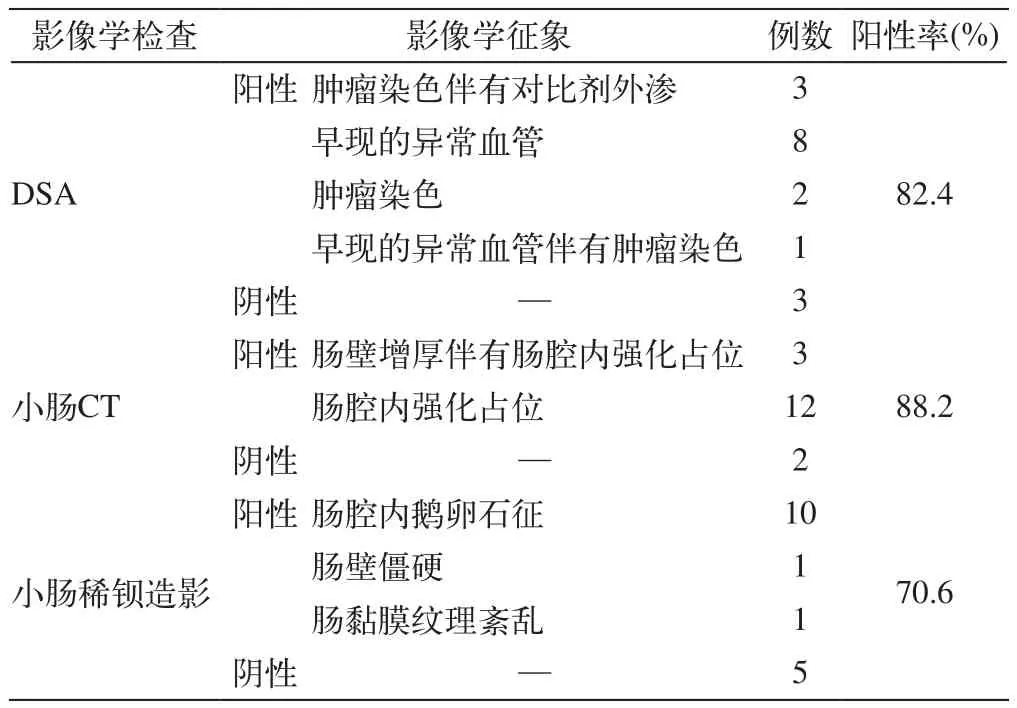
表1 小肠间质瘤的影像学检查阳性率比较
讨 论
胃肠道间质瘤是一类起源于胃肠道Cajal细胞或与Cajal 细胞同源的间叶干细胞,表达c-kit 蛋白(CD117),常见梭形、上皮样,偶见多形性细胞的间叶性肿瘤[4]。可发生于胃肠道任何部位,以胃区最常见(60%),其次是小肠(20%~30%)。小肠间质瘤无特异性临床表现,消化道出血是小肠间质瘤的常见症状之一,尤其是急性出血变化快、病情危重,如果不能及时诊断、早期治疗,将给患者造成严重后果。
DSA的减影技术和动态回放,能较好地显示病变部位的血管在动脉期、实质期、静脉期的改变,对诊断下消化道出血有重要的价值。DSA诊断消化道间质瘤出血的最可靠直接征象是对比剂溢出于血管外,表现为出血区域逐渐增大的小片状对比剂聚集,如果对比剂涂抹在胃肠道腔内的表面,可见胃肠道表面黏膜影,并可随胃肠道蠕动而运动,后期缓慢消失。本研究中,仅3例(17.6%)病例有直接征象。间接征象表现为动脉期病灶部位可见早现的粗细不等、紊乱走行血管影(图1A);另外,不同造影条件会有不同的影像学表现,本组一例病理显示肿瘤大小约2.9cm×2.5cm,DSA肠系膜上动脉造影仅有数根细小的早现异常血管,但3F管径微导管超选择造影后见肿瘤染色(图1A~C),勾勒出肿瘤的轮廓,可能跟图像放大及微导管口距病灶近,灌注压较高以及对比剂局部浓度较高有一定的关系。虽然微导管造影所需剂量一般比肠系膜上动脉造影小,但运用超选插管造影可增加局部对比剂的流量及浓度,从而使一些小的病灶及一些血供不丰富的病变能够显影。使用微导管需接滴注,否则导管进入小的分支血管,容易引起缺血及血流灌注不足,自身血栓形成,导致血管闭塞,造影失败,本组病例均已避免排除此种可能的假阴性。
DSA 不仅可以发现出血部位, 而且对病灶的定位有很大帮助。小肠病灶会随着肠蠕动而移动,且由于大部分肠道出血的间质瘤都为肠腔内生长(图1F),外科手术和小肠CT检查需要有标记的指导,本组病例有两例经DSA栓塞止血后再次出血行第2次DSA的患者,2组病例的病灶位置均发生了大范围的移动(图1A、B)。以下3种定位方法在本组中都得到了临床实践证明是关键和可行的:①通过数病灶血管在肠系膜根部的起源来定位。②微导管或微导丝置入后定位。③使用不透光的金属弹簧圈栓塞并标记定位。
小肠出血DSA 阴性的原因:虽然本组全部病例在手术中常规灌注山莨菪碱,但仍有3例未发现出血灶及异常血管。影响阳性率的原因较多[5],造影时期、出血量、插管水平及胃肠道蠕动等因素均可影响阳性率。由于出血活动期的阳性率明显高于出血间隙期,所以,造影时期应尽量选在出血活动期,用药物扩张血管诱发出血仍无阳性发现,要考虑出血是否在间歇期,其次要考虑出血量是否过少。有报道称[6],行肠系膜上动脉造影,当出血量大于0.5ml/s 时,可发现对比剂外溢,少量出血时对比剂外渗少,有时难以发现对比剂外渗征像。选择性插管水平也影响阳性率,运用超选插管造影可增加局部对比剂的流量及速度,从而使一些小的病灶及一些血供不丰富的病变能够显影,故必要时可对肠系膜上动脉分支逐一超选插管造影,以提高阳性率[7];当患者因出血使肠道蠕动明显增快而使图像模糊时,小的出血灶可能不会显示。本研究在常规运用血管扩张剂、改良插管技术后14 例DSA阳性,阳性率为82.4%,说明对于小肠间质瘤出血DSA有很大价值。
小肠MSCT 检查具有全面观察肠腔内、肠壁和肠腔外病变的特点,并且检查速度快、覆盖范围大空间分辨率更高、强大的图像后处理功能等优点,是其他方法无法比拟的。MSCT 的发展,使发现小肠微小病变成为可能[8-9],有文献报道阳性检出率高达88.5%[10]。间质瘤是实质性的富血供肿瘤,即便本组检查时不在出血急性期,但我们认为MSCT 双期增强检查特别适用于有明显基础病变( 如小肠肿瘤) 引起的出血,CT 能很好发现这些病变的形态学改变及多期强化表现。这里着重提一点的是急性期病人可因伴多种并发症,饮水受限及屏气不好而影响成像质量及微小病灶显示。本组CT直接征象(对比剂外渗)未观察到,而阳性率高于DSA(88.2%)的部分原因是:均选择在患者生命体征平稳时或DSA栓塞标记后行小肠CT检查,这样患者相对能耐受1小时内近1500ml的液体摄入,准备较充分;有了金属标记物容易发现较小的肿瘤(图1D),本组2例阴性病例肿瘤长径均小于3cm。
小肠稀钡造影查是一种无创的诊断方法,尤其适用于小肠间质瘤的诊断。它能直观地显示肿瘤的占位效应,并且对于术前定位有一定的帮助,特别是对于空肠近段以上的间质瘤,能清晰地显示肿瘤距幽门的长度,为外科手术切除肠段的长度及两端最多切除的余量提供预判的基础,避免切除过长引起吻合口高张力,继而引起肠瘘等并发症。但是小肠稀钡造影受周围肠道内对比剂相互遮挡,同时由于检查间隔的影响,容易漏诊远段小肠间质瘤。本组病例小肠稀钡造影阳性率较前两项检查均低(70.6%),但我认为该检查是完善术前资料的一项重要补充,MSCT重建图像不能完全代替它所显示的直观信息。
总之,上述3种影像学检查需互为补充,DSA能发现小肠间质瘤出血急性期的异常血管,为治疗疾病提供重要指导;CT可以择期在患者生命体征平稳后有助于病灶检出,且需要DSA的定位帮助;小肠稀钡造影阳性对术前直观定位有较大帮助。
[1] 钟 捷, 张晨莉, 马天乐, 等. 双气囊小肠镜与胶囊内镜诊断小肠出血病因比较. 中华消化杂志, 2004, 24: 741-744.
[2] Kameda N, Higuchi K, Shiba M,et al . A prospective, single blind trial comparing wireless capsule endoscopy and double balloon enteroscopy in patients with obscure gastrointestinal bleeding. J Gastroenterol, 2008,43 : 434-440.
[3] Yoon W, Jeong YY, Shing SS, et al . Acute massive gastrointestinal bleeding: detection and localization with arterial phase multi-detector row helical CT. Radiology, 2006,239 : 160-167.
[4] Bauer S, Hartmann JT, Wit M, et al. Resection of residual diseasein patients with metastatic gastrointestinal stromal tumors respondingto treatment with imatinib . Int J Cancer,2005, 117: 316.
[5] 刘善达, 王 林. 选择性动脉造影诊断小肠出血 . 临床放射学杂志, 2000, 19 : 310-312.
[6] Ghosh S,Watts D, Kinnear M. Management of gastrointes tinal hemorrhage. Postgrad Med J, 2002,78 : 4-14.
[7] 罗光华, 肖文连, 单 鸿, 等. 不明原因小肠出血数字减影血管造影价值. 介入放射学杂志, 2006, 15 : 221-223.
[8] Horton KM , Fishman EK. The current status of multi-detector row helical CT and three-dimensional imaging of the small bowel . Radiol Clin North Arn, 2003, 41: 199-212.
[9] Boudiaf M , Jaff A, Soyer P,et al. Smallbowel diseases:respective evaluation of multi-detector row helical CT enteroclysis in 107 consecutive patients . Radiology, 2004, 233:338-344.
[10] 胡道予, 李 震, 肖 明, 等. 16层螺旋CT诊断小肠出血性疾病的价值. 放射学实践, 2006, 21: 218-222.

