周围型支气管铸型病变的CT初步分析
应碧伟 李惠民 章家铭 王伟根 高 银
有关肺癌CT表现的文献非常多,但却没有专门报道以支气管铸型表现形式的周围型肺癌,就肺癌的发生发展机制来推论,这样的表现方式也是不寻常的。作者收集一组周围型支气管铸型的病例,回顾性分析其良恶性的鉴别诊断。
方 法
回顾性分析2010.2~2013.3常规CT检查中表现为段及段以远支气管铸型的孤立性病变21例,纳入标准为:CT上为孤立性病灶,病灶表现为单支或多支分支状的支气管明显增粗,外缘清楚,内部呈软组织密度,可以伴点状或少许钙化,但不伴远侧或周围伴随阴影。其中男13例,女8例,年龄41~76岁,平均55岁。临床表现为轻重不等的普通呼吸道症状,包括咳嗽、咳白痰,4例轻度发热,1例痰中血丝。最终11例手术证实,10例支气管镜检明确病理。
CT检查使用东芝Aquilion 16层CT和Philips 16层CT,其中7例进行了增强扫描。常规扫描层厚7或8mm双窗重建,肺窗采用肺算法或高分辨算法,纵隔窗采用标准算法;回顾性重建层厚1mm或1.25mm,部分重叠,软组织分辨率算法,并全部完成多平面重组(multiplanar reformation,MPR),部分完成其他重建如容积显示(volume rendering,VR)。增强扫描采用3~3.5ml/s的注射速度从前臂静脉团注300mgI/ml非离子型碘对比剂80ml,于血管期(约开始注射后23~28s)和实质期(70~90s)完成2次扫描。
数据传入专工作站(Veatra Ⅱ,Vital.corp,USA.),由同一位资深放射科医生在线进行三维重建,2位放射科医生共同完成回顾性在线分析。
结 果
恶性肿瘤(肺癌)12例,良性病变9例。病变按CT表现分为2类,一类为单支支气管病变,另一类为“指状”分布的分支状多支支气管病变。
1. 单支支气管病变
共14例,其中肺癌10例,占71%,包括腺癌4例、鳞癌3例、小细胞癌1例和未分类恶性肿瘤2例,其余4例均为炎症。
肺癌例6位于上叶,4例位于中叶或下叶,炎症2例位于上叶、2例位于下叶。所有病变表现为局限性支气管增粗,其内呈软组织样密度,2例伴有点状钙化,外缘规则或不规则,但均较光整(图1,2)。其中2例进行了增强扫描,支气管腔内结构均有强化,病理上均为恶性。
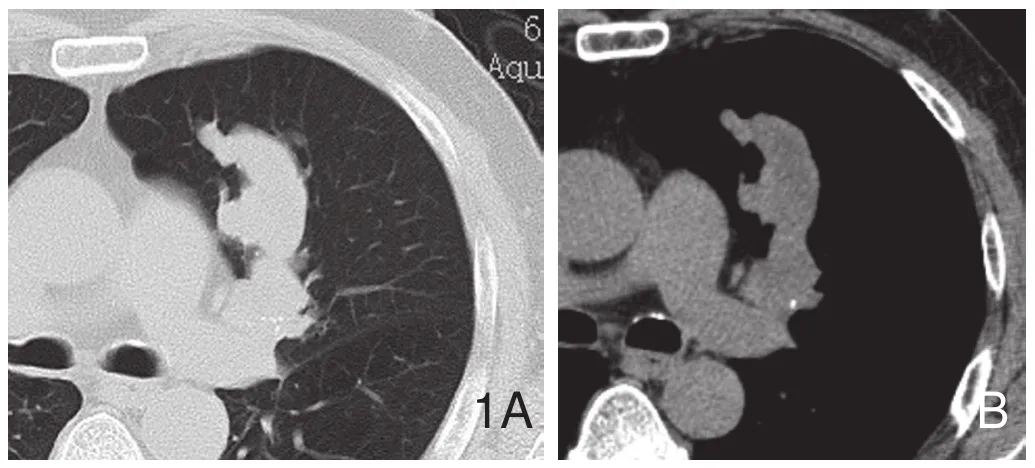
图1 男性,62岁,鳞癌,手术证实。肺窗(A)显示左肺上叶前段支气管不规则增粗,边缘清楚而不规则,远侧无伴随阴影;纵隔窗横断面(B)显示内部软组织密度,近侧见点状钙化。
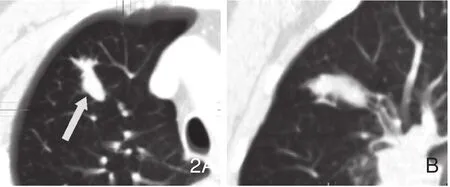
图2 男性,59岁,腺癌,手术证实。横断面(A)和矢状面(B)肺窗显示右肺上叶前段分支支气管局限性明显增粗,无明显伴随阴影。
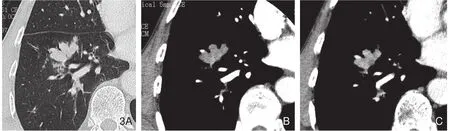
图3 男性,67岁,鳞癌,手术证实。肺窗(A)显示右肺下叶前基底段分支状支气管铸型病变,轮廓清楚;血管期(B)和实质期(C)纵隔窗显示病变均匀明显强化。
2. 分支状支气管病变
共7例,其中肺癌2例,占29%,ABPA 3例,炎症3例,支气管囊肿1例。5例增强检查显示3例明显强化,其中2例为肺癌,1例为炎性肉芽肿。
病变位于上叶1例,中叶或下叶6例;两例肺癌均位于下叶,呈“粗指状”表现,增强后病变明显强化(图3)。3例ABPA表现为多支支气管明显扩张,2例其内伴有点状钙化灶,2增强后无强化,病变边界清楚光滑。1例囊肿表现与此相似但内部密度中等。3例炎症内部密度较均匀,1例有强化者病理上显示为肉芽肿(图5)。
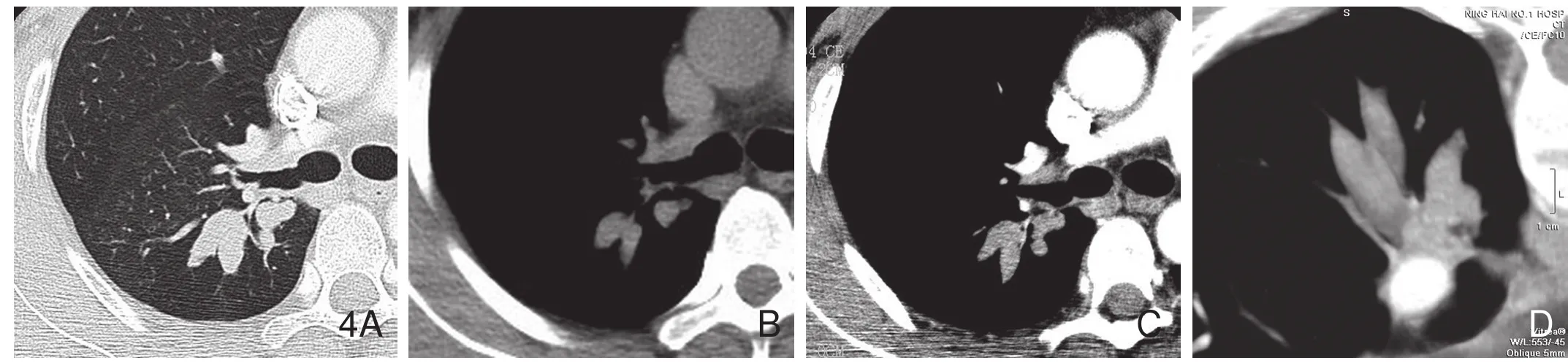
图4 男性,38岁,炎性肉芽肿,手术证实。肺窗(A)显示右肺下叶背段分支状支气管铸型病变,光滑;纵隔窗(B)显示病变呈软组织密度;增强(C)显示病变强化;VR图像(D)显示病变光滑的指状表现。
讨 论
支气管铸型病变通常被认为是黏液嵌塞(黏液栓),以往的文献[1-2]中CT扫描也仅仅是CT平扫而没有增强,只是单纯从形态学上分析,认为支气管黏液栓的显著特点是主轴指向肺门且与支气管走向分布一致,伴有支气管扩张,其中一个原因是肺癌引起的梗阻性黏液嵌塞,并非整个病变是肺癌,且大多指的是主支气管或叶支气管而非段以远支气管。结核性支气管改变可以侵犯各级支气管,表现为局限性管腔改变,或伴有明显黏液栓,但很少引起支气管铸型[3]。关于周围型肺癌与支气管的关系有不少文献[4-5],虽然很详细地描述了支气管与肺癌结节/肿块的多种关系,但也没有涉及本文所指的支气管铸型表现的类型。
本组病变表现特殊:段及段以远支气管的局限性增粗,单支或分支状,无明显伴随阴影,增粗支气管内部密度平扫呈软组织密度,病理上既可能是肺癌,也可能是炎症肉芽肿或支气管黏液栓。如果按以往观念简单地归类为支气管黏液嵌塞,可能导致肿瘤的延误诊断。本组病变表现按支气管累及的范围和形式分为单支支气管型和多支支气管型,前者更多是肺癌,占71%(10/14),以上叶出现情况较多见,增强强化的2例均为肺癌,提示增强对鉴别良恶性可能很有帮助,遗憾的是本组增强比例较低。多支分支状支气管铸型病变则良性多于恶性(2/7),文献也有报道沿支气管壁弥漫性生长的肺癌[6],但此种支气管铸型的肺癌则未见报道。本组分支状支气管铸型病变中ABPA占将近一半(3/7),提示真菌性尤其曲菌性病变是此类病变的主要鉴别诊断对象,内部伴有钙化或密度较高、增强后无强化可以帮助明确诊断。1例炎性肉芽肿表现与肺癌在CT上难以区分,是以后需要注意的鉴别难点。
总之,支气管铸型表现的段及段以远的这种周围型孤立病变,不能简单地以支气管黏液嵌塞处理,尤其发生在上肺野的单支支气管铸型病变,这些病变很可能是恶性的。CT增强很有必要,明显强化提示病变为富血供的软组织结构而非黏液栓,恶性可能性很大,因此对此类病变都要做增强扫描,以有效区分良恶性。
[1] 俞肖一,严洪珍,王同德,等. 支气管粘液嵌塞的放射诊断分析. 中华放射学杂志, 1999;33:263-266.
[2] 佟 丹, 赵永生, 赵锋. 支气管黏液嵌塞的CT 诊断. 中国医学影像技术,2000,16:654-655.
[3] 于 红,李惠民,沈 策,等. 气管支气管结核的多层C T诊断。 中国医学计算机成像杂志,2004,10:92-95.
[4] Qians JW,Zhou KR,Lu G,et al. The relationship between solitary pulmonary nodules and bronchi:multislice CT-pathological correlation.Clin Radiol, 2004,59:1121-1127.
[5] 孙鹏飞,肖湘生,刘士远,等.多层螺旋CT 对肺孤立性病灶支气管改变的评价. 放射学实践,2007,22:150-153.
[6] 王元洪, 柳 澄.沿支气管壁弥漫生长的肺癌1 例.医学影像学杂志,2006,16:568.

