糖尿病视网膜病变患者大脑视放射的弥散张量成像研究
顾 静 倪建明 张追阳
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最为常见和严重的微血管并发症之一,也是糖尿病患者视力下降,甚至致盲的主要原因。大量研究发现各种原因导致的视网膜病变将会导致视觉皮质功能和结构的继发性改变,对青光眼患者的尸检结果也证实了视网膜病变患者存在视觉皮质退变[1-4]。但目前还不清楚DR患者视放射白质纤维束是否存在异常,因此本研究采用DTI探讨糖尿病视网膜病变患者视放射的白质纤维束的改变。
方 法
1. 临床资料
以在我院内分泌科就诊的糖尿病患者作为研究对象,所有患者经眼科眼底镜检查,并按照1985年中华医学会眼科学会制定的视网膜病变的诊断和分期标准,将他们分为分为合并视网膜病变糖尿病组(DR)和无视网膜病变糖尿病组(NDR)。所有患者均排除糖尿病急性并发症、急性感染性疾病、原发性肾病以及甲状腺功能亢进症、心力衰竭、肿瘤等其他重大疾病,且常规MR成像序列上后视觉通路(包括视束、视放射和视觉皮质)及其他脑实质内未见异常信号灶。
共入组符合要求的DR患者18例(男10例,女8例,年龄59.00±6.98岁),21例NDR (男9例,女12例,年龄48.52±7.78岁)。同时选择在眼科进行眼底镜检查无异常的、性别和年龄相匹配的15例非糖尿病患者作为正常对照(男7例,女8例,年龄48.77±7.77岁),三组对象年龄和性别构成无显著性差异。所有影像学检查均通过患者知情同意。
2. 成像方法
MR成像设备为GE Signa VH/i 3.0T超导MR扫描仪,梯度场强度30 mT/m,梯度切换率为150mT·m-1·ms-1,鸟笼式头部正交线圈。所有患者都进行了常规MR检查,包括矢状面T1WI,横断位T1WI、T2WI、FLAIR。DTI扫描采用单次激发SE-EPI序列,扫描参数为TR/TE=10000/112ms,矩阵128×128,FOV220mm,层厚5mm,间隔1mm,NEX为1,在21个方向上施加弥散梯度,b=0和1000 s/mm2,扫描时间192s 。
3. 数据处理
DTI数据传入工作站(SUN ADW 4.0),利用Functool 2的DTI处理包进行计算,得到各项异性分数(factional anisotropy,FA)图。在FA图上视放射显示最为清楚的部位每侧选定5个感兴趣区域(ROI)进行FA值的测量,取其平均值。每个ROI面积统一设定为9mm²,分别置于双侧视放射对称的位置(图1)。所有ROI的设置由两名有经验的放射科医师独立进行,取平均后用于进一步分析,FA值结果以均数±标准差的形式表示。

图1 视放射的测量,每图1 侧测量5个ROI的FA值,取其平均值,每个ROI面积为9 mm2。图2 视放射平均FA值和糖尿病病程及糖化血红蛋白的散点变化分布图显示视放射平均FA值与随着糖化血红蛋白升高而降低,视放射平均FA值有随糖尿病的病程延长而下降的趋势,但是这种趋势没有达到统计学差异。
4. 统计分析
采用SPSS 10.0统计软件进行统计分析,各组资料以均数±标准差表示。三组受试者视放射FA值之间的差异采用单因素方差分析(ANOVA)比较,组间比较采用Bonferroni检验,Spearman等级相关性分析探讨视放射平均FA值与糖尿病病程及糖化血红蛋白之间的相关性。所有检验以P<0.05为差异有统计学意义。
结 果
DR组、NDR组和正常对照组人口学分布、糖尿病病程及糖化血红蛋白水平的比较见表1。DR组、NDR组和正常对照组三组年龄和性别分布无显著性差异(P>0.05),DR组病程显著大于NDR组(13.39±4.42年vs.10.21±4.14年,t=2.321,P=0.026),DR组糖化血红蛋白也显著高于NDR组[(8.02±2.15)% vs.(6.14±1.29)%,t=3.355,P=0.002]。

表1 DR、NDR和正常对照组临床资料
三组研究对象视放射FA值及其平均值见表2。三组患者两侧视放射FA值间均无显著性差异(P>0.05)。DR组左侧和右侧视放射FA值及其平均值均显著低于NDR组和正常对照组,而NDR组与正常对照组之间没有显著性差异。相关分析显示两侧视放射的平均FA值与糖尿病病程间没有显著的相关性(r=-0.31,P=0.06),而与糖化血红蛋白水平正相关(=-0.41,P=0.001)(图2)
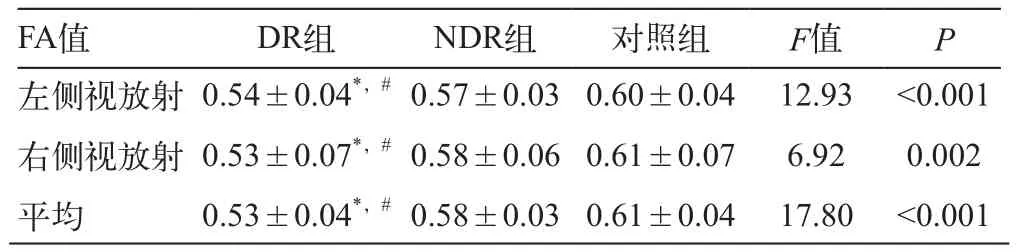
表2 DR、NDR和正常对照组两侧视放射FA值
讨 论
糖尿病是一个复杂的代谢疾病,常合并多系统多器官损害。糖尿病视网膜病变是糖尿病患者最为常见和严重的微血管并发症之一,也是糖尿病患者视力下降,甚至致盲的主要原因。其发病率随着年龄增长和病程延长而增加,糖尿病病史超过10年以上者,DR的发生超过50%。DR的基本病理改变是糖尿病微血管病变,但其发病机制及其病理生理学改变还远远没有阐述清楚。最近的一些研究显示DR患者还合并有脑内结构和功能的改变,动物实验中发现视网膜缺血后数天就出现视神经和视放射的病理改变[5-6]。今年来许多研究者尝试采用各种无创性影像学新技术,包括MR、PET和SPECT等,去揭示糖尿病对神经系统的影响,以进一步探索其潜在的病理生理学机制[4]。
磁共振弥散张量成像技术是目前唯一无创性活体研究脑白质结构及白质纤维束形态的技术,并可以进行定量分析,为研究视觉通路神经纤维提供了可能。DTI对神经元损害后的轴索变性非常敏感,新生儿围生期卒中后视放射弥散各项异性改变已经有报道[7]。本组资料显示糖尿病合并视网膜病变患者视放射FA值显著低于无视网膜病变的糖尿病患者及非糖尿病对照人群,而无视网膜病变的糖尿病患者与非糖尿病对照人群的视放射FA值没有显著差异。Kodl等[8]对25例病程15年以上的1型糖尿病患者的研究也证实视放射和放射冠白质纤维的弥散各向异性下降。采用磁共振波谱分析也证实DR患者枕叶视觉皮层区存在代谢异常[3-4],动物实验中发现视网膜缺血后数天就出现视放射的弥散各向异性下降[5,9]。
糖尿病合并视网膜病变后,视网膜出现微动脉瘤、新生血管形成、视网膜出血、玻璃体积血、牵拉性视网膜脱离及视神经萎缩等改变,并持续释放多种缺血相关因子。它们不仅对血管结构造成损伤,也会导致视网膜神经元的损害。现在已经知道外周神经损害之后可以出现大脑功能的可塑性重组,这种重组可以出现在皮质水平,也可以出现在皮质下、脑干和脊髓水平。长期去神经支配在中枢神经系统可以引起更加广泛重组,并且伴有解剖形态的变化[10]。Kitajima等[11]对一小组不同原因的视网膜病变患者进行MR研究也证实视野缺损与初级视觉皮质中枢神经元退变之间的关系。Boucard等[12]对青光眼和视网膜黄斑变性导致的视野缺损患者的研究结果显示长期视野缺损会合并枕叶皮质灰质萎缩,且皮质萎缩的位置与视网膜病变视野缺损在视觉皮质的映射区是相对应。Dogan等[2]采用DWI的方法也报道DR患者的视觉皮质、扣带回和眶额皮质ADC值显著升高,而NDR组则没有这些改变。
对缺血性脑梗死的研究已经证实原发性脑损伤后数周至数月其损伤区远侧会出现轴索及髓鞘的崩解(Wallerian变性)[13],视网膜神经元损伤可能也是通过这种跨神经元变性的方式引起后视路白质纤维的轴索变性及视觉皮质的继发性损伤。对猴和猫采用增加球内压的方式损伤视网膜也证实了这种继发的改变的存在[14]。视觉部分功能丧失,由于视觉传导通路缺乏有效的光化学信号刺激且顺行性神经递质运输也下降,可能进一步引起了发射投射纤维到初级视觉皮层的外侧膝状体神经轴索萎缩,进而影响视放射纤维束的结构完整性。另外糖尿病脑血流灌注降低,氧化应激,代谢障碍等,外源性胰岛素应用出现的血糖水平不规则波动也可以引起脑组织结构或功能的改变。本组资料也显示糖尿病患者视放射FA值与糖化血红蛋白水平负相关,视放射平均FA值有随糖尿病的病程延长而下降的趋势,但是这种趋势没有达到统计学差异。持续的高血糖对脑组织的损害不仅仅局限于视放射,Wessels 等[15]采用基于体素的形态分析方法分析了合并视网膜病变的1型糖尿病患者大脑皮质,结果显示DRP右侧额下回、右侧顶叶左侧小脑半球和左侧额中回皮质厚度显著变小。
本研究显示那些长期合并视网膜病变的患者,其视觉传导通路已经发生了继发性病理改变,进一步支持了糖尿病视网膜病变与脑损害有关联的推测。磁共振弥散张量成像可以无创性探测脑组织内微结构的改变,对了解糖尿病的脑内视觉通路的变化具有重要意义。糖尿病合并视网膜病变目前尚缺乏有效的治疗方法,有很多研究者致力于发展基于视网膜刺激的视觉假体研究工作。但视网膜移植能否成功恢复视力还取决于完整的视觉皮质中枢,更需要完整的视觉通路将信号有效的传递给视觉皮质。因此视网膜移植前,也应该综合考虑视觉传导通路和视皮质的改变,DTI对于预测哪些患者将从这种治疗中获益可能会有一定的帮助。
[1] Gupta N, Ang LC, Noel de Tilly L, et al. Human glaucoma and neural degeneration in intracranial optic nerve, lateral geniculate nucleus, and visual cortex. Br J Ophthalmol, 2006,90: 674-678.
[2] Dogan M, Ozsoy E, Doganay S, et al. Brain diffusion-weighted imaging in diabetic patients with retinopathy. Eur Rev Med Pharmacol Sci, 2012,16:126-131.
[3] 张 祥, 洪 梅, 陈 萍, 等. 糖尿病视网膜病变的视皮层和视辐射区1H-MR波谱初探. 中华放射学杂志, 2009, 43: 46-49
[4] Sahin I, Alkan A, Keskin L, et al. Evaluation of in vivo cerebral metabolism on proton magnetic resonance spectroscopy in patients with impaired glucose tolerance and type 2 diabetes mellitus. J Diabetes Its Complic, 2008, 22: 254-260.
[5] Song SK, Sun SW, Ju WK, et al. Diffusion tensor imaging detects and differentiates axon and myelin degeneration in mouse optic nerve after retinal ischemia, Neuroimage, 2003, 20: 1714-1722.
[6] Schoth F, Burgel U, Dorsch R, et al. Diffusion tensor imaging in acquired blind humans. Neurosci Lett, 2006, 398: 178-182
[7] Seghier ML, Lazeyras F, Zimine S, et al. Combination of eventrelated fMRI and diffusion tensor imaging in an infant with perinatal stroke. Neuroimage, 2004, 21: 463-472
[8] Kodl CT, Franc DT, Rao JP, et al. Diffusion tensor imaging identifies deficits in white matter microstructure in subjects with type 1 diabetes that correlate with reduced neurocognitive function. Diabetes, 2008,57: 3083-3089
[9] Sun SW, Liang HF, Cross AH, et al. Evolving Wallerian degeneration after transient retinal ischemia in mice characterized by diffusion tensor imaging. Neuroimage, 2008, 40: 1-10
[10] Mir HM, Tatsukawa KJ, Carmichael ST, et al. Metabolic correlates of lesion-specific plasticity: an in vivo imaging study. Brain Res,2004, 26, 1002: 28-34
[11] Kitajima M, Korogi Y, Hirai T, et al. MR changes in the calcarine area resulting from retinal degeneration. AJNR, 1997, 18: 1291-1295
[12] Boucard CC, Aditya T, Hernowo AT, et al. Changes in cortical grey matter density associated with long-standing retinal visual field defects. Brain, 2009,132:1898-1906.
[13] DeVetten G, Coutts SB, Hill MD, et al. Acute corticospinal tract Wallerian degeneration is associated with stroke outcome. Stroke,2010, 41: 751-756
[14] Yucel YH, Zhang Q, Weinreb RN, et al. Effects of retinal ganglion cell loss on magno-, parvo-, koniocellular pathways in the lateral geniculate nucleus and visual cortex in glaucoma. Prog Retin Eye Res, 2003, 22: 465-481.
[15] Wessels AM, Rombouts SA, Simsek S, et al. Microvascular disease in type 1 diabetes alters brain activation: a functional magnetic resonance imaging study. Diabetes, 2006, 55: 334-340.

