ESWAN序列在星形细胞肿瘤分级及鉴别诊断中的应用
孙琳琳 李 克 付 玏 汤伟军 谭德炎 付建辉巴哈提.哈立亚 米娜瓦尔.依米提
目前,磁敏感成像技术主要包括磁敏感加权成像(susceptibility weighted imaging, SWI)和T2* 加权血管成像,及其衍生序列:多回波采集重度T2*加权血管成像(T2 star weighted angiography/enhanced T2 star weighted angiography,SWAN/ESWAN)。SWAN是GE公司开发的多回波3D GRE磁敏感加权序列,ESWAN是为了满足定量的需求而诞生的SWAN功能扩展版,特点是信噪比高,最后得到的图像是由多个长TE时间的回波加权平均而成,并且ESWAN的功能覆盖了SWAN。磁敏感加权成像对血液产物、小静脉和铁沉积十分敏感,因此可用于脑肿瘤中微出血、静脉成像的检测及评估。本研究探讨ESWAN序列在星形细胞肿瘤分级及鉴别诊断中的作用。
方 法
1.病例采集
回顾性分析复旦大学附属华山医院东院2011年7月~2011年12月经手术和病理证实的脑星形细胞肿瘤患者35例;颅内原发淋巴瘤5例,脑内孤立性转移瘤6例,平滑肌肉瘤1例,黑色素瘤1例;脑膜瘤16例(其中1例为间变性脑膜瘤,WHOIII级),神经鞘瘤6例,血管母细胞瘤2例;髓母细胞瘤2例。并经由本院或外院CT扫描,排除瘤内钙化灶。
2.图像采集
应用GE SIGNA EXCITE 1. 5T HD MR 扫描仪,8通道头颅线圈,行常规MRI、增强T1 FLAIR及ESWAN序列,常规MRI包括平扫轴面、矢状或冠状面T1液体衰减翻转恢复序列( FLAIR) 、T2 液体衰减翻转恢复序列( FLAIR) 及增强后轴面、矢状面或冠状面T1 FLAIR。ESWAN序列:3D GRE 序列,回波数为11,首个回波TE 10 ms,回波间隔约5.1~5.2 ms,TR 77 ms,翻转角30°,带宽62.5Hz,NEX 0.69,层厚2 mm,层数48,矩阵416×356,FOV 240 mm×192 mm,扫描时间5 min 59 s。
3.图像后处理
ESWAN 图像后处理:扫描的每一层均得到分别对应11个回波的幅度图和相位图,所有图像传输至ADW 4.2工作站经Functool 软件包中ESWAN软件处理。后处理后的幅度图行最小强度投影显示颅内静脉和出血灶。为便于评估,现根据ITSS(intratumoral susceptibility signal intensity,瘤内磁敏感信号强度)数目将其分级如下:0级,无ITSS;1级,1~ 5 个点状、线条状ITSS;2 级,6~ 10 个点状、线条状ITSS;3 级,11个或以上点状、线条状ITSS。由2位有经验的神经放射医师分别对图像进行盲法评定。
4.统计分析
对所得数据用SPSS 16.0统计软件包进行分析处理;对低级别星形细胞肿瘤、间变性星形细胞瘤、胶质母细胞瘤内ITSS信号评级行多个独立样本的非参数检验Kruskal-Wallis H检验,以P<0.05 判定为有显著性差异;若上诉3组存在差异,则行两样本非参数检验Mann-Whitney U检验,进行两两比较。
结 果
1.颅内星形细胞肿瘤
35例,ITSS分级如下(图1):低级别星形细胞瘤10例,0级7例,1级3例;间变性星形细胞瘤10例,0级3例子,1级3例,2级1例,3级3例;胶质母细胞瘤15例,0级2例,1级2例,3级11例。KW检验的P值为0.036,表明三组的ITSS分级差异具有统计学意义;GBM-间变、间变-低级别、GBM-低级别两两比较后,P值分别为0.039、0.021、0.009,提示低级别星形细胞肿瘤、间变型星形细胞瘤、GBM三组间的ITSS分级差异具有统计学意义,并且随着肿瘤级别升高,ITSS分级亦升高;提示星形细胞肿瘤恶性程度升高,其自身瘤内血管增殖、微出血亦增加。
2.其他颅内肿瘤或病变
ITSS分级如下:淋巴瘤5例,0级4例,3级1例;转移瘤6例,3级6例;平滑肌肉瘤1例,3级1例;黑色素瘤1例,3级1例;炎性脱髓鞘1例,0级1例;脑膜瘤16例,0级5例,1级10例,3级1例;神经鞘瘤6例,1级1例,2级2例,3级3例;血管母细胞瘤2例,1级2例;髓母细胞瘤2例,0级1例,1级1例。高级别星形细胞肿瘤/GBM与其他单发恶性肿瘤的鉴别诊断见表1。
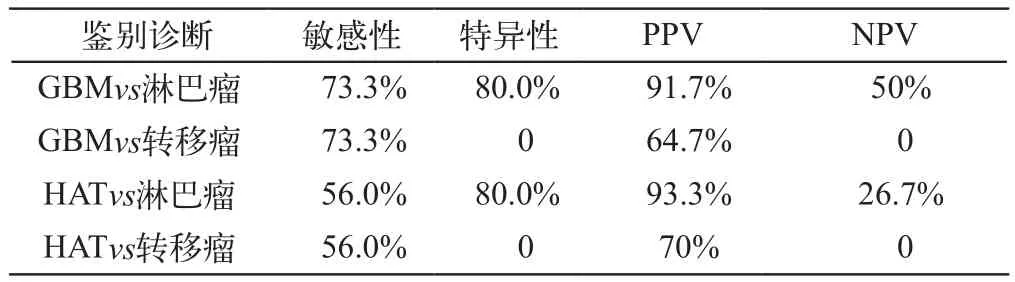
表1 GBM/HAT与颅内其他单发性肿瘤(淋巴瘤、转移瘤)的鉴别诊断
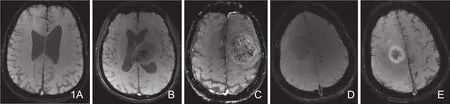
图1 低级别星形细胞瘤、间变型星形细胞瘤、胶质母细胞瘤的幅度图,经MinIP后处理图像,可清晰显示瘤内结构。A.右侧额叶星形细胞瘤(II级),ITSS 0级;B.左侧基底节区间变型星形细胞瘤(III级),ITSS分级 3级;C.左侧额叶胶质母细胞瘤(WHO IV级),ITSS 3级。ITSS信号低的高级别星形细胞肿瘤后处理图像;D.右侧额叶间变型星形细胞瘤,ITSS分级0级;E.右侧额顶叶胶质母细胞瘤,ITSS分级I级。
讨 论
神经上皮组织来源的肿瘤(tumors of neuroepithelial tissues)占成人原发性颅内肿瘤的50%~60%,其中星形细胞肿瘤(astrocytic tumor)约占神经上皮源性肿瘤的3/4[1]。按照肿瘤的生物学特性,星形细胞肿瘤可分为两大类:一类边界清楚,较少向周围脑组织浸润,包括毛细胞型星形细胞瘤等,其临床表现与疾病进展均有典型特征,预后较好;另一类星形细胞肿瘤则无明显边界,向周围组织脑组织广泛浸润,肿瘤细胞呈间变特性,包括间变型星形细胞瘤及多形胶质母细胞瘤等,此类肿瘤呈进展性,手术为主的综合治理效果较差。根据2007年版WHO中枢神经系统肿瘤的病理分级,星形细胞肿瘤可分为I~IV级,其中I、II级属于低级别星形细胞肿瘤,III、IV级属于高级别星形细胞肿瘤,其中低及高级别的星形细胞肿瘤预后明显不同,甚至高级别星形细胞肿瘤中的间变型星形细胞瘤及多形性胶质母细胞瘤的预后也差别明显,前者生存期3~5年,后者生存期9~12个月[2]。因此,若能在术前明确肿瘤的病理级别对于治疗方案和手术方式的选择具有重要意义[3-4]。
与病理分析从微观层面入手不同的是,影像学表现能抓住病变的整体特征。MRI 检查作为脑肿瘤术前检查的重要手段,为术前评价肿瘤级别高低提供了重要信息。肿瘤的血管生成通常与其存活能力及侵袭性相关,有研究证实肿瘤生长速度越快肿瘤内微血管密度(microvasular density,MVD)也高[5]。高级别肿瘤尤其是恶性肿瘤往往血供丰富,生长迅速,这种病理血管管壁较正常血管的壁更脆弱很容易破裂出血,并且肿瘤生长迅速也导致局部组织坏死、出血,肿瘤的这种出血、坏死导致肿瘤内部结构随着肿瘤级别的增高变得更复杂,这些复杂结构的显示对肿瘤的分级具有重要意义[6]。由此可见,肿瘤的血管增殖和出血与肿瘤的病理级别密切相关。胶质瘤是颅内常见的血管化程度最高恶性肿瘤之一[7],文献报道胶质母细胞瘤的出血率高达19%,低级别的胶质瘤中12.50%可检测到出血[8]。由于肿瘤结构异常以及瘤细胞快速增殖导致其耗氧量增加,使肿瘤血管内脱氧血红蛋白含量增加,脱氧血红蛋白作为人体内源性对比剂,使得肿瘤血管及微出血灶在ESWAN序列成像。ESWAN序列是一种高分辨率的三维梯度回波成像,采用薄层无间隔扫描,可避免信号丢失,并通过一系列后处理过程对所显示的磁敏感效应进行增强处理,相对邻近层面进行最小强度投影,这种独特的数据采集和图像处理过程提高了幅度图像的对比,对具有磁敏感效应的物质高度敏感,在1.5T的MR设备上可检测到直径约几百微米的亚体素单位的静脉和血液产物[9-10]。
本研究结果显示,在星形细胞肿瘤中,低级别(I,II级)、III级、IV级肿瘤中的ITSS分级具有显著差异;高级别(III、IV级)星形细胞肿瘤具有相对更高的ITSS分级(II或III级)。由此可见,高级别星形细胞肿瘤中的血管增殖及微出血灶远较低级别星形细胞肿瘤多见,ESWAN系列从宏观层面上与病理在微观层面结果相吻合。这提示我们,ESWAN技术是一种十分有前景的、有效鉴别星形细胞瘤级别的非侵入性方法[11-13]。另外,在低级别星形细胞瘤中,WHO I级和II级的肿瘤ITSS分级并无显著性差异;在高级别星形细胞肿瘤中,间变型星形细胞瘤(WHO III级)与多形性胶质母细胞瘤(WHO IV级)的ITSS分级存在显著差异,间变型星形细胞瘤出现ITSS的频率较胶质母细胞瘤为低。在星形细胞瘤中,随着ITSS分级的增加,肿瘤的恶性程度逐渐增加。同时,有文献报道[14]称,低级别肿瘤中出现ITSS也是表明肿瘤开始浸润的重要线索,其研究发现1例脑星形细胞瘤表现为均匀长Tl长T2信号,肿瘤内无出血和坏死征象,增强后未见明显强化,常规影像学表现符合低级星形细胞瘤,而瘤体内部在SWI 序列上可见ITSS,病理学结果显示为星形细胞瘤(II-III级),因此SWI 序列条件下ITSS的出现预示着肿瘤的隐匿恶性程度较高。对于这类肿瘤而言,术前往往会低估其恶性程度,从而导致手术切除范围不足。
在本研究的其他脑肿瘤中,淋巴瘤内的ITSS分级为0~III级,但是II、III级并不常见,仅有1例为ITSS3级,因此当把ITSS3级作为标准诊断GBM或高级别星形细胞瘤时,因其特异性较高,如表1所示,易鉴别诊断GBM/HAT与淋巴瘤;转移瘤多为富血供病变,且多伴发微出血,本研究搜集均为3级,故不易利用ITSS3级鉴别GBM/HAT和孤立性转移瘤;脑膜瘤的ITSS分级多为0~I级,但是若脑膜瘤发生间变,则ITSS信号可达II~III级;神经鞘瘤分级为1~3级,但是可通过神经鞘瘤的好发部位(CP角、蝶骨脊等)与GBM/HAT相鉴别。本研究中的其他恶性脑肿瘤,如1例平滑肌肉瘤的ITSS分级为3级,1例黑色素瘤分级为3级,但是其常规MR的影像特点足以与GBM/HAT像鉴别。
有研究表明,平扫与增强后的SWI图像相比较,脑灰质及白质并无明显的信号改变,但是静脉系统信号有改变[15]。有些学者认为平扫状态下的磁敏感加权成像就足以为胶质瘤分级,结合对比剂增强的磁敏感加权成像并不能提供额外信息[13]。但是,高级别脑肿瘤(除星形细胞瘤外,还包括转移瘤、淋巴瘤等)在增强ESWAN扫描图像中,边缘多见环形高信号,如图1C及E所示,提示肿瘤的血脑屏障破坏而引起的对比剂泄漏[6,11,12],而低级别星形细胞瘤则不常见。
[1] 周良辅主编. 现代神经外科学. 上海:复旦大学出版社,2001:376-378.
[2] Sathornsumette S, Reardon DA, Desjardins A, et al.Molecular targeted therapy for malignant glioma.Cancer,2007,110:13-24.
[3] Pouratian N, Asthagiri A, Jagannathan J, et al. Surgery insight: the role of surgery in the management of low-grade gliomas. Nat Clin Pract Neurol, 2007,3:628-39.
[4] Butowski NA, Sneed PK, Chang SM. Diagnosis and treatment of recurrent high-grade astrocytoma. J Clin Oncol, 2006,24:1273-1280.
[5] Tynninen O, Aronen HJ , Ruhala M, et al . MRI enhancement and microvascular density in gliomas. Correlation with tumor cell proliferation.Invest Radiol , 1999 ,34 :427-434.
[6] Sehgal V, Delpr opostoZ, Haddar D, et al. Susceptibility weighted imaging to visualize blood products and improve tumor contrast in the study of brain masses. J Magn Reson Imaging, 2006, 24: 41-51.
[7] Tuettenberg J, Friedel C, Vajkoczy P. Angiogene sis in malignant glioma a target for anti-tumor therapy. Crit Rev Oncol Hematol,2006,59:181.
[8] Kondiziolka D,Bernstein M, Resch L, et al.Significance of hemorrhage into brain tumors: clinicopatholigical study. J Neurosurg,1987, 679:852.
[9] Sehgal V , Delproposto Z , Haacke EM , et al . Clinical applications of neuroimaging with susceptibility weighted imaging. J Magn Reson Imaging , 2005 ,22 :439-450.
[10] Noebauer-Huhmann IM, Pinker K, Barth M, et al.Contrast-enhanced,high-resolution, susceptibility weighted magnetic resonance imaging of the brain: dose dependent optimization at 3 tesla and 1.5 tesla in healthy volunteers. Invest Radiol, 2006, 41: 249-255.
[11] Hori M, Ishigame K, Kabasawa H,et al. Precontrast and postcontrast susceptibility-weighted imaging in the assessment of intracranial brain neoplasms at 1.5 T. Jpn J Radiol, 2010,28:299-304.
[12] Hori M, Mori H, Aoki S, et al. Three-dimensional susceptibilityweighted imaging at 3 T using various image analysis methods in the estimation of grading intracranial gliomas. Magn Reson Imaging,2010,28:594-598.
[13] Park MJ, Kim HS, Jahng GH, et al.Semiquantitative assessment of intratumoral susceptibility signals using non-contrast-enhanced high-field high-resolution susceptibility-weighted imaging in patients with gliomas: comparison with MR perfusion imaging.AJNR, 2009,30:1402-1408.
[14] 郑兆凤, 董 光, 王 琦, 等. 对比增强前后SWI 在脑星形细胞肿瘤分级中的诊断价值.医学影像学杂志,2011,21:797-800.
[15] El-Koussy M, Schenk P, Kiefer C,et al. Susceptibility-weighted imaging of the brain: does gadolinium administration matter?Eur J Radiol, 2012, 81:272-276.

