Cyclin D1与P27在宫颈鳞状细胞癌组织中的表达及相关性
王一娜 童亚非
(东南大学附属盐城市第三人民医院,江苏 盐城 224000)
宫颈癌是女性最常见的恶性肿瘤之一,其发病率位居女性生殖系统的首位[1]。宫颈癌有鳞状细胞癌和腺癌两种病理类型,其中鳞癌占绝大多数。目前研究认为人类乳头瘤病毒(human papillomavirus,HPV)感染导致了一系列的癌基因被激活,并且导致细胞增殖和细胞凋亡紊乱,进而导致了宫颈癌的发生[2]。目前的研究[3]表明,Cyclin D1和P27在多种恶性肿瘤中均出现表达明显异常,或者有基因多态性的异常,但是在宫颈鳞癌中的二者的表达情况即相关性目前报道较少。本次研究通过免疫组织化学染色的手段研究Cyclin D1与P27蛋白在宫颈鳞癌组织中的表达情况及其相关性,并且探讨二者在宫颈鳞癌的发病机制中的作用。
1 资料和方法
1.1病例资料
收集自2008年1月至2011年12月4年间在我院妇产科就诊并且进行活检或者手术治疗的宫颈组织172例,其中宫颈鳞癌102例,宫颈组织正常70例。宫颈鳞癌患者按照年龄进行分类,其中年龄<45岁者46例,≥45岁者56例;按照FIGO临床分期标准对宫颈癌患者进行分期,Ⅰ期22例,Ⅱ期38例,III期42例;病理诊断为高分化鳞癌14例,中分化鳞癌50例,低分化鳞癌38例;术后病理诊断确认有淋巴结转移34例,无淋巴结转移68例,宫颈癌患者在进行手术之前均没有经过放疗和化疗等治疗措施。采集病理标本均采用4%多聚甲醛进行固定,常规石蜡包埋切片,切片厚度为5 μm。
1.2实验方法
石蜡切片常规脱蜡水化,微波修复5 min,3%过氧化氢孵育10 min去除内源性过氧化物酶,用5%正常兔血清封闭20 min后加羊抗人Cyclin D1一抗( 1∶100, 美国Sigma公司) ,羊抗人P27一抗(1∶200, 美国Sigma公司),室温过夜,PBST清洗,加辣根过氧化物酶标记的兔抗羊IgG二抗( 1∶100,美国Santa Cruz公司)室温孵育40 min;PBST清洗,加Elite-AP(英国Vector公司)孵育15 min,PBST清洗,DAB底物液(英国Vector公司)显色20 min,苏木素复染30 min,常规酒精脱水,二甲苯透明,中性树胶封片,待干燥后光镜下观察摄片。
1.3染色结果判断
染色结果显示Cyclin D1和P27均定位于胞核中,以细胞核出现棕黄色染色作为阳性。在高倍镜下随机选取5个视野,每个视野计数200个细胞,根据阳性细胞在全部组织细胞中所占比例判定实验结果,阳性细胞数占全部组织细胞数比例<10%判断为(-),阳性细胞数占全部组织细胞数比例为10%~49%之间判断为(+),阳性细胞数占全部组织细胞比例阳性细胞数≥50%判断为(++),以(+)及以上作为阳性。
1.4统计学方法
所有的数据使用SPSS18.0统计学软件进行分析,各组样本之间的比较采用χ2检验进行统计分析,Cyclin D1和P27之间的相关关系采用Spearman等级相关检验进行统计分析,以P≤0.05作为有统计学意义。
2 结 果
2.1Cyclin D1和P27在不同组织中的阳性表达情况
Cyclin D1和P27在宫颈正常组织和宫颈鳞癌组织中的表达情况见表1。Cyclin D1在宫颈鳞癌中的阳性表达率明显高于宫颈正常组织,差异具有统计学意义(χ2=50.12,P<0.05)。P27在宫颈正常组织中阳性表达率高于宫颈鳞癌组织,并且差异具有统计学意义(χ2=71.70,P<0.05)。

表1 Cyclin D1和P27在不同宫颈组织中阳性表达情况
2.2Cyclin D1和P27在宫颈鳞癌组织中的表达以及与临床病理指标的关系
Cyclin D1和P27在宫颈鳞癌阳性表达情况与年龄、FIGO临床分期、病理分级和淋巴结转移等临床病例指标的关系见表2。

表2 Cyclin D1和P27在宫颈鳞癌组织中的表达以及与临床病理指标的关系
2.3Cyclin D1和P27在宫颈鳞癌组织表达的相关性
使用Spearman等级相关检验分析二者之间的相关关系,结果为r=-0.46,P<0.05,提示Cyclin D1和P27在宫颈鳞癌组织表达存在负相关,见表3。
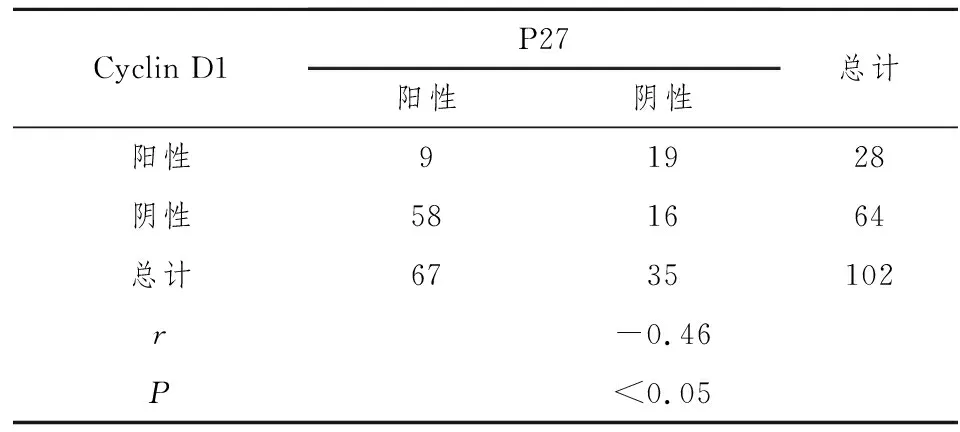
表3 Cyclin D1和P27在宫颈鳞癌组织表达的相关性
3 讨 论
目前的研究已经证实,宫颈癌的发生主要是感染HPV后,引发的局部宫颈组织的细胞增殖和凋亡之间的平衡被打破有密切关系。本研究通过免疫组化的方法来研究Cyclin D1和P27在宫颈鳞癌组织中的表达情况,结果显示Cyclin D1在宫颈正常组织中的阳性表达率明显的低于宫颈鳞癌组织,而P27在上述两种组织中的阳性表达率正好相反,并且两者之间的差异均具有统计学意义(P<0.05);通过分析Cyclin D1和P27在宫颈鳞癌阳性表达情况与年龄、FIGO临床分期、病理分级和淋巴结转移等临床病理指标的关系,结果发现Cyclin D1在宫颈鳞癌中阳性表达率和年龄无关,但是在临床分期晚、低分化和有淋巴转移的患者中的阳性表达率明显的高于临床分期早、高分化没有淋巴转移的患者,并且差异均具有统计学意义(P<0.05)。Cyclin D1 是细胞周期相关蛋白家族成员之一,其主要的功能是精确调控细胞周期,维持细胞正常生长发育平衡[4]。CyclinD1在G1 期与CDK4/CDK6 结合,并且使CDK4/CDK6活化,CDK4/CDK6能够使得Rb磷酸化,磷酸化的pRb 活化E2F促进DNA合成,促使细胞由G1 期进入S 期[5-6]。 研究还表明,Cyclin D1 蛋白过表达可能导致细胞持续性增殖,最终形成肿瘤[7]。学者Li S[8]通过研究卵巢癌组织中的Cyclin D1的蛋白表达水平,结果发现,Cyclin D1在临床分期较晚、分化程度较低的患者中的阳性表达率明显增高,和我们的研究结果基本一致。
目前的研究结果,野生型P27 基因是一种抑癌基因。在正常细胞周期中, P27 的功能是抑制CDK4 发生磷酸化,从而抑制CyclinD1/CDK4复合物的活性,阻止细胞进入S 期[9-10]。我们的研究表明,P27在正常宫颈组织中的阳性表达率明显高于宫颈鳞癌组织,并且在临床分期晚、低分化和有淋巴转移的患者中的阳性表达率明显低于临床分期早、高分化和没有淋巴转移的患者,差异均具有统计学意义(P<0.05)。现有的研究[11]表明,P27表达水平下降或者P27基因发生突变,即由野生型P27变为突变型P27,都能够导致对CyclinD1/CDK4复合物抑制减少,进而导致细胞周期过快运行,细胞增殖明显增加,导致肿瘤的发生。 我们的研究结果和Huang LW等人[12]的研究结果基本一致。
本研究还显示CyclinD1与P27在宫颈鳞癌中的表达呈负相关,提示P27可能通过影响CyclinD1的表达水平来调控细胞的凋亡,其主要的作用机制在于P27能够通过直接下调CyclinD1/CDK4复合物的活性,推迟细胞从G1期进入S期。而P27表达水平下调则会减少CyclinD1/CDK4复合物的抑制作用,从而刺激细胞增殖,导致肿瘤的发生[13]。
我们的研究结果表明,CyclinD1在宫颈鳞癌的组织中高表达,并且其表达水平和临床分期、病理分级以及淋巴结转移相关;P27在宫颈鳞癌的组织中低表达,并且其表达水平和临床分期、病理分级以及淋巴结转移相关;CyclinD1和P27在宫颈鳞癌的组织负相关,提示CyclinD1和P27在宫颈鳞癌的发生发展中起到了协同作用。
[1] Pochylski T, Kwasniewska A. Absence of point mutation in codons 12 and 13 of K-RAS oncogene in HPV-associated high grade dysplasia and squamous cell cervical carcinoma[J]. Eur J Obstet Gynecol Reprod Biol, 2003,111(1):68-73.
[2] Adurthi S, Krishna S, Mukherjee G, et al. Regulatory T cells in a spectrum of HPV-induced cervical lesions: cervicitis, cervical intraepithelial neoplasia and squamous cell carcinoma[J]. Am J Reprod Immunol, 2008,60(1):55-65.
[3] Beecken WD, Ringel EM, Babica J, et al. Plasmin-clipped beta(2)-glycoprotein-I inhibits endothelial cell growth by down-regulating cyclin A, B and D1 and up-regulating p21 and p27[J]. Cancer Lett, 2010,296(2):160-167.
[4] Shi Y, Tao Y, Jiang Y, et al. Nuclear epidermal growth factor receptor interacts with transcriptional intermediary factor 2 to activate cyclin D1 gene expression triggered by the oncoprotein latent membrane protein 1[J]. Carcinogenesis, 2012,33(8):1468-1478.
[5] Yang W, Xia Y, Hawke D, et al. PKM2 phosphorylates histone H3 and promotes gene transcription and tumorigenesis[J]. Cell, 2012,150(4):685-696.
[6] Verlinden L, Verstuyf A, Convents R, et al. Action of 1,25(OH)2D3on the cell cycle genes, cyclin D1, p21 and p27 in MCF-7 cells[J]. Mol Cell Endocrinol, 1998,142(1-2):57-65.
[7] Gorbahn M, Klein MO, Lehnert M, et al. Promotion of osteogenic cell response using quasicovalent immobilized fibronectin on titanium surfaces: introduction of a novel biomimetic layer system[J]. J Oral Maxillofac Surg, 2012,70(8):1827-1834.
[8] Sui L, Tokuda M, Ohno M, et al. The concurrent expression of p27(kip1) and cyclin D1 in epithelial ovarian tumors[J]. Gynecol Oncol, 1999,73(2):202-209.
[9] Kase S, Takahashi S, Sato I, et al. Expression of p27(KIP1) and cyclin D1, and cell proliferation in human pterygium[J]. Br J Ophthalmol, 2007,91(7):958-961.
[10] Tong L. Expression of p27(KIP1) and cyclin D1, and cell proliferation in human pterygium[J]. Br J Ophthalmol, 2008,92(1):157.
[11] Sui L, Tokuda M, Ohno M, et al. The concurrent expression of p27(kip1) and cyclin D1 in epithelial ovarian tumors[J]. Gynecol Oncol, 1999,73(2):202-209.
[12] Huang LW, Chao SL, Hwang JL, et al. Down-regulation of p27 is associated with malignant transformation and aggressive phenotype of cervical neoplasms[J]. Gynecol Oncol, 2002,85(3):524-528.
[13] Mundle SD. Targeting cyclin D1 for high risk myelodysplastic syndromes[J]. Leuk Res, 2012,36(8):964-965.

