99Tcm-膜连蛋白V在下腔静脉血栓模型家兔体内生物分布
吴大勇,张文艳,边艳珠,胡玉敬
(河北省人民医院 核医学科,河北 石家庄 050051)
深静脉血栓形成(deep venous thrombosis,DVT)是导致肺动脉血栓栓塞(pulmonary thromboembolism,PTE)的主要原因,51%~71%下肢 DVT 患者可能发生PTE[1]。DVT的影像诊断主要依靠超声检查,而超声检查不能分辨新鲜与陈旧静脉血栓,因此存在明显的不足[2]。
急性新鲜血栓中血小板活化后膜表面暴露带负电荷磷脂酰丝氨酸(phosphatidylserine,PS),膜连蛋白 V(Annexin V)依赖钙离子能够特异的与PS结合,具有纳摩尔级的亲和力[3]。
PTE误诊率、病死率高,西方国家DVT和PTE的年发病率分别为 0.1%和 0.05%[4]。急性静脉血栓主要为新鲜混合血栓,其中混合血栓内的白色血栓部分富含活化血小板,而形成时间较长的静脉陈旧混合血栓,多发生机化血栓活化血小板明显减少[5]。新鲜静脉血栓较陈旧机化血栓脱落风险更大,二者的鉴别对制定临床治疗计划具有关键意义[6]。
根据与活化血小板结合的靶位点不同,血栓活化血小板显像剂主要分为与GPIIbIIIa受体结合、与P-选择素结合、与PS结合三类[7]。与GPIIbIIIa受体结合的显像剂研究较多[8-11],99Tcm-P280已被美国FDA批准应用于临床急性下肢血栓显像。但多肽制备成本高,价格昂贵,其应用受到一定限制。季顺东[12]、吴锦昌[13]、方纬[14]等利用99Tcm标记国内自行研制的P-选择素单克隆抗体SZ-51成功对新鲜动脉、下肢深静脉及肺动脉血栓显像,但单克隆抗体相对分子质量较大,血液清除较慢,显像中本底较高,图像质量亦受到一定影响。
与PS结合的显像剂主要为放射性核素标记Annexin V,已有关于99Tcm-Annexin V对急性左房血栓[15]、腹主动脉瘤附壁血栓[16]、感染性心内膜炎血栓性赘生物[17]、新鲜动脉血栓[18-20]显像研究的报道。Rouzet F等[17]实验中观察到在制备感染性心内膜炎动物模型过程中,因导管损伤上腔静脉内壁形成的静脉血栓摄取99Tcm-Annexin V以及肺内栓子摄取99Tcm-Annexin V,这也为99Tcm-Annexin V静脉血栓显像及肺动脉栓塞血栓显像提供了依据。
本实验拟研究99Tcm-Annexin V在下腔静脉血栓模型家兔的体内分布,并对新鲜与陈旧静脉血栓对99Tcm-Annexin V的摄取情况进行分析。
1 材料与方法
1.1 主要仪器与试剂
ZD-6000井型γ计数锝分析仪:西安志达公司产品;钼锝发生器:北京原子高科股分有限公司产品;Annexin V(Bender Medsystems公司)、氯化亚锡:分析纯,天津市化学试剂三厂产品;新华1号滤纸:北京师范大学化学院惠赠;丙酮:分析纯,天津市富宇精细化工有限公司产品;柠檬酸、柠檬酸钠:分析纯,天津市博迪化工股份有限公司产品;葡萄糖:分析纯,天津市百世化工有限公司产品;酒石酸钾钠:分析纯,天津市永大化学试剂有限公司产品。
1.2 实验动物
新西兰家兔:15只,雌雄不拘,体重2.0~2.5 kg,购自河北医科大学实验动物中心,合格证编号为1009032。
2 实验方法
2.1 99Tcm-Annexin V制备
取柠檬酸0.48 g、柠檬酸钠1.32 g、葡萄糖1.47 g,置于烧杯中加100 mL蒸馏水,搅拌至充分溶解,制备柠檬酸葡萄糖溶液(ACD)待用。参照文献[21]取一洁净反应瓶,加入Annexin V 30 μg、ACD溶液500 μL、酒石酸钾钠溶液(10 g/L)100 μL、SnCl2/HCl溶液(2 g/L)10 μL,摇匀,充分反应,2~4 ℃冰箱冷藏20 min,加入高锝酸钠溶液1 mL(1 110 GBq/L),室温下反应20 min,完成标记。利用新华1号滤纸为固定相、丙酮做展开剂,测定99Tcm-Annexin V 的Rf,测定99Tcm-Annexin V标记率,室温下及37 ℃恒温箱保存1、2、3、4、5及8 h的放化纯度。
2.2 下腔静脉血栓模型家兔的建立
3%戊巴比妥钠1~1.3 mL/kg耳缘静脉注射麻醉后固定于手术台,右侧腹备皮,沿腹直肌右外侧线切开皮肤4~6 cm切口,逐层钝性分离腹壁肌肉、腹膜,入腹腔后钝性分离后腹膜,暴露右肾下极水平以远约4 cm长下腔静脉,将长约3 cm自制单股螺旋铜丝向心方向穿刺入下腔静脉留置,缝合血管,止血,观察下腔静脉回流通畅后回纳肠管,逐层缝合腹膜、肌肉、皮肤。家兔术后清洁环境饲养。
2.3 99Tcm-Annexin V的家兔体内分布
将15只实验兔随机分为新鲜血栓组、陈旧血栓组及对照组,每组5只。前两组建立下腔静脉血栓模型,对照组与血栓组进行相同的手术过程,但未在下腔静脉内置入螺旋铜丝。新鲜血栓组与对照组于术后1 d进行体内分布实验,陈旧血栓组于术后14 d进行体内分布实验。
各组实验兔均经耳缘静脉注射99Tcm-Annexin V 4 mCi,于注射99Tcm-Annexin V 1 h后均经耳缘静脉注射过量戊巴比妥钠处死,分离组织、血栓,计算放射性摄取率。新鲜血栓组和陈旧血栓组分别取血栓、血液、血栓部位下腔静脉血管、头侧下腔静脉血管、后肢肌肉、胃、心、肺、肝、肾、脾、骨及小肠组织;对照组取对应组织。将上述所取组织生理盐水冲洗干净,纱布粘干,测所取各组织及血液放射性计数并准确称重,计算所取标本的放射性摄取率(%ID/g)。计算两血栓组血栓分别与血液、血栓部位下腔静脉血管、头侧下腔静脉血管、肌肉的放射性摄取比(T/NT)。
2.4 病理检查
两血栓组血栓称重及测量放射性计数完毕后,立即置于福尔马林固定液中。将所留存血栓标本进行HE染色确定血栓病理特征。
2.5 统计学分析
3 结果与讨论
3.1 99Tcm-Annexin V标记
测定99Tcm-Annexin V 的Rf为0.1。99Tcm-Annexin V标记率为98%,室温下及标记后37 ℃恒温水浴箱保存4 h内放化纯度均高于95%,8 h放化纯度仍大于90%,标记物体外稳定性良好。
3.2 病理检查
新鲜与陈旧血栓组血栓及病理图示于图1。新鲜血栓组实验兔解剖后下腔静脉内肉眼均可见血栓形成,血栓沿螺旋铜丝红白相间或以白色为主。陈旧血栓组解剖后肉眼亦均可见血栓形成,血栓沿螺旋铜丝红白相间;对照组解剖后下腔静脉内未见血栓形成,下腔静脉回流通畅。新鲜血栓组、陈旧血栓组实验兔血栓重量分别为(0.058±0.013)g和(0.088±0.064)g。
3.3 99Tcm-Annexin V的家兔体内分布
99Tcm-Annexin V在家兔体内分布结果列于表1。新鲜血栓组、陈旧血栓组血栓放射性摄取率分别为(0.018 94±0.002 16)%ID/g、(0.004 73±0.001 28)%ID/g。新鲜血栓组血栓放射性摄取率与陈旧血栓组进行两样本t检验,结果差异有统计学意义(t=12.66,P<0.05)。新鲜血栓组血栓与血液、血栓与血栓部位下腔静脉血管、血栓与头侧下腔静脉血管、血栓与肌肉的T/NT分别为3.42±1.06、26.32±13.60、31.23±16.00、111.62±52.23,高于陈旧血栓组:0.98±0.09、5.12±2.01、6.25±2.38、21.82±5.93,两组数据分别进行两样本t检验,结果差异有统计学意义(t分别为5.14、3.44、3.45、3.82 ,P<0.05)。
新鲜血栓组血栓病理证实均为新鲜混合血栓,镜下见淡红色珊瑚状血小板小梁,小梁间纤维素网内包含红细胞,小梁边缘有较多中性粒细胞粘附(见图1a);陈旧血栓组血栓病理证实均为陈旧机化混合血栓,镜下见珊瑚状血小板小梁,小梁间隙可见多量内皮细胞分化趋势细胞,小梁间纤维素网内包含少量红细胞及较多附着的中性粒细胞,呈机化表现(见图1c)。新鲜的静脉血栓较陈旧静脉血栓含有更多的活化血小板,99Tcm-Annexin V的体内分布数据反映了这一生理特性。新鲜血栓组血栓与血液的放射性摄取比为3.42±1.06,由数据推测利用99Tcm-Annexin V显像,能够获得较清晰的图像。但三组实验兔血液放射性摄取率相对较高,可能显像本底会相对较高。

a——新鲜血栓组血栓照片,血栓沿螺旋铜丝附着;b——病理(HE染色,放大40倍),显示为新鲜混合血栓,白色血栓与红色血栓间或存在;c——陈旧血栓照片,血栓沿螺旋铜丝附着;d——病理(HE染色,放大40倍),显示为陈旧机化混合血栓,血栓小梁间隙可见多量血管内皮细胞分化趋势细胞,呈机化表现。图1 新鲜与陈旧血栓组血栓及病理图Fig.1 The thrombi of the fresh and old thrombus groups and the pathological section by Hematoxylin-eosin stains:
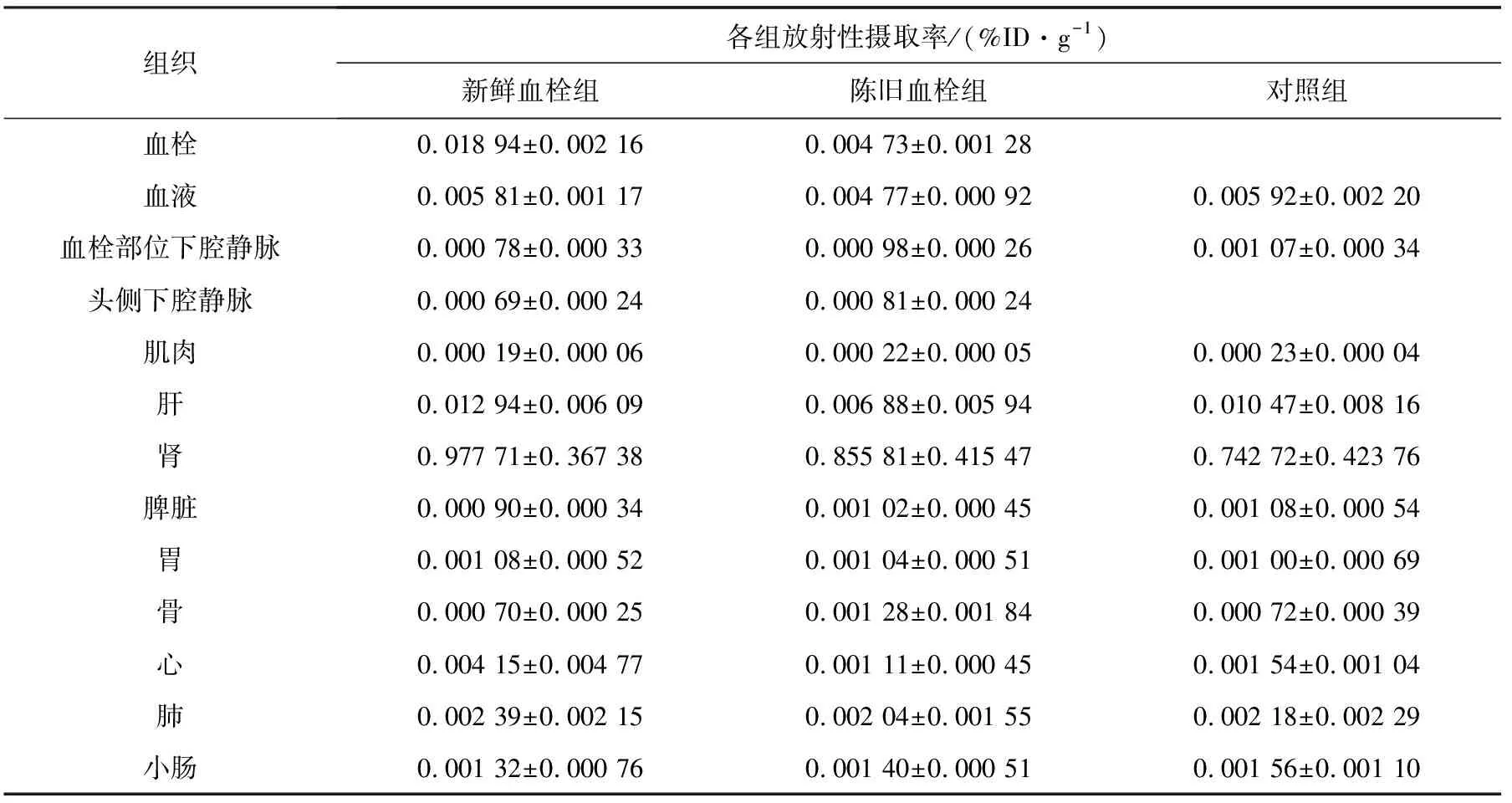
组织各组放射性摄取率/(%ID·g-1)新鲜血栓组陈旧血栓组对照组血栓 0.018 94±0.002 160.004 73±0.001 28血液0.005 81±0.001 170.004 77±0.000 920.005 92±0.002 20血栓部位下腔静脉0.000 78±0.000 330.000 98±0.000 260.001 07±0.000 34头侧下腔静脉0.000 69±0.000 240.000 81±0.000 24肌肉0.000 19±0.000 060.000 22±0.000 050.000 23±0.000 04肝0.012 94±0.006 090.006 88±0.005 940.010 47±0.008 16肾0.977 71±0.367 380.855 81±0.415 470.742 72±0.423 76脾脏0.000 90±0.000 340.001 02±0.000 450.001 08±0.000 54胃0.001 08±0.000 520.001 04±0.000 510.001 00±0.000 69骨0.000 70±0.000 250.001 28±0.001 840.000 72±0.000 39心0.004 15±0.004 770.001 11±0.000 450.001 54±0.001 04肺0.002 39±0.002 150.002 04±0.001 550.002 18±0.002 29小肠0.001 32±0.000 760.001 40±0.000 510.001 56±0.001 10
4 小结
新鲜静脉血栓对99Tcm-Annexin V的摄取明显高于陈旧静脉血栓,且新鲜血栓组血栓与血液的放射性摄取比较高,通过体内分布数据推断,99Tcm-Annexin V有望应用于新鲜静脉血栓显像,以及鉴别新鲜与陈旧静脉血栓。
参考文献:
[1]程显声, 何建国. 肺栓塞的流行病学[J].中国循环杂志, 1998, 13(2): 65-66.
[2]Vriens PW, Blankenberg FG, Stoot JH , et al. The use of technetium99Tcmannexin V for In vivo imaging of apoptosis during cardiac allograft rejection[J]. J Thorac Cardiovasc Surg , 1998, 116:844-853.
[3]Jaffer FA, Weissleder R. Seeing Within: Molecular Imaging of the Cardiovascular System[J]. Circulation, 2004, 94: 433-445.
[4]Torbicki A, Van Beek EJR, Charbonnier B, et al. Guidelines on diagnosis and management of acute pulmonary embolism[J]. Eur Heart J, 2000, 21(16): 1 301-1 336.
[5] Tadataka Hayashi,Hideo Mogami,Yusuke Mura-kami, et al. Real-time analysis of platelet aggregation and procoagulant activity during thrombus formation in vivo[J]. Pflugers Arch-Eur J Physiol, 2008, 456:1 239-1 251.
[6] 李小强, 王深明. 深静脉血栓形成的诊断和治疗指南(第2版)[J]. 中华外科杂志,2012, 50(7):611-614.
[7] 吴大勇,边艳珠. 血栓活化血小板放射性核素显性研究进展[J]. 中国医学影像技术,2011, 27(12):58-61.
[8] 何嘉,方纬,王峰,等.99Tcm-DMP444肺动脉血栓与下肢深静脉血栓显像的实验研究[J].中华核医学与分子显像杂志,2012,32(1):59-62.
[9] Lister-James J, Vallabhajosula S, Moyer BR, et al. Pre-Clinical Evaluation of 99mTechnetium Platelet Receptor Binding Peptide[J]. J Nucl Med, 1997, 38: 105-111.
[10] Knight LC, Maurer AH, Romano JE. Comparison of 123Iodine Disintegrins for Imaging Thrombi and Emboli in a Canine Model[J]. J Nucl Med, 1996, 37:476-482.
[11] Knight LC, Baidoo KE, Romano JE, et al. Imaging Pulmonary Emboli and Deep Venous Thrombi with99mTc-Bitistatin, a Platelet Binding Polypeptide from Viper Venom[J]. J Nucl Med, 2000, 41:1 056-1 064.
[12] Ji S, Fang W, Zhu M, et al.Detection of pulmonary embolism with99Tcm-labeled F(ab)2 fragment of anti-P-selectin monoclonal antibody in dogs[J]. Tohoku J Exp Med, 2011, 223(1): 9-15.
[13] 吴锦昌,何广仁,阮长耿,等.99Tcm抗人活化血小板单克隆抗体SZ51对狗动、静脉血栓的放免显像研究[J]. 中华核医学杂志,1994,14:35-37.
[14] 方纬,季顺东,刘秀杰,等. 肺动脉血栓放射免疫显像实验研究[J]. 中华核医学杂志,2002,22(3):188-190.
[15] Stratton JR, Dewhurst TA, Kasina S, et al. Selective Uptake of Radiolabeled Annexin V on Acute Porcine Left Atrial Thrombi[J]. Circulation, 1995, 92: 3 113-3 121.
[16] Sarda-Mantel L, Coutard M, Rouzet F, et al.99Tcm-Annexin V Functional Imaging of Luminal Thrombus Activity in Abdominal Aortic Aneurysms[J]. Arterioscler Thromb Vasc Biol, 2006, 26: 2 153-2 159.
[17] Rouzet F, Hernandez MD, Hervatin F, et al. 99mTechnetium Labeled Annexin V Scintigraphy of Platelet Activation in Vegetations of Experimental Endocarditis[J]. Circulation, 2008, 117:781-789.
[18] 贾支俊, 申景涛, 郭万华,等.99Tcm标重组H_AnnexinV在动物血栓显像中的研究[J]. 中华核医学杂志, 2007, 27(5) :291-294.
[19] Tait JF, Cerqueira MD, Dewhurst TA, et al. Evaluation of annexin V as a platelet-directed thrombus targeting agent[J]. Thromb Res, 1994, 75: 491-501.
[20] 吕中伟, 朱承谟, 李 彪, 等.99Tcm-Annexin V血栓显像及其体内分布的初步实验研究[J]. 上海医学影像杂志, 2000, 9(3):137-139.
[21] Zhu L, Liu BL, Guo YZ.99Tcmdirect labeling of Annexin V for potential apoptosis imaging in vivo (Abstract) [J]. J Labelled comp Radiopharm,2003, 46(1): S324.

