补饲精料对贵州黑山羊血浆抗氧化应激能力和生化指标的影响
吴文旋,段永邦
(1.贵州大学 动物科学学院,贵州 贵阳550025;2.贵州省凯里市畜牧局,贵州 凯里556004)
精粗比是用来衡量反刍动物日粮营养学特性的重要指标。精粗比大,营养水平高;反之,则营养水平低。一般而言,山羊日粮应含有一定水平的粗料,以维持瘤胃健康,因为过高精料饲粮常引起瘤胃酸中毒等疾病。但对生长期山羊来说,饲喂高含量粗料基础日粮,往往造成气体产量大,能量损失大,饲料利用率不高,不能满足其营养需要。因此,在生产实践中常采用补饲精料的方法增加养分供应,促进采食,提高生长性能[1-4]。
近年来,贵州山羊养殖规模明显扩大,存栏量大增,但传统以粗料为主、精料为辅的低营养水平饲养方式造成生长期山羊日粮养分供应明显不足,导致其生长速度较慢,不利于山羊养殖效益的提高[5]。结合贵州山羊养殖实际,笔者前期研究了补饲精料对生长期山羊生长性能的影响,发现其采食量、日增重、饲料转化率、经济效益均显著增加[6]。据此,本文探讨提高日粮精粗比对生长期山羊血液抗氧化应激和生化指标的影响,为提高我省山羊养殖技术水平提供技术积累。
1 材料与方法
1.1 试验设计
选取健康无病、体况良好,处于生长期的雌羊45只,根据月龄(15±1.3)、体重(20±2.5)kg一致或相似的原则,按单因子随机区组试验设计分为3组,每组3个重复,每个重复5只,分别饲喂对照组、试验1组、试验2组日粮。对照组山羊日粮组成:精料0.1 kg,粗料0.35 kg(田间杂草、高粱、青刈玉米、青贮高粱的混合物);试验1组、试验2组分别在对照组日粮的基础上补饲0.3 kg、0.6 kg精料混合料(含4%预混料)。为预防山羊发生瘤胃酸中毒,试验2组精料内添加2%缓冲剂。试验持续31 d,分为预饲期和正试期:第1~7 d为第一阶段(即预饲期7 d);第8~15 d为第二阶段;第16~23 d为第三阶段;第24~31 d为第四阶段。山羊精料组成与日粮营养水平见表1。
1.2 饲养管理
结合羊场实际饲养管理情况,山羊分栏全舍饲。每天10∶00、17∶00清槽后将粗料与精料充分混匀饲喂;为防止山羊采食不均,试验将饲粮均分给每头山羊饲槽,并根据采食情况对饲粮不断进行摊匀,尽量保证山羊的采食量水平一致。上午、下午山羊采食后在运动场自由运动,运动场内设有饮水槽,自由饮水。山羊粪便每周清除一次。
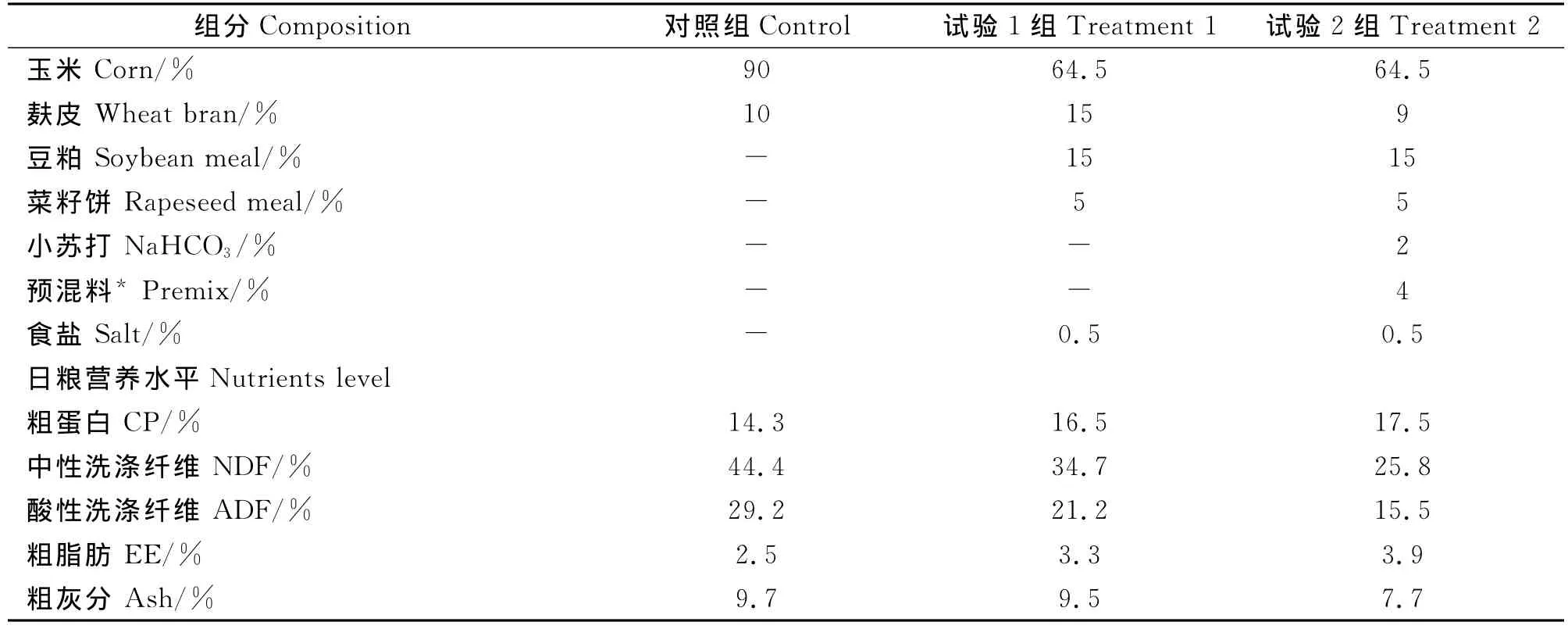
表1 山羊精料组成与日粮营养水平(绝干基础)Table 1 Concentrate composition and dietary nutrients level for growing goat(DM basis)
1.3 样品采集与指标检测
饲料样品:从预饲期开始,每3天采集1次日粮,-20℃冰柜冷冻保存。试验结束后,将其带回实验室烘干、粉碎,测定概略养分含量:粗蛋白、中性洗涤纤维、酸性洗涤纤维、粗脂肪、粗灰分。
血样:试验预定分别在4个阶段的最后1 d,对山羊称重后用一次性真空采血管从颈静脉采集10 m L,肝素钠抗凝血,3 000 r/min离心20 min,搜集上层血浆,测定抗氧化应激能力指标:总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA),生化指标:血浆尿素氮(PUN)、谷草转氨酶(AST)、甘油三酯(TG)、总胆固醇(TCH)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)。由于天气、羊场管理需要等原因的影响,山羊实际采血时间为第7、16、25、31 d,与预定时间略有差异。
1.4 数据统计及分析
应用SAS(9.2)对数据按单因素有重复观测值方式进行统计与分析,数据表示为“平均数±标准差”。试验除对单次采血点外,综合4次采血血浆指标结果进行统计分析(文中表述为整个试验期)。各组测定指标差异性多重比较用Duncan's法进行,组间差异显著水平定为(P<0.05)。
2 结果与分析
2.1 血浆抗氧化应激能力
由表2可见,3组山羊血液抗氧化应激能力指标含量在预饲期内相似,差异不显著(P>0.05);但随着时间的延续,逐渐表现出差异。在第25 d,试验2组山羊血浆T-AOC水平显著高于对照组48%(P<0.05),也高于试验1组15.6%(P>0.05);从整个试验期来看,试验1组、2组山羊血浆T-AOC水平分别较对照组提高16%(P>0.05)、28%(P<0.05)。试验1组山羊血浆SOD水平在第16 d显著高于对照组17.5%(P<0.05)和试验2组8.2%(P>0.05);在整个试验周期内,试验1组、2组山羊血浆SOD含量分别高于对照组12.7%(P<0.05)、9.7%(P<0.05)。试验1组、2组山羊血浆 GSHPx水平在第16 d较对照组高37.9%(P<0.05)、35.2%(P<0.05),在整个试验周期也显著高于对照组8.2%(P<0.05)、11.6%(P<0.05),两处理组差异不显著(P>0.05)。第25 d,试验1组山羊血浆MDA水平比对照组降低24%(P<0.05),试验2组比对照组降低10%(P>0.05);第31 d,试验2组比对照组降低25.5%(P<0.05),比试验1照组降低15.6%(P>0.05);在整个试验周期内,以试验2组MDA水平最低,显著低于对照组14.6%(P<0.05),比试验1组低7.3%(P>0.05)。可见,补饲精料可增强山羊血浆抗氧化应激能力;总体来看,试验2组效果最优。

表2 补饲精料对生长期贵州黑山羊血浆抗氧化应激的影响Table 2 Plasma anti-oxidative stress status of Guizhou black growing goats fed diets with increasing concentrate
2.2 血浆生化指标
相比之下,补饲精料对山羊血浆AST、PUN含量的影响较小(表3),除试验1组山羊血浆PUN水平在第二次采血点显著低于对照组外(P<0.05),其余各采血点和整个试验期内3组山羊血浆AST、PUN含量未表现出规律性,差异均未达显著水平(P>0.05)。同时,3组山羊血浆脂质代谢指标TG、TCH、HDLC、LDLC水平也不受补饲精料的影响,在各个采血点和整个试验期内差异均不显著(P>0.05,表3)。
3 讨 论
3.1 日粮精粗比对血浆抗氧化应激能力的影响
自由基广泛存在于动物生命代谢过程中,处于产生与消除的动态平衡状态,但这种平衡一旦被打破,就可使体内积累过多自由基而发生氧化应激[7]。氧化应激通过生物膜中不饱和脂肪酸的过氧化反应产生脂质过氧化物,破坏细胞膜的生物学构象,使膜蛋白的生物学功能丧失,降低机体免疫应答能力,对机体健康具有明显的负面效应[8]。营养调控措施(如添加维生素、微量元素、微生态制剂、改变精粗比等)是增强机体抗氧化应激能力的有效途径,已得到诸多试验结果的验证[9-11]。
T-AOC、SOD、GSH-Px、MDA是常用来表征机体抗氧化应激能力的指标。其中,T-AOC可用来综合衡量机体抗氧化系统功能的状况,是机体对外来刺激的代偿能力和自由基代谢状态的反映。SOD作为清除体内超氧阴离子自由基的辅助因子和参与转换氧自由基的过氧化物酶,具有保护细胞免受损伤的功能,可保持机体氧化应激与抗氧化应激之间的平衡状态。GSH-Px是分解体内过氧化物的重要分子,可保护细胞膜结构的完整性,具有阻止自由基对机体产生危害的功能。而作为氧自由基引起的脂质过氧化反应的终产物,MDA是间接反映机体内氧自由基代谢的状况和组织细胞受自由基攻击的程度及脂质过氧化程度。一般来说,T-AOC、SOD、GSH-Px水平升高或MDA含量降低,意味着提高了体内抗氧化应激能力[12-13]。
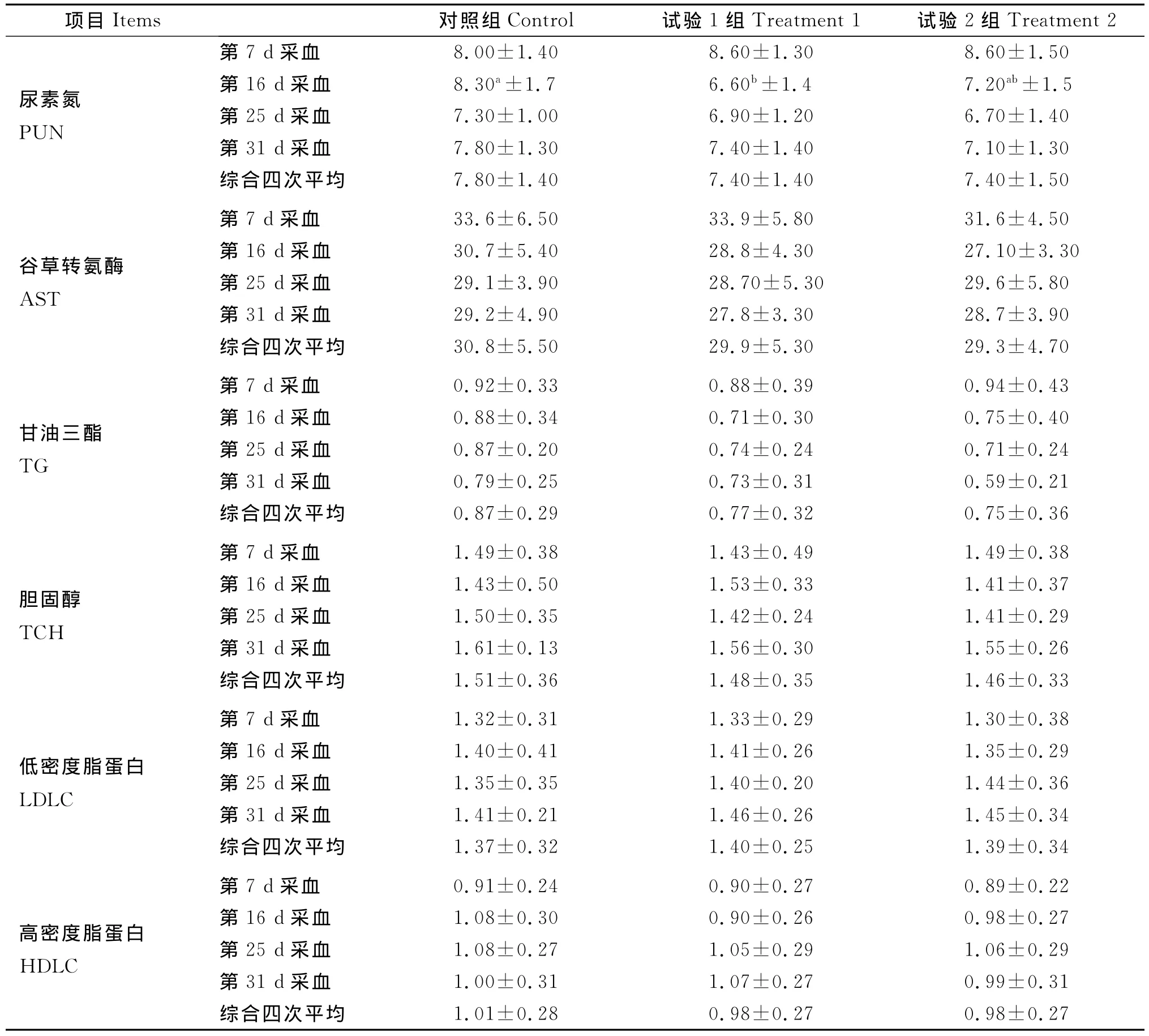
表3 不同精粗比日粮对山羊血浆生化指标的影响Table 3 Plasma biochemical metabolites of Guizhou black growing goats fed diets with increasing concentrate
张爱忠等[14]报道,日粮添加酵母硒有利于增强山羊抗氧化应激能力。许宗运等[15]在奶牛中也发现类似结果。Sgorlon等[16]指出,当精料水平由30%增至55%时,母羊血液抗氧化应激能力持续增加。侯志高等[17]研究发现,奶牛日粮精料水平在0~100%范围内,以55%组的血液抗氧化应激能力最强,低于或高于该水平均可降低抗氧化应激能力。本试验山羊日粮精料水平由22%提高至66%时,血液抗氧化应激能力持续增强,即提高T-AOC、SOD、GSH-Px水平,降低MDA含量。这可能是因为对照组山羊日粮供应量不能满足其营养需要,组织、系统内部细胞和瘤胃微生物发生异常代谢,产生了超过自身消除能力的自由基数量并不断蓄积,从而扰乱了体内氧化应激的平衡状态,发生氧化应激。本试验中发现,在增加精料供应量后,山羊的采食量、日增重和饲料利用率均显著提高[6],因为提高精料水平除可满足山羊瘤胃微生物活动的营养需要外,还可为其提供生长所需养分,在一定程度上使自由基的产生和消除处于可调控范围,稳定体内细胞氧化应激平衡状态,进而提高其抗氧化应激能力。同时,从单次采血和综合整个试验期来看,试验2组T-AOC、GSH-Px、MDA水平要优于试验1组,说明抗氧化应激能力随精料添加比例的增加而逐渐增强。这提示,贵州省当前生长期山羊日粮营养水平明显不足,需要增加精料供应量,在满足其营养需要的同时,提高抗氧化应激能力,促进山羊生长。当然,在补饲精料时,为防止精料水平过高而诱发瘤胃酸中毒,应在精料中添加缓冲剂。
综上所述,在低营养水平供应下,补饲精料可增强生长期山羊抗氧化应激能力。山羊作为反刍动物,基于瘤胃的生理重要性和独特功能,除血液指标外,后续研究可从日粮养分水平高低的角度出发,研究其对瘤胃微生物数量、区系组成、活性和组织切片病理变化与抗氧化应激能力的深层次差异。
3.2 不同日粮精粗比对血浆生化指标的影响
血液生化代谢产物是准确衡量动物机体全身或局部代谢状态和组织生理功能的重要参数,其含量过高或过低是血液异常代谢的直接体现。血浆尿素氮(PUN)是蛋白质代谢的中间或终末产物,可用来反映动物机体蛋白质/氨基酸的代谢状况,已成为血液检测的常规指标之一。PUN水平低,表明机体对蛋白质/氨基酸的利用率高;反之,则蛋白质/氨基酸的利用率就低。从本试验的结果来看,虽然只有试验1组PUN水平在第16 d显著低于对照组,但试验1组、2组PUN水平数值上均低于对照组,说明补饲精料有利于提高2个试验组山羊对日粮蛋白质/氨基酸的利用效率。汪水平等[18]发现,复方中药能在一定程度上改善肉牛对蛋白质/氨基酸的利用率。研究指出,补饲过瘤胃胆碱可降低泌乳盛期奶牛PUN水平,提高蛋白质/氨基酸的利用率[19]。
肝脏是体内重要的代谢器官,AST是反映其机能的常用指标。动物机体肝脏发生病变,可导致血液AST水平累积升高。本试验中,不同日粮精粗比对3组山羊在单一采血点和整个试验期内血浆AST含量均没有明显影响,表明本试验设计的精粗比是可控的,对生长期山羊的肝功能没有不利影响。这可能与试验2组山羊日粮中添加了缓冲剂,消除了导致肝功能受损的不利因素有关;同时提示在高精料中添加缓冲剂的必要性。
日粮精粗比对生长期山羊血浆脂质代谢指标TG、TCH、HDLC、LDLC的影响均不明显,其含量在单一采血点和整个试验期内差异均不显著。其原因可能是,补饲的精料为淀粉质类饲料,脂质含量有限,在生长期山羊体内不用于合成脂类,不足以引起其血浆脂质代谢指标的大幅变化。目前用来调控脂质代谢的途径包括复方中草药[18]、脂肪来源[20]、黄芪多糖[21]等。Löhrke等[22]在奶牛上发现,脂质过氧化与发生氧化应激存在一定的相关性。而本试验所用山羊处于生长期,可将更多的日粮养分用于满足生长需要;另外,物种及其生理阶段的差异也可能是脂质代谢指标差异不显著的原因之一。就目前的报道来说,脂质代谢异常多见于围产期奶牛处于能量负平衡,分解体贮的状况。
4 结 论
补饲精料可显著提高生长期贵州黑山羊血浆T-AOC、SOD、GSH-Px含量,降低 MDA水平,明显增强血浆抗氧化应激能力。可降低PUN水平,有助于改善对蛋白质的利用效率;对肝功能和血浆脂质代谢指标无显著影响。
[1] 郭洪杞,罗 杰.南江黄羊与贵州白山羊杂交改良试验[J].江苏农业科学,2006(3):134-136.
[2] 刘鹤翔,欧阳叙向,邓灶福,等.不同营养水平补饲对湘东黑山羊肥育羔羊生产性能的影响[J].中国草食动物,2006,26(6):9-11.
[3] 刘世杰,宋代军.精料不同补饲量对肉山羊增重的影响[J].中国草食动物,2004,24(6):21-22.
[4] 张吉鹍,包赛娜,赵 辉,等.木薯渣不同补饲方式对山羊生产性能的影响研究[J].饲料工业,2009,30(21):31-34.
[5] 宋章会.贵州山羊生产现状调查与发展对策[J].贵州畜牧兽医,2007,31(5):12-13.
[6] 段永邦,吴文旋,杨 艺,等.不同精料补饲水平对贵州黑山羊生长性能的影响[J].江苏农业科学,2012,40(1):186-188.
[7] Piccione G,Borruso M,Giannetto C,et al.Assessment of oxidative stress in dry and lactating cows[J].Acta Agriculturae Scandinavica,Section A-Animal Science,2007,57(2):101-104.
[8] Lakritz J M,Leonard J,Eichen P A,et al.Whole blood concentrations of glutathione in cattle exposed to heat stress or a combination of heat stress and endophyte-infected tall fescue toxins in controlled environmental conditions[J].Am J Vet Res,2002,63:799-803.
[9] 孙 涛,代 腊,唐飞江,等.饲料中镉对产蛋鸡生产性能、抗氧化功能及其体内残留的影响[J].畜牧兽医学报,2012,43(2):232-241.
[10] 谢全喜,崔诗法,徐海燕,等.复合微生态制剂与饲用抗生素对肉鸡生长性能、免疫性能和抗氧化指标的影响[J].动物营养学报,2012,24(7):1 336-1 344.
[11] 陈恒灿,马 黎,陈克嶙,等.丙氨酰谷氨酰胺二肽对早期断奶仔猪抗氧化能力及肠道保护的研究[J].畜牧兽医学报,2011,42(2):251-259.
[12] Sharma N,Singh N K,Singh O P,et al.Oxidative stress and antioxidant status during transition period in dairy cows[J].Asian-Aust J Anim Sci,2011,24(4):479-484.
[13] Armstrong D,Browne R.The analysis of free radicals,lipid peroxides,antioxidant enzymes and compounds related to oxidative stress as applied to the clinical chemistry laboratory[J].Advances in Experimental Medicine and Biology,1994,366:43-58.
[14] 张爱忠,卢德勋,姜 宁,等.酵母培养物对绒山羊机体抗氧化能力的影响[J].动物营养学报,2010,22(3):781-786.
[15] 许宗运,张丽娟,韩俊文.不同水平酵母硒对奶牛血液抗氧化能力的影响[J].动物营养学报,2007,19(60):753-757.
[16] Sgorlon S,Stradaioli G,Gabai G,et al.Variation of starch and fat in the diet affects metabolic status and oxidative stress in ewes[J].Small Ruminant Research,2008,74(1):123-129.
[17] 侯志高,王振勇,柴同杰,等.不同精粗比日粮对奶牛机体氧化应激和瘤胃内环境稳定性的影响[J].畜牧兽医学报,2008,39(4):455-459.
[18] 汪水平,王文娟,左福元,等.中药复方对夏季肉牛的影响:Ⅱ.血气指标、血清代谢产物浓度及免疫和抗氧化功能参数[J].畜牧兽医学报,2011,42(5):734-741.
[19] 吴文旋.过瘤胃胆碱对泌乳奶牛血液脂质代谢和抗氧化应激的影响[J].中国农学通报,2012,28(2):39-42.
[20] 潘 瑜,毛述宏,关 勇,等.饲料中不同脂肪源对鲤鱼生长性能、脂质代谢和抗氧化能力的影响[J].动物营养学报,2012,24(7):1 368-1 375.
[21] 杨秋霞,王洪芳,陈 辉,等.饲粮中添加黄芪多糖对蛋鸡血清及蛋黄中脂肪性状的影响[J].动物营养学报,2011,23(12):2 143-2 148.
[22] Löhrke B,Viergutz T,Kanitz W,et al.Hydroperoxides in circulating lipids from dairy cows:Implications for bioactivity of endogenous-oxidized lipids[J].J Dairy Sci,2005,88(5):1 708-1 710.

