基因芯片和比例法药物敏感性试验检测结核分枝杆菌对利福平和异烟肼耐药性的比较研究
欧维正,骆科文,王 燕,秦 万,蒙 俊,张廷梅
(贵阳市肺科医院,贵州贵阳550003)
目前,用于结核分枝杆菌(Mycobacterium tuberculosis,MTB)耐药性的检测方法有多种,但大部分检测方法所需时间较长。传统方法是以培养为基础的绝对浓度法和比例法,需要2~3个月时间才能得到药物敏感性结果,放射性快速诊断技术(BACTEC)可将耐药检测缩短到2~4周,但仍不能满足临床的需要。随着分子生物学理论和技术的发展,MTB基因组的破译和耐药分子机制的阐明,使我们从分子水平上认识了MTB的遗传本质和耐药机制,建立了许多先进的分子生物学方法。基因芯片就是近年发展起来的一种新方法。基因芯片是利用MTB耐药性与基因突变有关的分子机制,对其与耐药性相关的突变位点进行检测,根据检测位点的突变情况判断MTB的耐药性,将耐药性检测的时间缩短到5~6 h,达到快速、灵敏、准确检测耐药性的目的。我们用基因芯片与比例法药物敏感性试验做比较研究,检测MTB对利福平(rifampin,RFP)和异烟肼(isoniazid,INH)的耐药情况,初步评价基因芯片对快速诊断耐多药结核病(MDR-TB)的临床价值。
材料和方法
一、材料
1.检测菌株 收集贵阳市肺科医院2011至2012年间327株MTB临床分离株。比例法药物敏感性试验以MTB标准株H37Rv(ATCC 27294)为质控菌株。
2.抗结核药物 RFP和INH均为Sigma公司产品(批号分别为080M1506V和060M0090)。
3.培养基 改良罗氏培养基、RFP和INH含药改良罗氏培养基自制。用于比例法药物敏感性检测的RFP和INH含药培养基药物终浓度分别为 40 和0.2 μg/mL。
4.MTB耐药基因芯片检测试剂 由博奥生物有限公司提供[注册号为国食药监械(准)字2010第 3400383号,批号为 20120201和20120601]。检测指标包括RFP及INH的3个耐药相关基因rpoB、katG及inhA启动子的野生型及不同突变型。其中RFP耐药相关基因rpoB检测6个位点,包括531位 TCG→TTG、531位 TCG→TGG、526位 CAC→GAC、526 位 CAC→TAC、526位 CAC→CTC、526位 CAC→CGC、511位 CTG→CCG、513位 CAA→CCA、513位 CAA→AAA、516位 GAC→GTC、516位 GAC→TAC、516 位 GAC→GGC及533位CTG→CCG等13种突变型,对于INH耐药相关基因katG及inhA启动子各检测1个位点,分别为katG基因315位AGC→ACC和AGC→AAC2个突变型,inhA基因启动子-15位C→T突变型。
5.仪器 MTB耐药基因芯片配套检测仪器由博奥生物有限公司提供,包括ExtractorTM36核酸快速提取仪、BioMixerTMⅡ芯片杂交仪、Slide-WasherTM8芯片洗干仪、LuxScanTM10K-B微阵列芯片扫描仪等;TC-96/G/H(b)基因扩增仪由杭州博日科技有限公司提供。
二、方法
1.比例法药物敏感性试验 参照《结核病诊断实验室检验规程》[1]进行 MTB临床分离株的RFP和INH比例法药物敏感性试验,菌悬液首先配制成1 mg/mL,再稀释成10-2和10-4mg/mL 2个浓度,分别接种于RFP和INH含药改良罗氏培养基上。
2.DNA提取 在进行比例法药物敏感性试验后,用10 μL接种环刮取(尽量取到斜面各部分)约1/2环相同菌株按MTB耐药基因芯片检测试剂说明书提取DNA,-20℃保存备用。
3.MTB耐药基因检测 将提取的DNA按试剂说明书进行聚合酶链反应(PCR)扩增、芯片杂交、洗涤、甩干和结果扫描判读。以试剂盒自带的阴阳性对照作为质控。
4.DNA序列测定 随机将基因芯片和比例法药物敏感性试验的RFP或/和INH结果不符的16株样本DNA,委托博奥生物有限公司送第三方进行测序。
结 果
一、经改良罗氏培养基培养阳性鉴定为MTB的临床分离株,分别用基因芯片和比例法药物敏感性试验检测其对RFP和INH的耐药性,2011至2012年间共完成327株检测,其中有31株RFP或/和INH结果不符,总符合率为90.52%,见表1;二者对MDR-TB的检出率分别为18.65%和18.96%。
二、DNA测序的16株MTB结果对照基因芯片结果发现4个新的突变类型:rpoB515(A→T)、rpoB526(C→A)、rpoB516(G→A)和 rpoB531(TC→CA),不在基因芯片检测范围内。其中1株rpoB511(T→C)的突变株同时检测有rpoB526(C→A)的突变。DNA测序结果与基因芯片和比例法药物敏感性试验的结果比较见表2。
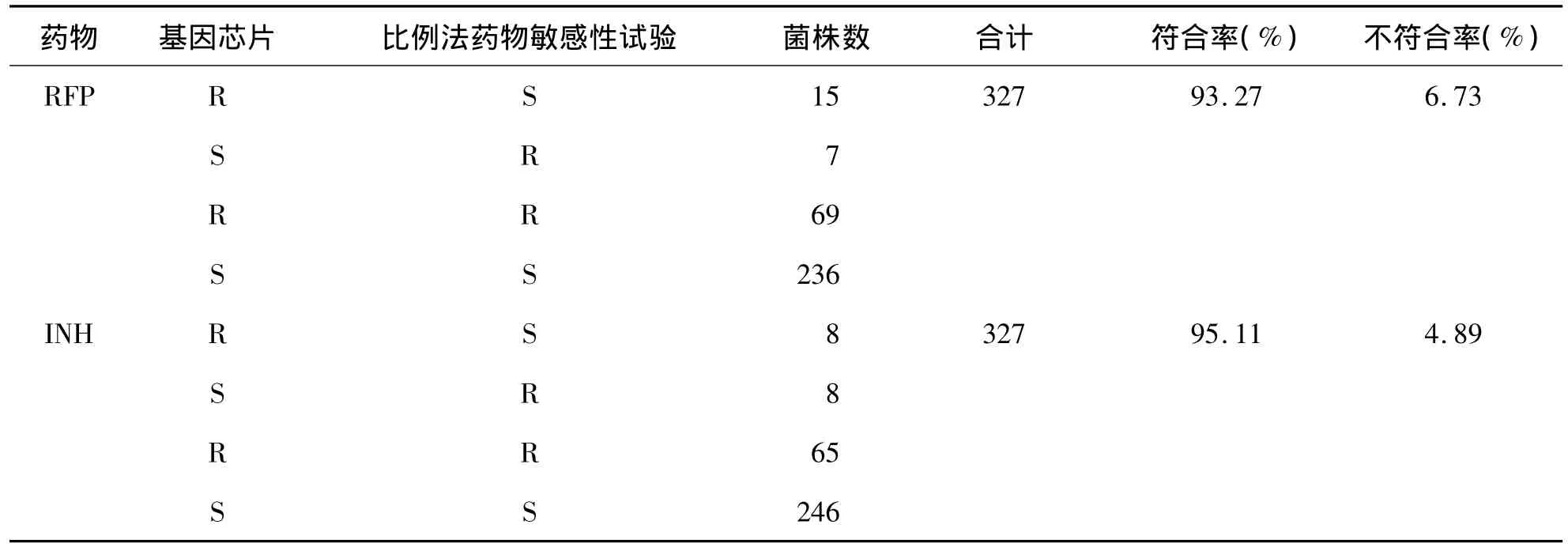
表1 基因芯片和比例法药物敏感性试验对327株MTB耐药性的检测结果比较

表2 基因芯片和比例法药物敏感性试验检测结果不符的16株MTB与DNA测序结果比较
讨 论
我国是世界第2大结核病高发国家,也是MDR-TB患者最多的国家[2]。结核病疫情恶化的原因之一是MDR-TB的出现和流行。据世界卫生组织(WHO)最新调查每年有48.9万例MDRTB患者[3],而我国9.3%的结核病患者是MDRTB,几乎是世界 MDR-TB患病率(4.8%)的2倍[4]。RFP和INH作为结核病治疗中最主要的一线抗结核药物,对其耐药性的研究日益受到重视,检测其耐药性是诊断MDR-TB的依据。
本研究用基因芯片和比例法药物敏感性试验检测MTB对RFP和INH的耐药性,基因芯片与传统的比例法药物敏感性试验相比,RFP符合率为93.27%,INH符合率为95.11%,RFP和INH的总符合率为90.52%,同时二者对MDR-TB的检出率也基本相同,分别为18.65%和18.96%,显示2种方法具有极高的可比性。表1显示,15株比例法药物敏感性试验RFP敏感株和8株比例法药物敏感性试验INH敏感株用基因芯片检测为耐药,而7株比例法药物敏感性试验RFP耐药株和8株比例法药物敏感性试验INH耐药株用基因芯片检测为敏感。为进一步研究2种方法的差异,我们从上述31株RFP或/和INH结果不符菌株中随机选出16株菌株做DNA序列测定。结果发现除3株基因芯片RFP敏感株因3个新基因突变类型不在检测范围内而漏检,1株基因芯片RFP耐药株合并有其他新基因突变类型外,其余基因芯片结果均与DNA测序结果完全符合,特别INH结果100%符合,反观比例法药物敏感性试验与DNA测序结果比较,符合率≤50.00%。表2结果提示,基因芯片较比例法药物敏感性试验与DNA测序的结果符合率更高。对于比例法药物敏感性试验敏感而基因芯片耐药菌株,可能与比例法药物敏感性试验的控制条件不良有关,也可能与某些基因位点突变的低水平耐药相关[5]。对于比例法药物敏感性试验耐药而基因芯片敏感的菌株,除上述有的基因突变类型不在基因芯片检测范围内外,比例法药物敏感性试验的控制条件不良也可能是原因之一。
有研究表明,MTB耐RFP是由于其作用靶标RNA聚合酶β亚单位的编码基因(rpoB)突变所致[6-7],其中96%的RFP耐药性与rpoB基因81 bp处的突变有关[5]。耐 INH 与 katG、inhA、ahpC 和kasA中一个或多个基因突变有关[6-7],其中约有30% ~60%的INH耐药是katG基因突变引起,少数INH的低水平耐药由inhA基因突变所致[5]。Bang等[8]对 1 825例结核病患者研究表明,katG315(G→C)和inhA基因启动子-15位C→T突变型分别占到INH高水平耐药和低水平耐药的84%。有学者认为ahpC基因突变极少,可能与耐INH无关,kasA基因突变与耐INH之间的关系还需进一步研究[9]。本研究中以比例法药物敏感性试验的耐药结果为基础,基因芯片的RFP耐药检出率为90.79%[69/(69+7)],INH的耐药检出率为89.04%[65/(65+8)],高于崔振玲等[10]报道的结果。说明本研究中的基因芯片的设计位点包括了主要的耐药基因易突变位点。对于哪些基因位点易突变、与耐药程度的关系、在本地区的突变率情况等需要进一步研究。当然,基因芯片不能检测出所有的基因突变位点,这在一定程度上也说明基因芯片技术的不足。
尽管当前基因芯片虽不能完全代替传统的药物敏感性试验方法,且检出率有待进一步提高,但基因芯片分析比传统方法明显快速,仅需5~6 h,而且基因芯片的试验条件可控性好,自动化程度高,易于标准化。本研究结果显示,基因芯片检测MTB对RFP和INH的耐药性较比例法药物敏感性试验有更高的敏感性和特异性,对MDR-TB的快速诊断具有重要的临床价值。
[1]中国防痨协会基础专业委员会.结核病诊断实验室检验规程[M].北京:中国教育文化出版社,2006:49-51.
[2]Quy HT,Lan NT,Borgdorff MW,et al.Drug resistance among failure and relapse cases of tuberculosis:is the standard retreatment regimen adequate[J].Int J Tuberc Lung Dis,2003,7(7):631-636.
[3]World Health Organization.Global tuberculosis control:epidemiology,strategy,financing [R].Geneva:World Health Organization,2009.
[4]He GX,Zhao YL,Jiang GL,et al.Prevalence of tuberculosis drug resistance in 10 provinces of China[J].BMC Infect Dis,2008,8:166.
[5]张卓然,夏梦岩,倪语星.微生物耐药的基础与临床[M].北京:人民卫生出版社,2007:193-287.
[6]吴雪琼.耐药性结核分枝杆菌的分子生物学研究现状[J].中华结核和呼吸杂志,2006,29(12):837-840.
[7]Uys PW,Warren R,van Helden PD,et al.Potential of rapid diagnosis for controlling drug-susceptible and drug-resistanttuberculosis in communities where Mycobacterium tuberculosis infections are highly prevalent[J].J Clin Microbiol,2009,47(5):1484-1490.
[8]Bang D,Andersen PH,Andersen AB,et al.Isoniazidresistant tuberculosis in Denmark:mutations,transmission and treatment outcome[J].J Infect,2010,60(6):452-457.
[9]周 江,张万江.结核分枝杆菌对异烟肼和利福平耐药的研究进展[J].中国现代医药杂志,2011,13(1):111-114.
[10]崔振玲,景奉香,胡忠义,等.基因芯片检测结核分枝杆菌利福平和异烟肼耐药性研究[J].中华结核和呼吸杂志,2004,27(7):439-441.