17-AAG通过STAT3通路调控胃癌细胞VEGF基因及蛋白表达作用探讨*
赵恩宏 许 倩 肖丽君 刘 镭 赵 爽 高亚贤 郑 鑫
虽然近年胃癌发病率有所下降,但仍然位居恶性肿瘤中第二位,严重威胁人类的健康[1]。我国胃癌死亡率居恶性肿瘤首位,占23%。影响胃癌治疗和预后的关键因素是很多胃癌在发现早期即存在较大范围的局部侵袭,甚至转移。侵袭和转移是胃癌患者死亡的主要原因。肿瘤血管新生是肿瘤侵润转移必不可少的一个环节,抗肿瘤药物对肿瘤血管新生的抑制作用越来越受到重视。17-烯丙胺-17-脱甲氧格尔德霉素(17-allylamino-17-desmethoxy-geldanamycin,17-AAG)是热休克蛋白90抑制剂,通过和热休克蛋白90特异性结合,降解其客户蛋白而发挥抗肿瘤作用。目前国内外研究主要集中于17-AAG诱导肿瘤凋亡、干扰细胞周期等作用。曾有报道显示17-AAG有抑制肿瘤侵袭、转移及新生血管生成的效果。在前期研究的工作基础上,我们观察了17-AAG对胃癌MKN-45细胞增殖的抑制作用及对VEGF、STAT3基因和蛋白表达的影响,本研究旨在探寻17-AAG是否能够通过作用于STAT3而发挥对VEGF的负性调控作用,初步探讨STAT3通路在17-AAG调控胃癌侵袭和血管生成中所发挥的作用,为17-AAG对胃癌的治疗提供潜在的新靶点。
1 材料与方法
1.1 材料
1.1.1 试剂 DMEM培养基、琼脂糖、溴化乙锭购自GIBCO BRL公司;胎牛血清购自杭州四季青公司;17-AAG购自深圳生尔易美有限公司;MTT购自美国Peprotech公司;Trizol总RNA提取试剂购自Invitrogen公司;RT-PCR试剂盒、DNA Marker购自大连Ta-KaRa公司;引物购自上海生工公司;STAT3单克隆抗体购自美国Epitmics公司;VEGF和β-ACTIN单克隆抗体购自美国Santa公司;辣根酶标记羊抗兔和羊抗鼠IgG购自美国KPL公司;BCA蛋白定量试剂盒购自博奥森公司;Prestained Protein Ladder购自Fermentas公司;ECL超敏发光液购自普利莱公司。
1.1.2 细胞来源 胃癌MKN-45细胞株为附属医院中心实验室馈赠。
1.1.3 仪器 SW-CT-2F超净工作台;XD-101倒置显微镜;LD5-2A离心机;Heraeus BB5060CO2培养箱;B10-RAD 680酶标仪;PCR仪为BIO-Rad公司;96孔细胞培养板为美国Corning公司。
1.2 方法
1.2.1 细胞培养 胃癌MKN-45细胞株生长在含10%胎牛血清的DMEM培养基中,置于37℃,5%CO2培养箱,每3d换液,进行传代培养。
1.2.2 MTT法测定细胞增殖情况 体外培养细胞至对数生长期,贴壁细胞用0.25%胰酶消化后,制成单细胞悬液,计数,离心,调整细胞浓度为5×104/mL,190 μL/孔加入到96孔板,37℃,5%CO2培养箱中,培养24 h,之后分别加入阳性对照药DOC和17-AAG,使其中终浓度为 0.160、0.31、0.62、1.25、2.50、5.00、10.0 mg/L,每个浓度设5个复孔,同时设立对照组(不加药组)和空白对照组(不加细胞也不加培养液)作为对照。培养24 h和48 h后,每孔加入5 g/L新鲜配制的MTT 10 μL/孔,继续培养4 h后,小心吸取上层培养液,每孔加入二甲基亚砜(DMSO)150 μL,震荡10 min,待蓝色结晶完全溶解后,在酶标仪492 nm、540 nm、650 nm波长处检测各孔的OD值。计算17-AAG对肿瘤细胞的生长抑制率=(1-药物孔OD值/对照孔OD值)×100%。以同一样品的不同浓度对肿瘤细胞的抑制率作图可得到剂量反应曲线,并进行回归计算,通过回归计算半数抑制浓度,即IC50。
1.2.3 RT-PCR法检测17-AAG作用后胃癌MKN-45细胞株VEGF、STAT3基因mRNA的表达 1)总RNA的提取:终止培养后,每孔加入500 μL Trizol提取液,按照试剂提取操作流程进行RNA提取,测定RNA浓度、完整度和纯度;2)反转录合成cDNA:参照TaKa-Ra公司RT-PCR(AMV)试剂盒的具体步骤和要求,依次加入总RNA 1.5 μg,10×RT buffer 1 μL dNTPmix1μL,MgCL22 μL,Oligo16-180.5μL,RNase Inhibitor 0.25μL,补水至总反应体系为20 μL,充分混匀后置于常规PCR仪中,设定温度:30℃、10 min,42℃、30 min,99℃、5 min,5℃、5 min。所得cDNA产物置于-20℃冰箱中保存备用;3)RT-PCR:参照试剂说明书的具体要求和步骤,扩增条件见表1。

表1 RT-PCR引物序列和产物大小及反应条件Table1 Primer sequences,products size and conditions for RT-PCR
将产物于2%琼脂糖凝胶电泳,恒压120 V,30 min,UVP成像分析系统拍照观察。图片扫描图像用Quantity One软件进行灰度分析,每组实验至少重复5次,计算目的基因条带与内参照(β-actin)的灰度比值。
1.2.4 Western Blotting法检测17-AAG作用后胃癌MKN-45细胞株STAT3、VEGF蛋白的表达 1)总蛋白的提取:体外培养细胞至对数生长期,贴壁细胞用0.25%胰酶消化后,制成单细胞悬液,计数,离心,调整细胞浓度为5×104/mL,3 mL/孔加入6孔板,37℃,5%CO2培养箱中,培养48 h,之后分别加入17-AAG,使其中终浓度为1.0、2.0、3.0、5.0 mg/L,每个浓度设5个复孔,同时设立对照组(不加药组)作为对照。48 h后终止培养,温和PBS洗细胞2次,加入冰预冷的适量细胞裂解液,冰上裂解20 min,4℃,12 000 rpm离心20 min,收集上清,按照BCA蛋白定量试剂盒说明进行定量。
2)取 50 μg蛋白与 5×SDS加样缓冲液混合,100℃变性5 min,用8%SDS-聚丙烯酰胺凝胶电泳分离,电转移至PVDF膜上,以含5%脱脂奶粉TBS-T溶液(10 mmol/L Tris-CL,100 mmol/L NaCL+0.1%Tween 20)封闭,室温下与兔抗人STAT3、VEGF单克隆抗体(1∶300稀释)共同孵育,再与相应的HR-PO抗Ig抗体耦联物(1∶2 000稀释)孵育,以上步骤间用TBS-T常温下充分洗膜。ECL检测试剂盒显影,洗片。同样方法,以β-actin(1∶100稀释)杂交做为内对照。胶片经扫描仪扫描后获得图像,用Quantity one分析软件测定条带灰度值,计算STAT3、VEGF的相对含量=STAT3、VEGF蛋白条带灰度值/内对照β-actin蛋白条带灰度值。
1.3 统计学方法
采用SPSS 11.5统计软件包进行统计学分析。数据资料用±s表示,采用单因素方差分析或重复测量资料的方差分析对数据进行处理。单因素方差分析两两比较时采用SNK-q检验。以P≤0.05为差异具有统计学意义。
2 结果
2.1 17-AAG对MKN-45细胞增殖影响
结果表明,17-AAG在体外细胞试验中其浓度0.165~10 μg/mL时对胃癌MKN-45细胞有显著的抑制作用,且有明显的量效关系;体外作用48 h的抑制率优于24 h(表2,图1)。
表2 17-AAG体外不同作用时间对MKN-45细胞抑制率(n=5,±s,%)Table2 Inhibition ratio of 17-AAG at various action times in vitro on MKN-45 cells

表2 17-AAG体外不同作用时间对MKN-45细胞抑制率(n=5,±s,%)Table2 Inhibition ratio of 17-AAG at various action times in vitro on MKN-45 cells
P<0.01 vs. control group;△IC50:the mean value of three repetition
P<0.01 vs.control group;△IC50:the mean value of three repetitionInhibitory rate 45.79 39.52 34.75 31.7 21.75 19.1 18.1748 h after transfection 8.32
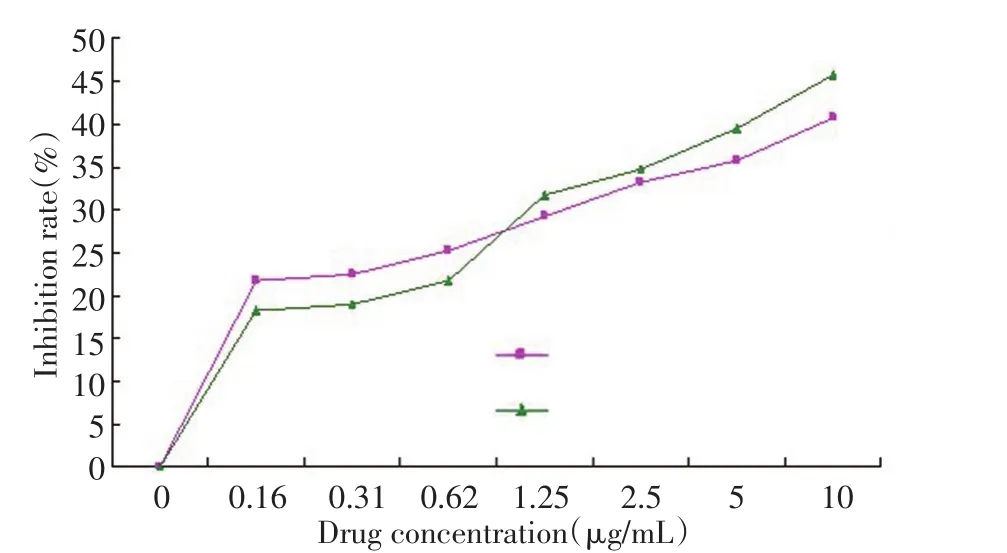
图1 17-AAG体外不同作用浓度对人胃癌MKN-45细胞抑制率Figure1 Inhibition ratio of various concentrations of 17-AAG in vitro on MKN-45 human gastric cancer cells
2.2 人MKN-45细胞株STAT3、VEGF基因mRNA的表达
2.2.1 不同作用浓度17-AAG对人MKN-45细胞STAT3、VEGF基因mRNA表达的影响 结果表明,17-AAG分别以1.00、2.00、3.00、5.00 mg/L的浓度作用于各组细胞48h后,VEGF、STAT3 mRNA的表达量逐渐降低,呈一定的浓度依赖性。各实验组与对照组,各组之间两两比较,差异均有统计学意义(P<0.05,表3,图2)。
表3 不同作用浓度17-AAG对MKN-45细胞系VEGF、STAT3基因mRNA表达的影响(±s)Table3 Effect of various concentrations of 17-AAG on STAT3 and VEGF gene mRAN expressions in MKN-45 cells

表3 不同作用浓度17-AAG对MKN-45细胞系VEGF、STAT3基因mRNA表达的影响(±s)Table3 Effect of various concentrations of 17-AAG on STAT3 and VEGF gene mRAN expressions in MKN-45 cells
*P<0.05 vs.control group;△P<0.05 vs.1.0μg/mL group;▲P<0.05 vs.2.0μg/mL group;☆P<0.05 vs.3.0 μg/mL group;■P<0.05
Group 1 2 3 4 5 F Concentration of 17-AAG(μg/mL)Control 1 2 3 5 n 5 5 5 5 5STAT3/β-ACTIN 2.7±0.02 1.54±0.04△1.29±0.04△▲1.22±0.02△▲☆0.83±0.06△▲☆■VEGF/β-ACTIN 0.94±0.06 0.73±0.06△0.57±0.04△▲0.42±0.05△▲☆0.23±0.05△▲☆■136.00**P<0.05 vs.control group;△P<0.05 vs.1.0μg/mL group;▲P<0.05 vs.2.0μg/mL group;☆P<0.05 vs.3.0 μg/mL group;■P<0.05

图2 不同作用浓度17-AAG对MKN-45细胞中STAT3、VEGF mRNA表达的影响Figure2 Effect of various concentrations of 17-AAG on STAT3 and VEGF mRAN expressions in MKN-45 cells
2.2.2 不同作用时间17-AAG对MKN-45细胞STAT3、VEGF mRNA表达的影响 结果表明,以3.0 mg/L 17-AAG作用于MKN-45细胞12、24、48 h后,VEGF、STAT3 mRNA的表达量逐渐降低,呈一定的时间依赖性。各实验组与对照组,各组之间两两比较,差异均有统计学意义(P<0.05,表4,图3)。
表4 不同时间17-AAG对人MKN-45细胞STAT3、VEGF mRNA表达的影响(±s,n=5)Table4 Effect of various concentrations of 17-AAG on STAT3 and VEGF protein expressions in MKN-45 human cells

表4 不同时间17-AAG对人MKN-45细胞STAT3、VEGF mRNA表达的影响(±s,n=5)Table4 Effect of various concentrations of 17-AAG on STAT3 and VEGF protein expressions in MKN-45 human cells
*P<0.05 vs.control group;△P <0.05 vs.12h group;▲P <0.05 vs.24 h group;☆P<0.05
Group 1 2 3 4 F Time(h)Control 12 24 48 n 5 5 5 5STAT3/β-actin 8.27±0.18 6.23±0.34△4.44±0.26△▲2.29±0.26△▲☆VEGF/β-actin 0.49±0.04 0.43±0.05△0.26±0.04△▲0.10±0.01△▲☆111.25**P<0.05 vs.control group;△P <0.05 vs.12h group;▲P <0.05 vs.24 h group;☆P<0.05

图3 不同作用时间17-AAG对MKN-45细胞中VEGF、STAT3 mRNA表达的影响Figure3 Effect of 17-AAG at various action times on VEGF and STAT3 mRNA expressions in MKN-45 cells
2.3 人MKN-45细胞STAT3、VEGF蛋白的表达
2.3.1 不同作用浓度17-AAG对人MKN-45细胞系STAT3、VEGF蛋白表达的影响 结果表明,17-AAG分别以1.00、2.00、3.00、5.00 mg/L的浓度作用于各组细胞48 h后,各组细胞STAT3、VEGF蛋白的表达量逐渐降低,呈一定的浓度依赖性。各实验组与对照组,各组之间两两比较,差异均有统计学意义(P<0.05,表5,图4)。
表5 不同浓度17-AAG对人MKN-45细胞系STAT3、VEGF蛋白表达的影响(±s,n=5)Table5 Effect of 17-AAG at various action times on STAT3 and VEGF mRNA expressions in MKN-45 human cells
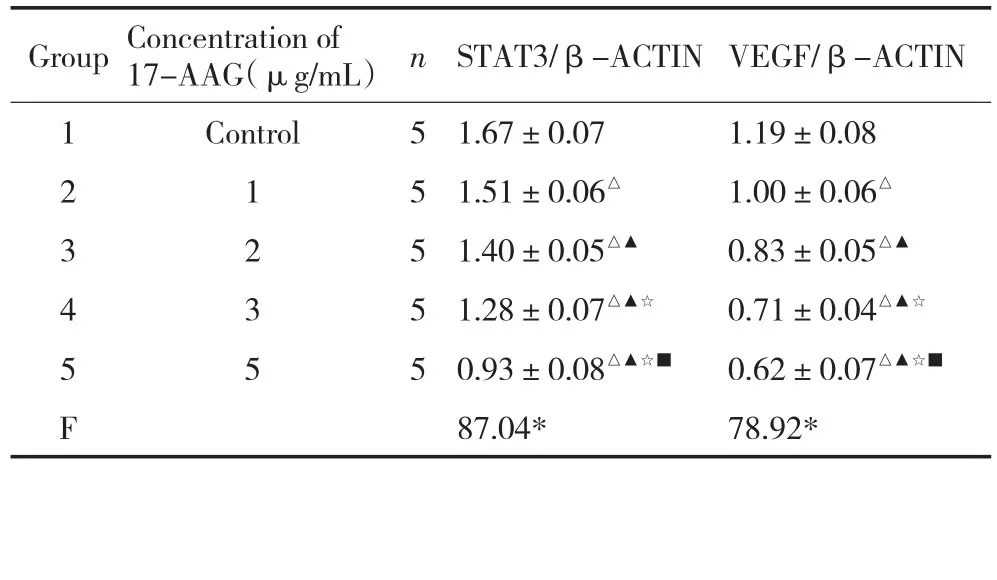
表5 不同浓度17-AAG对人MKN-45细胞系STAT3、VEGF蛋白表达的影响(±s,n=5)Table5 Effect of 17-AAG at various action times on STAT3 and VEGF mRNA expressions in MKN-45 human cells
*P<0.05 vs.control group;△P<0.05 vs.1.0μg/mL group;▲P<0.05 vs.2.0 μg/mL group;☆P<0.05 vs.3.0 μg/mL group;■P<0.05
VEGF/β-ACTIN 1.19±0.08 1.00±0.06△0.83±0.05△▲0.71±0.04△▲☆0.62±0.07△▲☆■78.92**P<0.05 vs.control group;△P<0.05 vs.1.0μg/mL group;▲P<0.05 vs.2.0 μg/mL group;☆P<0.05 vs.3.0 μg/mL group;■P<0.05

图4 不同浓度17-AAG对MKN-45细胞中STAT3、VEGF蛋白表达的影响Figure4 Effect of various concentrations of 17-AAG on STAT3 and VEGF protein expressions in MKN-45 cells
2.3.2 不同作用时间17-AAG对人胃癌MKN-45细胞STAT3、VEGF蛋白表达的影响 结果表明,以3.0 mg/L的 17-AAG 作用于 MKN-45细胞 12、24、48 h后,STAT3、VEGF蛋白表达量逐渐降低,呈一定的时间依赖性。各实验组与对照组,各组之间两两比较,差异均有统计学意义(P<0.05,表6,图5)。
表6 不同时间17-AAG对人MKN-45细胞系STAT3、VEGF蛋白表达的影响(±s,n=5)Table6 Effect of 17-AAG at various action times on STAT3 and VEGF protein expressions in MKN-45 human cells

表6 不同时间17-AAG对人MKN-45细胞系STAT3、VEGF蛋白表达的影响(±s,n=5)Table6 Effect of 17-AAG at various action times on STAT3 and VEGF protein expressions in MKN-45 human cells
*P<0.05 vs.control group;△P<0.05 vs.12 h group;▲P<0.05 vs.24 h group;☆P<0.05
Group 1 2 3 4 F Time(h)Control 12 24 48 n 5 5 5 5STAT3/β-actin 1.68±0.09 1.19±0.05△1.00±0.06△▲0.40±0.05△▲☆VEGF/β-actin 1.04±0.06 0.85±0.05△0.68±0.03△▲0.50±0.04△▲☆124.44**P<0.05 vs.control group;△P<0.05 vs.12 h group;▲P<0.05 vs.24 h group;☆P<0.05

图5 不同时间17-AAG对MKN-45细胞中STAT3、VEGF蛋白表达的影响Figure5 Effect of various concentrations of 17-AAG on STAT3 and VEGF protein expressions in MKN-45 cells
3 讨论
肿瘤血管新生是肿瘤侵润转移必不可少的一个环节。癌组织中的新生血管不仅为肿瘤细胞增殖提供了养分,亦为瘤细胞提供了迁移的通道,大量的癌细胞可由此进入循环系统而向远处转移。自1971年Judah Folkman首次提出肿瘤的生长和转移依赖于血管生成的假说,抗肿瘤药物对肿瘤血管新生的抑制作用越来越受到重视。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种参与机体所有(胚胎发育、生理、病理)血管生成的细胞因子,也是迄今研究最多且最深入的肿瘤新生血管标志分子。信号转导和转录活化蛋白(signal transducer and activator of transcriptions,STATs)是一种重要的信号级联分子,参与细胞生长、分化及发育等多种生理过程。STAT在多种人类恶性肿瘤组织及细胞系中存在高表达,而在正常组织中却很少或没有STAT的活化[2]。尤其是STAT3,目前认为可能是一种癌基因,其参与的信号转导途径异常可能在肿瘤的侵袭、转移中起重要作用。当细胞因子或生长因子激活STAT3上游的JAK或SRC酪氨酸激酶后,使STAT3活化形成p-STAT3,进而形成二聚体转入细胞核,调节多种与肿瘤细胞转化、增殖、侵袭转移等相关的靶基因转录活性[3-4]。有报道显示,STAT3可通过调节某些激酶作用,破坏E-钙粘附蛋白(E-cadherin)/b-链蛋白(b-catenin)复合物,使b-链蛋白的酪氨酸磷酸化后从细胞膜释放,从而使细胞间粘附能力下降,使肿瘤细胞容易从原发灶脱离出来,促进肿瘤转移[5]。阻断肿瘤细胞中癌基因STAT3信号传导通路可以起到治疗肿瘤的作用。VEGF的表达受诸多因素的调控,最近的研究表明,STAT3能直接调控VEGF的转录[6-7]。研究显示:持续激活STAT3能诱导VEGF的表达,导致肿瘤新生血管形成;用STAT3的显性负性突变体或反义寡核苷酸阻断STAT3信号通路能抑制由Src和IL-6介导的VEGF的表达上调,从而抑制肿瘤的生长与侵袭转移。另有研究表明,STAT3介导血管内皮细胞中VEGFR信号通路,其在血管内皮细胞的增殖、迁移及微血管的形成中是必需的,阻断STAT3的激活,能抑制内皮细胞的迁移及微血管的形成[8]。STAT3可能是促进肿瘤新生血管形成的关键因素之一。
17-烯丙胺-17-脱甲氧格尔德霉素(17-allylamino-17-desmethoxy-geldanamycin,17-AAG)是热休克蛋白90抑制剂,通过和热休克蛋白90特异性结合,降解其客户蛋白而发挥抗肿瘤作用,近年来备受关注。17-AAG抗多种肿瘤如乳腺癌、黑色素瘤等研究已进入了Ⅱ期临床[9-10]。肿瘤血管新生是肿瘤侵润转移必不可少的一个环节,对于抑制乳腺癌侵袭和血管生成靶向药物是当今的研究热点,目前已有几种应用:如重组人源性抗VEGF单克隆抗体贝伐单抗,抗HER-2单克隆抗体曲妥珠单抗及帕妥珠单抗,小分子EGFR酪氨酸激酶抑制剂吉非替尼及拉帕替尼等。但以上药物均为单一靶向药物,HSP90是癌细胞中生长信号转导通路的枢纽,底物蛋白众多,因此以HSP90为作用靶点的17-AAG与作用于单一靶点的抗乳腺癌药物相比无疑具有明显的优势。Cheong等[11]报道,异泽兰黄素可以通过阻断对胃癌MKN-45细胞的STAT3通路而抑制VEGF表达。本文研究结果显示,0.165~10 mg/L的17-AAG作用24h、48h后对MKN-45细胞有显著的抑制作用,且有明显的时间、剂量依赖性;选取48 h的时间点结果显示,1.0、2.0、3.0、5.0 mg/L 的 17-AAG 作用后,对MKN-45细胞STAT3和VEGF的mRNA和蛋白表达均下调,且具有浓度依赖性;选取3.0 mg/L的浓度点,17-AAG 作用 12、24、48 h后,各组细胞STAT3和VEGF mRNA和蛋白表达均下调,且具有时间依赖性。其中17-AAG尤其对STAT3下调作用尤为显著。
根据以上实验结果,本文研究认为17-AAG从基因水平和蛋白水平都抑制了STAT3的表达,VEGF作为STAT3的下游底物,进而其基因和蛋白也均被负性调控而表达降低。结合相关文献报道,研究实验提示17-AAG可能通过阻断STAT3通路而下调VEGF的表达进而发挥抗肿瘤血管新生作用。但是由于肿瘤细胞的血管新生所涉及的步骤和环节复杂,而17-AAG作用靶点众多,STAT3的下游分子也种类很多,故后续工作我们将通过体外和体内工作进一步探寻STAT3通路的上游或下游是否还存在其他因子直接或间接调控VEGF的表达,或17-AAG是否通过抑制STAT3而对其他血管新生相关分子也发挥调控作用。我们的研究将进一步丰富17-AAG的作用靶点,为17-AAG针对胃癌的治疗提供实验数据,为17-AAG在临床上的进一步开发和应用提供理论依据。
1 Zheng HC,Xu XY,Yu M,et al.The role of Reg IV gene and its encoding product in gastric carcinogenesis[J].Hum Pathol,2010,41:59-69.
2 Page BD,Ball DP,Gunning PT.Signal transducer and activator of transcription 3 inhibitors:a patent review[J].Expert Opin Ther Pat,2011,21(1):65-83.
3 Spano JP,Milano G,Rixe C,et al.JAK/STAT signalling pathway in colorectal cancer:a new biological targetwith therapeutic implications[J].Eur J Cancer,2006,42(16):2668-2670.
4 Herrmann A,Kortylewski M,Kujawski M,et al.Targeting Stat3 in the myeloid com partment drasticallyim proves the invivo antitumor functions of adoptively transferred T cells[J].Cancer Res,2010,70(19):7455-7464.
5 Rivat C,Rodrigues S,Bruyneel E,et al.Implication of STAT3 signaling in human colonic cancer cells during intestinal trefoil factor 3(TFF3)-and vascular endothelial growth factor-mediated cellular invasion and tumor growth[J].Cancer Res,2005,65(1):195-202.
6 Okazaki H,Tokumaru S,Hanakawa Y,et al.Nuclear translocation of phosphorylated STAT3 regulates VEGF-A-induced lymphatic endothelial cell migration and tube formation[J].Biochem Biophys Res Commun,2011,412(3):441-445.
7 Zheng Z,Chen H,Zhao H,et al.JAK2/STAT3 signaling pathway activation mediates tumor angiogenesis by upregulation of VEGF and bFGF in non-small-cell lung cancer[J].Invest Ophthalmol Vis Sci,2010,51(1):64-71.
8 Goydos JS.Vascular endothelial growth factor C mRNA expression correlates with stage of progression in patients with melanoma[J].Clin Cancer Res,2003,9(16):5962-5967.
9 Modi S,Stopeck A,Linden H,et al.HSP90 inhibition is effective in breast cancer:a phase II trial of tanespimycin(17-AAG)plus trastuzumab in patients with HER2-positive metastatic breast cancer progressing on trastuzumab[J].Clin Cancer Res,2011,17(15):5132-5139.
10 Pacey S,Gore M,Chao D,et al.A Phase II trial of 17-allylamino,17-demethoxygeldanamycin(17-AAG,tanespimycin)in patients with metastatic melanoma[J].Invest New Drugs,2012,30(1):341-349.
11 Cheong JH,Hong SY,Zheng Y,et al.Eupatilin Inhibits Gastric Cancer Cell Growth by Blocking STAT3-Mediated VEGF Expression[J].J Gastric Cancer,2011,11(1):16-22.

