晚期肺腺癌EGFR突变状态对培美曲塞疗效的影响
张 琼 杨 哲 戴洪海 王 瑜 韩俊庆
肺癌是世界范围内最常见的肿瘤,60%以上的肺癌在诊断时已是晚期[1]。对于晚期或不可手术切除的非小细胞肺癌,根据表皮生长因子受体(epidermal growth factor receptor,EGFR)基因亚型及病理类型决定治疗方案是目前的趋势[2],培美曲塞联合铂类化疗是晚期肺腺癌的一线化疗方案,但EGFR突变状态是否会对培美曲塞的疗效产生影响尚不明确。因此,本文对40例应用培美曲塞治疗的晚期肺腺癌患者进行回顾性研究,探讨EGFR突变状态是否影响培美曲塞的疗效。
1 材料与方法
1.1 病例选择
分析病例包括2010年7月至2013年3月在山东省立医院治疗的晚期肺癌患者,病理组织诊断为肺腺癌且均有可评价病灶,至少接受过1个周期培美曲塞或培美曲塞联合铂类的一线化疗,所有病例PS评分为0~2分(0分:无症状;1分,有症状,但几乎完全可自由活动;2分:有时卧床,但白天卧床时间还超过50%)。符合上述分析要求的43例患者中,2例治疗后无随访资料,1例是否放疗不详,所以可分析的病例共40例。中位年龄55.5(36~75)岁;女性15例,男性25例。EGFR突变组22例(55.0%),野生组18例(45.0%)。两组病例的性别、年龄、分期、是否吸烟、含铂类化疗周期数、大于3周期化疗的人数等基本资料无统计学差异,见表1。
1.2 方法
1.2.1 化疗方案 全组接受培美曲塞单药化疗病例3例,培美曲塞联合铂类两药方案化疗病例37例,培美曲塞剂量为500 mg/m2d1,顺铂剂量为25 mg/m2d2~4,卡铂AUC为5 mg/mL d2,21天为1个化疗周期。全组中位化疗周期数为4(1~6)周期,其中EGFR野生型组中位化疗周期数为4(2~6)周期,突变组为3.5(1~6)周期。
1.2.2 EGFR基因检测 获取冰冻或石蜡病理组织切片,在治疗前或治疗过程中经益善生物技术公司采用突变富集液相芯片(mutant-enriched liquid chip,MEL)技术[3]进行EGFR外显子18、19、20、21基因突变情况检测。共22例存在EGFR外显子突变,其中EGFR外显子18突变2例,均为G719A型;EGFR外显子19突变8例,均为delE746-A750型;EGFR外显子21突变11例,均为L858R型;EGFR外显子19和21双突变1例,为delE746-A750型和L858R型;无EGFR外显子20突变者。
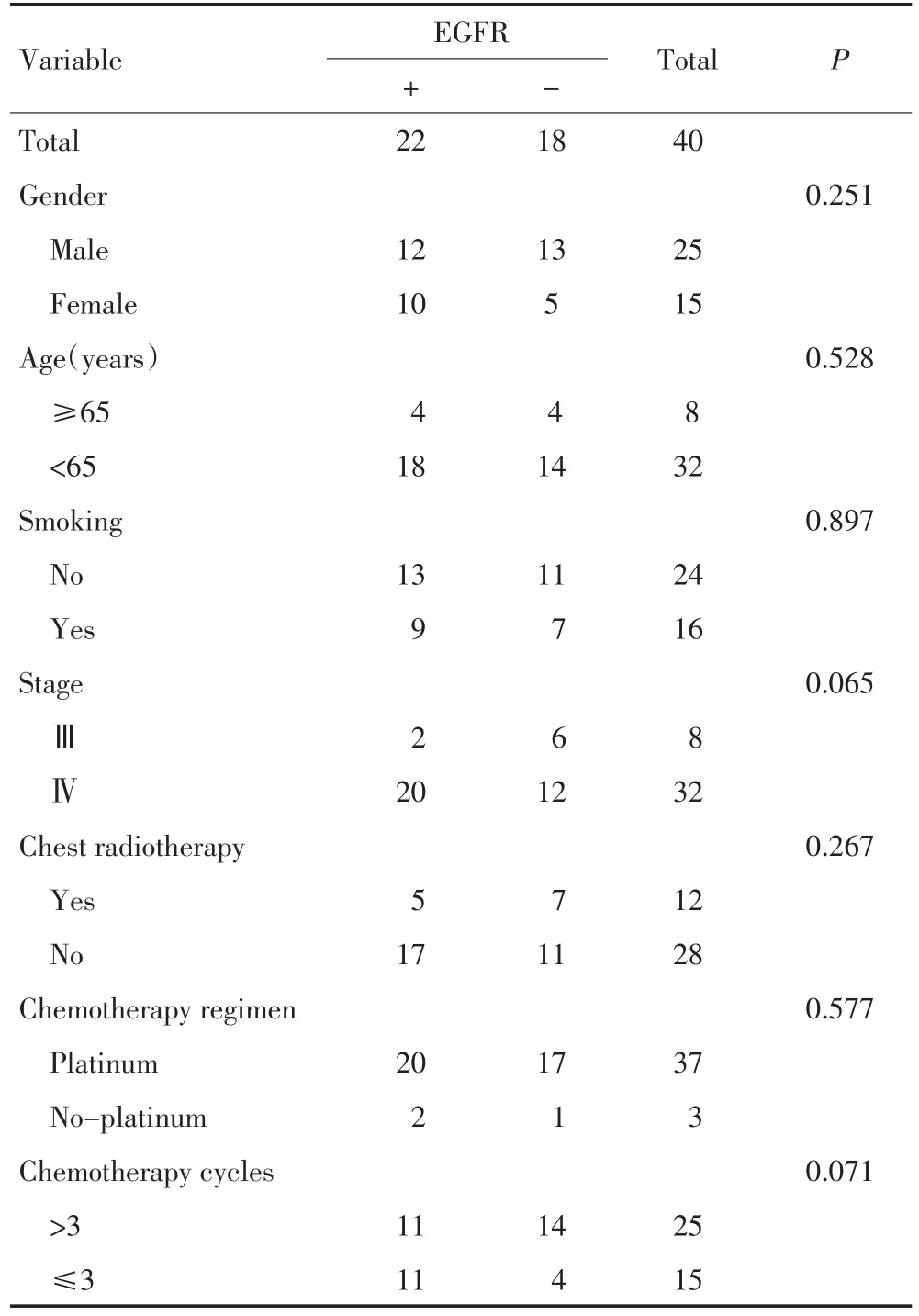
表1 晚期肺腺癌患者一般资料Table1 Clinical data of patients with advanced lung adenocarcinoma
1.2.3 疗效评价方法 按照RECIST1.0标准每2个周期评价疗效。疗效分为完全缓解(complete remission CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。本研究观察的首要终点为无进展生存期(progression free survival,PFS),次要终点为总有效率(overall response rate,ORR)、疾病控制率(disease control rate,DCR)。ORR包括CR+PR,DCR包括CR+PR+SD。PFS是指首次含培美曲塞方案化疗至发现疾病进展或者研究随访终止的生存时间。根据NCI-CTC 3.0标准评价含培美曲塞化疗方案的不良反应。
1.3 统计学方法
应用SPSS 17.0软件进行统计学分析。两组基线特征及疗效比较用Pearson χ2检验或Fisher确切概率法,中位PFS生存分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结果
2.1 随访结果
中位随访时间11个月。至随访结束时,突变组14例PD(63.6%,14/22),野生组12例PD(66.7%,12/18),共3例患者仍在治疗中。
2.2 疗效
全组CR为0,PR为37.5%(15/40),DCR为85%(34/40),中位PFS为7.4个月。突变组22例,ORR 31.8%(7/22),DCR 81.8%(18/22),中位PFS 5.3个月;野生组18例,ORR 44.4%(8/18),DCR 88.9%(16/18),中位PFS 8.9个月;两组比较ORR和DCR无统计学差异(P=0.412;P=0.673),中位PFS有统计学差异(表2、图1,P=0.046)。
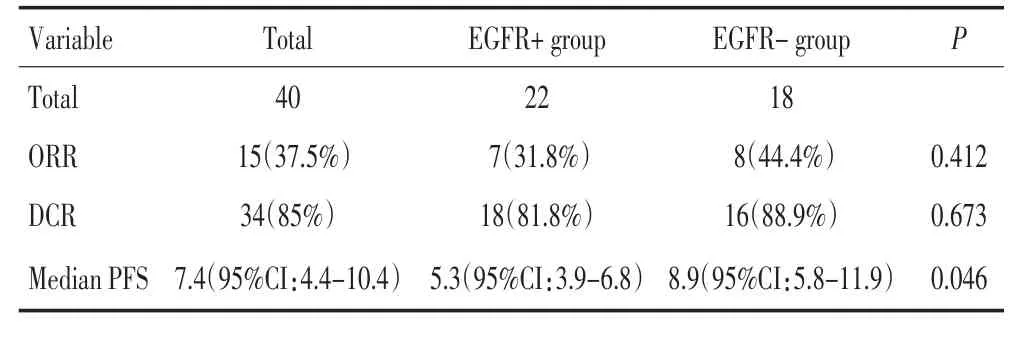
表2 晚期肺腺癌含培美曲塞方案一线化疗结果Table2 Results of pemetrexed-included first-line chemotherapy in patients with advanced lung adenocarcinoma
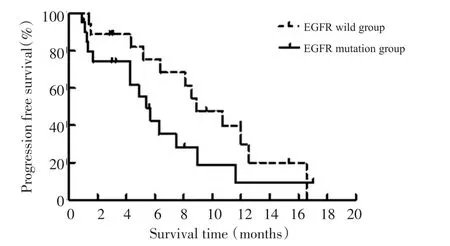
图1 晚期肺腺癌含培美曲塞方案一线化疗无进展生存期Figure1 Progression free survival of pemetrexed-included first-line chemotherapy in patients with advanced lung adenocarcinoma
2.3 不良反应
主要不良反应为Ⅰ~Ⅱ度骨髓抑制及胃肠道反应,EGFR基因突变组与野生组各不良反应发生率均无统计学差异(表3)。全组无血小板降低病例。其他少见不良反应,两组各1例Ⅲ度骨髓抑制;各1例肾小球滤过率轻度降低;突变组1例窦性心动过速,2例轻微心肌缺血;野生组1例Ⅱ度腹泻。两组均无患者因不良反应停药或减量。
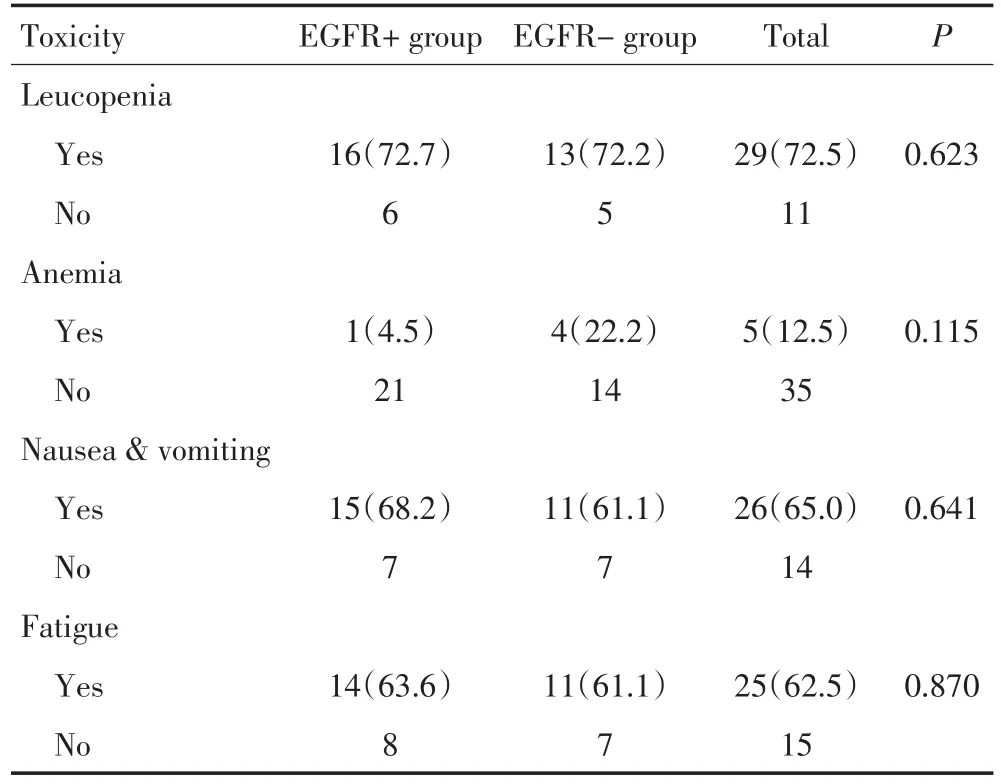
表3 两组不良反应比较 例(%)Table3 Comparison of adverse reactions between two groups
3 讨论
近年来培美曲塞在晚期非小细胞肺癌一线治疗中的有效率可达30.6%(264/862),PFS 4.8个月[4],较其他化疗药物有明显优势。随着培美曲塞在肺腺癌治疗中的广泛应用,研究者也在不断地寻找影响培美曲塞疗效的分子标志物,旨在通过精确、经济的预测指标筛选出能从培美曲塞中获益最大的人群。目前研究较多的有:培美曲塞作用的靶酶、ALK基因突变状态、EGFR基因突变状态等。培美曲塞的主要作用靶酶-胸苷酸合成酶(thymidylate synthase,TS)已经被证实是培美曲塞疗效的预测指标[5-6]。同时,多项研究表明ALK基因异位型肺癌患者培美曲塞化疗的疗效优于ALK基因未异位者[5,7,9]。但ALK基因异位对培美曲塞疗效的影响仍需大样本的研究进一步确定,TS酶对培美曲塞疗效的影响虽然确切,但检测技术尚未推广,所以目前以ALK基因异位和TS酶作为选择培美曲塞获益人群的指标仍存在较大的局限性。
EGFR基因检测逐渐成为肺腺癌的常规检查项目。EGFR突变状态不同的肺腺癌对EGFR-TKIs(epidermal growth factor receptor-tyrosine kinase inhibitors)疗效有很大的不同,那么EGFR突变状态是否会对培美曲塞的疗效产生影响?研究者进行了相关研究,Wu等[8]对晚期肺腺癌患者采用培美曲塞单药二线及以上治疗,EGFR突变组RR和中位PFS均优于野生组(12.9%vs.1.6%,P=0.016;中位 PFS 3.9个月 vs.2.3个月,P=0.030);Camidge等[9]对Ⅳ期 NSCLC(non-small cell lung cancer)患者进行含培美曲塞一线及以上化疗,EGFR突变组和EGFR、KRAS、ALK(anaplastic lymphoma kinase)均未突变组中位PFS分别为5.5、4个月。Lee等[7]对晚期NSCLC患者应用培美曲塞单药二线及以上化疗,EGFR突变组和EGFR、ALK均未突变组ORR分别为4.7%(2/43)和16.2%(6/37)、疾病进展时间(time to progression,TTP)分别为1.4个月和2.9个月。Okamoto等[10]对非鳞型NSCLC采用培美曲塞联合卡铂一线治疗,结论:EGFR野生组和突变组患者ORR(36.1%(22/61)vs.37.5%(9/24))相似,但中位PFS野生组较突变组有延长趋势(6.9 vs.5.7个月)。
本研究总ORR、中位PFS均优于Scagliotti等[4]的培美曲塞联合顺铂一线治疗晚期NSCLC的研究结果(37.5%(15/40)vs.30.6%(264/862),7.4个月vs.4.8个月),可能与本研究病例均为肺腺癌有关。本研究野生组较突变组有较好的ORR(44.4%(8/18)vs.31.8%(7/22);P=0.412)和 DCR(88.9%(16/18)vs.81.8%(18/22);P=0.673),但差异均无统计学意义;野生组中位PFS优于突变组(8.9 vs.5.3个月;P=0.046)。此结果与Wu等[8]的采用培美曲塞单药二线及以上方案治疗肺腺癌的研究结论不一致,而与Okamoto等[10]的培美曲塞联合卡铂一线治疗非鳞型NSCLC的研究结论相近,产生这种差异的原因可能有:1)本研究病例均为含培美曲塞一线化疗;2)本研究有92.5%(37/40例)病例为培美曲塞联合铂类双药化疗;3)培美曲塞疗效与TS酶低表达有关[6],而WU等[8]报道化疗药物可能改变患者体内的TS酶,从而使本研究与既往采用培美曲塞二线及二线以上化疗的研究结果不一致。此外,Giovannetti等[11]研究发现,与EGFR野生型相比,有突变的H1650细胞株表达低水平的TS酶,本研究未进行TS酶检测,无法判断本研究EGFR突变组与野生组的疗效差别是否与两组各自的TS酶表达水平及其差异有关。Bai等[12]报道化疗可能改变EGFR突变状态,本研究化疗过程中患者可能存在EGFR突变状态的改变,从而可能使本研究的结果产生偏倚。本研究为小样本回顾性研究,尚有待于大样本、多中心、前瞻性的研究进一步证实。
对于EGFR突变型肺腺癌,EGFR-TKIs和培美曲塞化疗均对延长其生存期有意义[13],目前临床证据[14]显示让患者有机会接受两种治疗策略,才能使患者获益最多。但争议在于该类患者首先选择哪种治疗策略。结合本研究结果,培美曲塞对EGFR突变型疗效不如野生型理想,因此作者倾向于EGFR突变型肺腺癌一线药物首选EGFR-TKIs。
综上所述,培美曲塞联合铂类治疗EGFR野生型晚期肺腺癌较突变型PFS延长,ORR、DCR有改善趋势。晚期肺腺癌EGFR突变状态对培美曲塞的疗效有影响。
1 刘雨桃,郏 博,石元凯,等.2011年非小细胞肺癌研究进展[J].癌症进展,2012,10(2):124-128.
2 Leighl NB.Treatment paradigms for patients with metastatic non-small-cell lung cancer:first-,second-,and third-line[J].Curr Oncol,2012,19(Suppl 1):S52-S58.
3 Zhang L,Yang H,Zhao Y,et al.Detection of EGFR Somatic Mutations in Non-Small Cell Lung Cancer(NSCLC)Using a Novel Mutant-Enriched Liquidchip(MEL)Technology[J].Curr Drug Metab,2012,13(7):1007-1011.
4 Scagliotti GV,Parikh P,von Pawel J,et al.Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naïve patients with advanced-stage non-small-cell lung cancer[J].J Clin Oncol,2008,26(21):3543-3551.
5 Lee HY,Ahn HK,Jeong JY,et al.Favorable clinical outcomes of pemetrexed treatment in anaplastic lymphoma kinase positive non-small-cell lung cancer[J].Lung Cancer,2013,79(1):40-45.
6 Sun JM,Han J,Ahn JS,et al.Significance of thymidylate synthase and thyroid transcription factor 1 expression in patients with nonsquamous non-small cell lung cancer treated with pemetrexed-based chemotherapy[J].J Thorac Oncol,2011,6(8):1392-1399.
7 Lee JO,Kim TM,Lee SH,et al.Anaplastic lymphoma kinase translocation:a predictive biomarker of pemetrexed in patients with non-small cell lung cancer[J].Journal of Thoracic Oncology,2011,6(9):1474-1480.
8 Wu SG,Yang CH,Yu CJ,et al.Good response to pemetrexed in patients of lung adenocarcinoma with epidermal growth factor receptor(EGFR)mutations[J].Lung Cancer,2011,72(3):333-339.
9 Camidge DR,Kono SA,Lu X,et al.Anaplastic Lymphoma Kinase Gene Rearrangements in Non-small Cell Lung Cancer are Associated with Prolonged Progression-Free Survival on Pemetrexed[J].J Thorac Oncol,2011,6(4):774-780.
10 Okamoto I,Aoe K,Kato T,et al.Pemetrexed and carboplatin followed by pemetrexed maintenance therapy in chemo-naïve patients with advanced non-squamous non-small-cell lung cancer[J].Invest New Drugs,2013,31(5):1395-1396.
11 Giovannetti E,Lemos C,Tekle C,et al.Molecular mechanisms underlying the synergistic interaction of erlotinib,an epidermal growth factor receptor tyrosine kinase inhibitor,with the multitargeted antifolate pemetrexed in non-small-cell lung cancer cells[J].Mol Pharmacol,2008,73(4):1290-1300.
12 Bai H,Wang Z,Chen K,et al.Influence of chemotherapy on EGFR mutation status among patients with non-small-cell lung cancer[J].J Clin Oncol,2012,30(25):3077-3083.
13 吴一龙,孙 燕,廖美琳,等.EGFR突变型肺癌的处理[J].循证医学,2011,11(2):65-68.
14 吴国明.2012年美国临床肿瘤学会晚期非小细胞肺癌内科治疗新进展[J].西部医学,2012,24(9):1650-1653.

