利用EROD和GST酶评估竹子制浆造纸废水的生物毒性
侯丽萍 应光国 舒 琥 赵建亮
(1.广州大学生命科学学院,广东广州,510006;2.中国科学院广州地球化学研究所有机地球化学国家重点实验室,广东广州,510640;3.广州大学华南生物多样性研究所,广东广州,510006)
造纸废水含有大量有毒的有机污染物,对造纸废水进行生物毒性测试可补充化学分析方法的不足,有效评价造纸废水的安全性。目前,一般采用急性毒性测试方法[1]及基于细胞培养的生物标记法来评估造纸废水的综合毒性[2]。
食蚊鱼(Gambusia affinis)属鳉形目(Cyprinodontiformes)、胎鳉科(Poeciliidae),具有广泛的生境适应性、繁殖周期短、生殖率高、明显的两性性状等特点,且易于在实验室饲养,被广泛用作造纸废水毒性的指示生物物种[3]。采用酶活性指标监测造纸废水污染程度尚处起步阶段,且尚未有利用野生食蚊鱼活体 7-乙氧基-3-异吩呛哇酮-脱乙基酶(7-ethoxyresorufino-deethylase,EROD)和谷胱甘肽硫转移酶(Glutathione-S-transferase,GST)来评估造纸废水毒性的报道。EROD是混合功能氧化酶系统(MFO)的主要组分,属细胞色素氧化酶p450系中同工酶CYP1A1的一族,为第一阶段解毒酶,主要通过催化氧化反应增加底物的极性。在正常水体环境中,鱼体内的EROD活性相对较低,但在某些特定的外来化学物质(特别是各种多环芳香烃类化合物)的诱导下,鱼体内的EROD活性异常升高。因此,可将鱼体内EROD的活性作为水体环境中特定污染物的监测指标。GST广泛存在于动物肝脏微粒体中,是外源性物质在体内生物转化的关键酶类,也是内源性物质代谢的重要酶。GST属于第二阶段解毒酶,主要催化内源性谷胧甘肽与底物进行结合反应,从而提高底物的水溶性,有利于底物从生物体内排出。
侯丽萍等[4]研究发现,广东省四会市受竹子制浆造纸废水污染的邓村河道中食蚊鱼的种群、个体和组织都发生了改变,并出现了雄性化的雌性食蚊鱼,表明该区域河流可能受到竹子制浆造纸废水中有毒有机物的污染,对当地生态环境和人们的健康造成严重的潜在影响。因此,本实验测定了邓村河道中野生食蚊鱼活体EROD和GST的活性,以研究竹子制浆造纸废水对鱼类生物转化酶系的损害,并深入评估该区域造纸废水的生物毒性。
1 实验
1.1 造纸作坊与采样点
调查区域为受竹子制浆造纸废水污染的广东省四会市邓村河(见图1)。调查区域段的邓村河沿岸有7家造纸作坊(造纸作坊M1与M2、M3与M4、M4与M5均相距约400 m,M2与M3、M5与M6、M6与M7分别相距约800、500、300 m),均以竹子为原料,采用“小苏打浸泡法”制浆,每个作坊的纸产品产量约为5 t/a。造纸废水主要为碎竹和洗浆过程中产生的废水,废水只经过滤处理后直接排入邓村河,无其他处理措施,排放量约为40 m3/d。
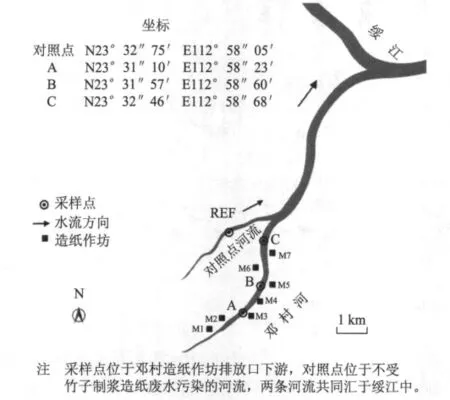
图1 采样点与对照点示意图
1.2 食蚊鱼的采集及预处理
食蚊鱼采集时间为2009年8月和2010年3月。在各采样点,用大型渔网捕获足够数量的食蚊鱼,放入已编号的大型塑料桶中,每个塑料桶盛装10 L采样点的原水,用氧气泵充氧,并在24 h内运回实验室,48 h内进行雌雄分类、解剖及性体指标测定。EROD活性受鱼体内激素的影响较大,不同生长发育阶段的雌性食蚊鱼的EROD活性具有显著差异。因此,在测定EROD活性时,把食蚊鱼分为成熟雌性食蚊鱼、未成熟雌性食蚊鱼及成熟雄性食蚊鱼,而测定GST活性时只分为雌性食蚊鱼和雄性食蚊鱼。根据Noggle[5]的方法,定义具有生殖突起的为雌性食蚊鱼,无生殖突起的为雄性食蚊鱼;交接器具有钩状结构的雄性食蚊鱼为成熟的雄性食蚊鱼,不带钩状结构的为未成熟的雄性食蚊鱼;体长>20 mm的雌性食蚊鱼为成熟的雌性食蚊鱼,体长<20 mm的雌性食蚊鱼为未成熟的雌性食蚊鱼;具有明显胎斑的为怀孕的食蚊鱼。分类后,挑选大小基本一致的食蚊鱼进行解剖,保证每个采样点制备酶源的食蚊鱼的数量不少于30条。采集食蚊鱼的同时,测定各采样点的水质参数,如pH值、温度、硬度、溶氧量、TSS及BOD7。
1.3 酶源的制备
将食蚊鱼于冰浴条件下解剖后,迅速取出鱼肝组织,将用滤纸吸去血渍的鱼肝置于组织匀浆器中。按以下步骤配置缓冲液 PBS1:加入11.184 g KCl和5.206 g HEPES(4-羟乙基哌嗪乙磺酸、N-(2-羟乙基)哌嗪-N'-2-乙烷磺酸)于1 L水中,调节pH值至7.5。加入1 mL该缓冲液于组织匀浆器中匀浆1 min。然后取适量匀浆液于高速冷冻离心机中(Beckman,4℃,10000 r/min)离心20 min。取上清液并分为3份,每份200 μL,在4℃下保存。其中,2份分别用于EROD和GST活性测定,1份用于酶源中蛋白质含量的测定。
1.4 EROD活性的测定
采用改进的快速终止荧光光度法测定食蚊鱼的EROD活性,即根据鲫鱼肝脏EROD活性的测定方法略作修改[6]。反应体系包含190 μL磷酸缓冲液(浓度 0.1 mol/L,pH 值 7.8),30 μL 7-乙氧基-3-异吩噁唑酮(ERF,浓度 1.73 μmol/L),50 μL 酶源上清液。向测试管中加入30 μL四钠盐(NADPH,浓度0.4 mol/L),并在 20℃水浴中反应 10 min,加入2 mL预冷的甲醇终止反应。空白管用重蒸水代替酶源上清液。用荧光分光光度计测定产物7-羟基-3-异吩噁唑酮(RF)的荧光强度,激发波长为550 nm,发射波长为585 nm。参照标准曲线得到RF的含量,并计算EROD活性。
1.5 GST活性的测定
参照Habig等[7]的方法测定食蚊鱼的GST活性。用购自南京建成生物工程研究所的试剂盒进行测定,酶促反应为1200 μL的反应体系。向1.5 mL的离心管中加入150 μL的基质液,50 μL酶源上清液,对照管不加酶液,在37℃下水浴10 min,再加入500 μL试剂(取试剂盒中的粉末加入170 mL 100℃的蒸馏水,充分溶解,取出试剂盒中50 mL的溶液,充分混合这两种液体,即成过饱和溶液,该饱和溶液的上清液即为实验用的试剂),500 μL无水乙醇,对照管另加入50 μL酶源上清液,大力振荡摇匀后,在4000 r/min下常温离心10 min,取上清液进行显色反应。显色反应在1.5 mL的EPA管中进行,反应总体系为1125 μL。显色反应液混匀后在室温下放置15 min,取300 μL显色后的反应液于96孔板中进行412 nm吸光值的测试。
1.6 酶源中蛋白质含量的测定
采用酶标仪按Bradford的方法[8]测定酶源中蛋白质的含量,蛋白标准液为牛血清蛋白(BSA)。取适量离心后的酶源上清液或其稀释液,加入显色剂考马斯亮蓝(Coomassie brilliant blue G250),当显色剂与蛋白质结合后,会由红色变为蓝色。测定前先按V(考马斯亮蓝)∶V(水)=1∶4稀释考马斯亮蓝,在96孔板中加入300 μL稀释后的考马斯亮蓝,然后加入10 μL酶源上清液,并设3个孔加入蛋白标准液,另外3个孔为空白样。待反应结束后,通过测定595 nm下的吸光度来确定酶源中蛋白质的含量。
1.7 统计分析
实验所得数据均用SPSS(ver.11.5)进行分析;用单因素方差分析(ANOVA)检验不同采样点食蚊鱼的EROD和GST活性,并用Dunnett's test对结果进行验后多重比较。如果P<0.05,认为有显著性统计意义。
2 结果与讨论
2.1 各采样点的水质参数
各采样点的水质参数如表1所示。由表1可知,采样点A、B、C处的水温、pH值与对照点差异不大。与对照点的水质相比,采样点水质的电导率稍高,溶氧量低,BOD7和TSS含量高。这表明,邓村竹子制浆造纸废水的排放对该区域水体环境造成了污染。
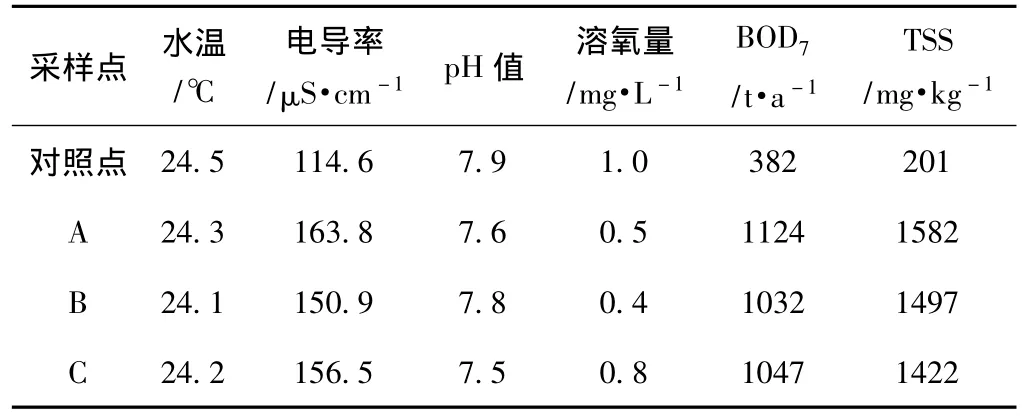
表1 采样点的水质参数
2.2 造纸废水对食蚊鱼EROD活性的影响
图2所示的是2009年夏季(8月)各个采样点和对照点的食蚊鱼EROD活性。由图2可知,与对照点食蚊鱼的EROD活性相比,各采样点食蚊鱼的EROD活性显著高(P<0.01)。对照点未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD 活 性 分 别 为 2.62 ×10-12、1.97 ×10-12、2.08×10-12mol/(min·mg)。其中,采样点 A处的未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD活性分别为对照点的4.1、4.0和3.5倍;采样点B处的未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD活性分别为对照点的3.2、3.4、3.5倍;采样点C处的未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD活性分别为对照点的3.2、3.4、3.1倍。各采样点的未成熟雌性食蚊鱼的EROD活性比成熟雌性食蚊鱼和成熟雄性食蚊鱼的高。

图2 2009年8月份邓村造纸废水对食蚊鱼EROD活性的影响
图3所示的是2010年春季(3月)各采样点和对照点食蚊鱼EROD活性。由图3可知,对照点未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD 活 性 分 别 为 1.91 × 10-12、1.34 × 10-12、1.08×10-12mol/(min·mg)。与对照点相比,各采样点食蚊鱼的EROD活性显著高(P<0.01)。其中,采样点A处的未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD活性分别为对照点的4.6、4.4、2.2倍;B点未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD活性分别为对照点的3.8、4.0、2.3倍;C点未成熟雌性食蚊鱼、成熟雌性食蚊鱼、成熟雄性食蚊鱼的EROD活性分别为对照点的3.2、3.8、2.3倍。各采样点的未成熟雌性食蚊鱼的EROD活性比成熟雌性食蚊鱼和成熟雄性食蚊鱼高。
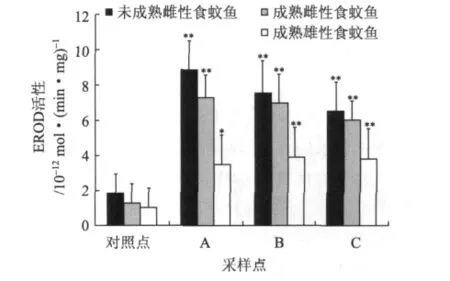
图3 2010年3月份邓村造纸废水对食蚊鱼EROD活性的影响
Andersson等[9]研究表明,与未受造纸废水污染的河流中的鱼类相比,生活在受含漂白工段造纸废水污染的河流中鱼类的EROD活性显著升高,其活性与离造纸厂的距离成反比。目前,由于生产工艺的改良,漂白工段废水中的许多对环境有害的化合物已被去除,如多氯联苯(PCB)和多环芳烃(PAH)等。但Martel等[10]研究证实,不含漂白工段的造纸废水仍会诱导鱼类的EROD活性升高。他们认为,造纸废水中诱导鱼类EROD活性升高的化合物不是高分子质量的疏水性化合物,而是来源于造纸原材料中的二级PAH形式的疏水化合物——树脂、缁醇类等物质。本研究结果显示,无论是夏季还是春季,生活于受邓村竹子制浆造纸废水污染的河道中的食蚊鱼EROD活性均比对照点的高,说明该造纸废水中的某些化合物能与细胞内芳烃受体(Ah2R)结合,诱导了EROD活性升高。邓村造纸作坊采用的原料是竹子,因此,很有可能在生产过程中释放出来的缁醇类物质在影响鱼类生长发育的同时,诱发EROD活性升高,引发毒性效应。因此,除了对常规的PCB和PAH化合物进行监测外,由二级PAH形式的疏水化合物引起的环境污染问题也需引起一定的重视。
Elskus等[11]研究表明,雌鱼在繁殖期间生物转化系统受到抑制,EROD活性也受到抑制。因此,处于繁殖期间的雌鱼的EROD活性比其他鱼的低。Bankey等[12]研究表明,造纸废水均能引起未成熟和成熟黑鲈的EROD活性升高,未成熟黑鲈的EROD活性均比成熟并处于繁殖期间黑鲈的EROD活性高。本实验研究结果显示,各采样点未成熟雌性食蚊鱼EROD活性比其他发育阶段食蚊鱼的EROD活性高,这与Bankey等的研究结果一致。
EROD在内分泌系统中扮演何种角色及其对繁殖造成何种潜在的影响,机理如何,这些都需要进一步研究。EROD的活性与水体环境的温度、鱼的种类、性别、生长发育阶以及肝脏的健康情况密切相关,用其作为生物标志物的时候一定要注意以上条件的差异性。
2.3 造纸废水对食蚊鱼GST活性的影响
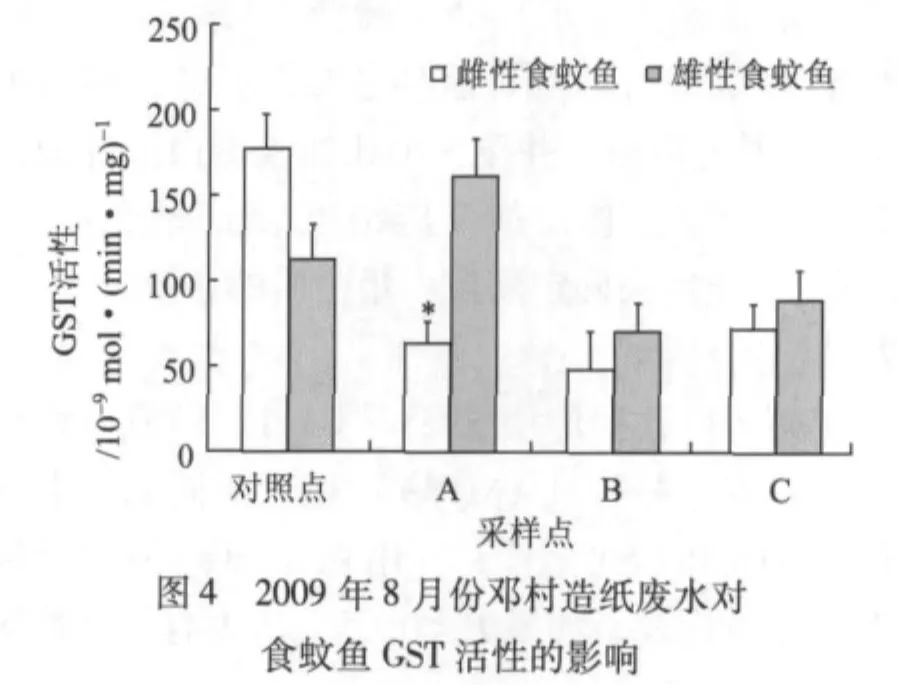
图4显示的是2009年夏季(8月)邓村竹子制浆造纸废水对食蚊鱼GST活性的影响。由图4可知,与对照组雌性食蚊鱼的GST活性相比,采样点A、B处雌性食蚊鱼的GST活性显著降低(P<0.05)。除了采样点A外,采样点B、C处的雄性食蚊鱼的GST活性均比对照点的低,但无显著差异(P>0.05)。
图5显示的是2010年春季(3月)邓村竹子制浆造纸废水对食蚊鱼GST活性的影响。由图5可知,与对照点食蚊鱼GST活性相比,采样点A、B、C处食蚊鱼的GST活性总体低,采样点B处的雌性食蚊鱼及C处的雌、雄食蚊鱼的GST活性较对照点的有显著差异(P<0.05)。

GST是生物机体内重要的代谢酶系之一。该酶存在于生物机体的各种组织中,具有消除体内自由基和解毒的双重功能,其活性的大小可反映生物机体抗氧化能力的高低,并对生物机体肝脏的早期损伤诊断具有一定的价值[13]。尹大强[14]研究证实,含漂白工段的造纸废水会显著诱导鲫鱼肝脏微粒体GST的活性。Holth T F等[15]用造纸废水暴露斑马鱼,研究结果表明,短时间暴露对斑马鱼GST活性起诱导作用,长时间暴露则起抑制作用。王重刚[16]的研究也发现,用2,4-二氯苯酚、苯并芘(BaP)、重金属等污染物暴露鱼类后,在短时间和低浓度剂量暴露时,其肝脏和脾脏的谷胱甘肽过氧化物酶(GPx)和GST活性显著升高;在长时间和高浓度剂量暴露后,由于鱼体内谷胱甘肽(GSH)含量降低和过氧化氢酶(CAT)活性增大,则污染物对GPx和GST活性的诱导作用消失,甚至抑制它们的活性。本研究结果显示,各采样点食蚊鱼的GST活性总体比对照点的低,但只有个别采样点出现显著差异。GST活性低的原因可能是,受竹子制浆造纸废水的污染程度比较严重,食蚊鱼体内GSH消耗过大,造成GST活性下降。以上结果表明,GST用作生物标志物指示竹子制浆造纸废水生物毒性时没有EROD敏感。
3 结论
测定了生活于受竹子制浆造纸废水(采用“小苏打浸泡法”制浆)污染的河道中食蚊鱼活体肝脏7-乙氧基-3-异吩呛哇酮-脱乙基酶(7-ethoxyresorufinodeethylase,EROD)和谷胱甘肽硫转移酶(Glutathione-S-transferase,GST)的活性。结果表明,食蚊鱼可作为检测竹子制浆造纸废水污染的敏感生物标志物,其EROD活性可有效真实地评价竹子制浆造纸废水的安全性,GST在用作竹子制浆造纸废水生物毒性的标志物时,响应没有EROD敏感。EROD的活性与水温、鱼的性别、成熟阶段及肝脏的健康情况密切相关,用其作为生物标志物的时候一定要注意以上条件的差异性。
[1]沈盎绿,马胜伟,平仙隐,等.制浆造纸废水对不同鱼类急性毒性研究[J].海洋渔业,2006,28(4):332.
[2]倪潇潇,王子健.造纸厂废水的生物毒性测试[J].中国造纸,2006,25(12):27.
[3]Cody R P,Bortone S A.Masculinization of mosquitofish as an indicator of exposure to kraft mill effluent[J].Bulletin of Environmental Contamination and Toxicology,1997,58(3):429.
[4]Hou Liping,Xie Yongping,Ying Guangguo,et al.Developmental and reproductive characteristics of western mosquitofish(Gambusia affinis)exposed to paper mill effluent in the Dengcun River,Sihui,South China[J].Aquatic Toxicology,2011,103(3/4):140.
[5]Noggle J J.Eastern Mosquitofish as Bioindicator of Pulp and Paper Effluents[D].Gainesville:University of Florida,2005.
[6]吴 鹰,孟艳玲,周忠良.环境内分泌干扰物对河川沙塘鳢的雌激素效应检测[J].环境检测管理与技术,2006,8(6):13.
[7]Habig W H,Pabst M J,Jakoby W B.Glutathione stransferases:The first enzymatic step in mercapturic acid formation[J].The Journal of Biological Chemistry,1974,249:7130.
[8]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal Biochemistry,1976,72(1/2):248.
[9]Andersson T,Hardig J,Larsson A.Physiological disturbances in fish living in coastal water polluted with bleached kraft pulp mill effluent[J].Canadian Journal of Fisheries and Aquatic Sciences,1988,45(9):1525.
[10]Martel P H,Kovacs T G,O’Connor B I,et al.A survey of pulp and paper mill effluents for their potential to induce mixed function oxidase enzyme activity in fish[J].Water Research,1994,28(8):1835.
[11]Elskus A A,Stegeman J J,Susani L C,et al.Polychlorinated biphenyls concentration and cytochrome P-450E expression in winter flounder from contaminated environments[J].Marine Environmental Research,1989,28(1/4):25.
[12]Laura A Bankey,Peter A Van Veld,Dennis L Borton,et al.Responses of cytochrome P4501A in freshwater fish exposed to bleached kraft mill effluent in experimental stream channels[J].Canadian Journal of Fisheries and Aquatic Sciences,1995,52(3):439.
[13]George S G.Enzymology and molecular biology of phase xenobioticⅡ conjugating enzymes in fish[M].Washington D C:Lewis Publishers,1994.
[14]尹大强.漂白纸浆废水对鲫鱼(Carassius auratus)肝脏微粒体代谢酶的影响[J].南京大学学报:自然科学,2003,39(3):392.
[15]Holth T F,Nourizadeh-Lillabadi R,Blaesbjerg M.Differential gene expression and biomarkers in zebrafish(Danio rerio)following exposure to produced water components[J].Aquatic Toxicology,2008,4(11):277.
[16]王重刚.苯并(a)芘和芘的混合物暴露对梭鱼脾脏抗氧化防御系统的影响[J].海洋学报,2003,25(2):135.

