CaS升温浸出过程的电位-pH图
何环宇,裴文博,刘 璇,王海华,崔一芳
(武汉科技大学 钢铁冶金及资源利用省部共建教育部重点实验室,武汉 430081)
CaS升温浸出过程的电位-pH图
何环宇,裴文博,刘 璇,王海华,崔一芳
(武汉科技大学 钢铁冶金及资源利用省部共建教育部重点实验室,武汉 430081)
针对炼钢脱硫废渣的浸出去硫热力学研究,采用平均热容法通过热力学计算绘制出不同温度条件下CaS-H2O系电位-pH图;考察了温度对钙、硫稳定存在形式和体系中电极反应平衡关系的影响.结果表明,298 K时,硫化钙的浸出反应即可自发进行;降低pH,硫以H2S的形式逸出,增大pH,硫以S2-的形式进入浸出液.随着温度升高,有利于HS-向S2-和H2S转化和微溶物质CaSO4的浸出,提高硫的浸出率。与常温相比,高温条件下,pH>7时,更有利于钙形成Ca(OH)2和硫以S2-,HS-,SO-24离子进入浸出液或以H2S的形式逸出.
CaS-H2O系;热力学计算;电位-pH图
电位-pH图是重要的热力学工具,利用电位-pH图可方便地判断反应的方向和生成物的稳定性,迄今为止,已经在20多个学科不同的领域采用它指导生产和科研[1].自1953年Halpern将这种图形应用于分析湿法冶金热力学,陆续有研究者根据Latimer等的ΔGθ25值绘制了常温下的硫化物-水系、(非)金属-水系以及金属-配合物-水系的电位-pH图[2].炼钢脱硫废渣是主要的冶金固体废弃物,将其作为原料返回冶金过程再利用是解决废渣占地以及降低生产成本的有效途径,但需解决再利用过程中废渣中有害元素硫循环富集的问题[3,4],研究表明[5]炼钢脱硫废渣中硫以CaS为基本单元形成铝酸钙复合硫化物,稳定性非常强,难以去除,但在一定的条件下,采用浸出处理可以获得高效、稳定的去硫效果[6].然而,由于采用浸出法处理炼钢废渣尚处于探索阶段,在浸出过程中CaS的热力学行为目前鲜有研究者涉足.基于炼钢脱硫废渣浸出去硫的热力学研究需要,本文通过查找热力学数据并采用平均热容法进行热力学计算,绘制298,373,423和473 K温度条件下CaS-H2O系电位-pH图,为废渣的浸出去硫最佳途径及条件的选择提供热力学依据,对废渣中有害物质的去除及提高废渣再利用率具有意义.
1 绘制电位-pH图的基本原理
电位-pH图是在给定温度、组分活度或气相分压的条件下,表示反应平衡时溶液pH值与电位之间的关系.水溶液里的反应可用通式表示如下:
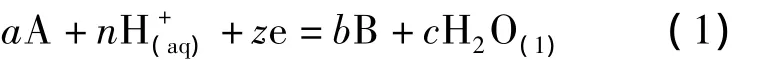
式中A,B分别为反应物与生成物,a,b,c,n均为化学计量系数;z是参加反应的电子数;aA是氧化态活度,aB是还原态活度.
在温度和压强不变时,反应式(1)的吉布斯自由能变化为

在稀溶液中,aH2O=1,pH= -lg aH+,式(2)可以变化为:


式中 R=8.314 J·K-1mol-1,F=96 500 C/mol.
2 热力学数据的来源和计算
2.1 常温(298 K)条件下的热力学数据
2.2 高温(373 K,423 K,473 K)条件下的热力学数据计算
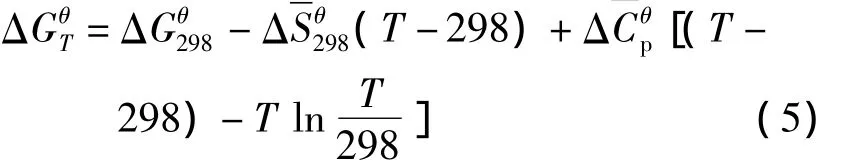

表1 298 K条件下CaS-H2 O系主要物质的热力学数据[7,8]Table 1 Thermodynam ic data ofmain substances in the CaS-H2 O system at298 K
则任何温度下氧化还原反应体系的电位可表示为

对于溶解沉淀反应体系,高温下pH为:
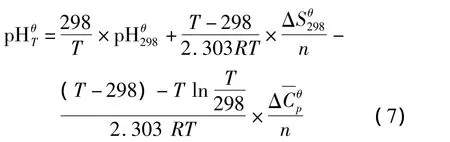

将(8)式代入(5)式即得中性物质平均热容
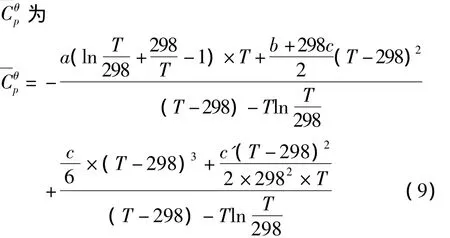
式中的 a,b,c,c',为各中性分子的热容温度系数.
2.2.2 离子的平均热容Cθp计算
离子平均热容可根据离子熵对应原理[9]求得,即对同类离子而言,Cθp与 298 K 的绝对熵值成正比关系,即:

2.2.3 高温条件下CaS-H2O体系中相关物质的平均热容
根据中性分子和离子的平均热容计算公式(9)、(10)以及相关热力学数据,计算出CaS-H2O体系中相关物质的平均热容如表 4所示
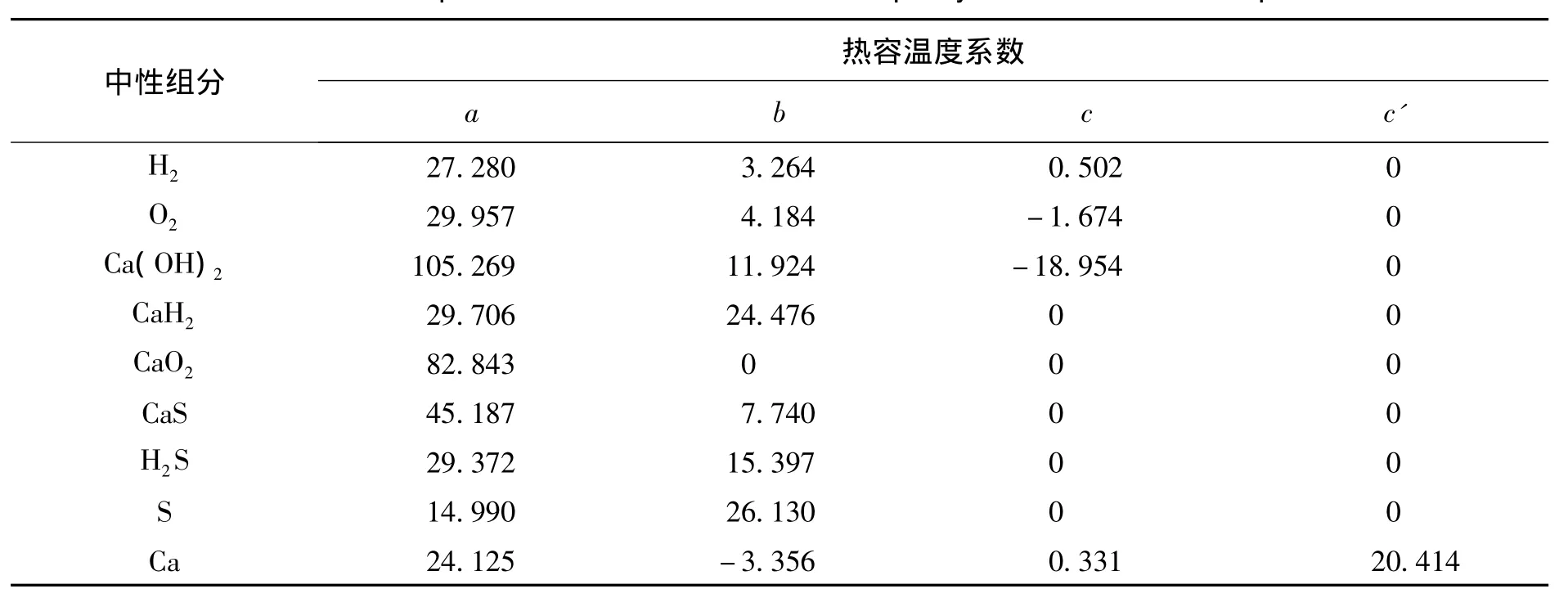
表2 相关中性组分的热容温度系数[8]Table 2 The tem perature coefficient of the heat capacity of some neutral com ponents
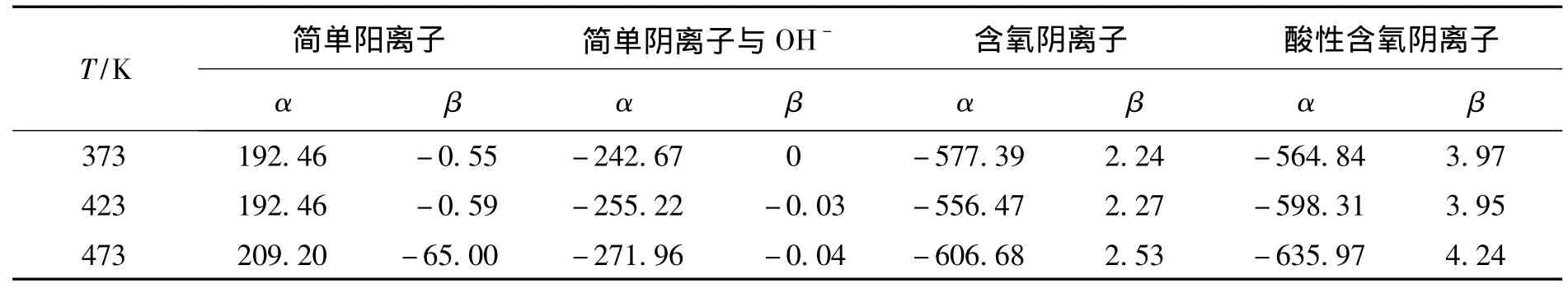
表3 离子热容参数[2]Table 3 The heat capacity parameters the ionsT/K简单阳离子简单阴离子与OH- 含氧阴离子
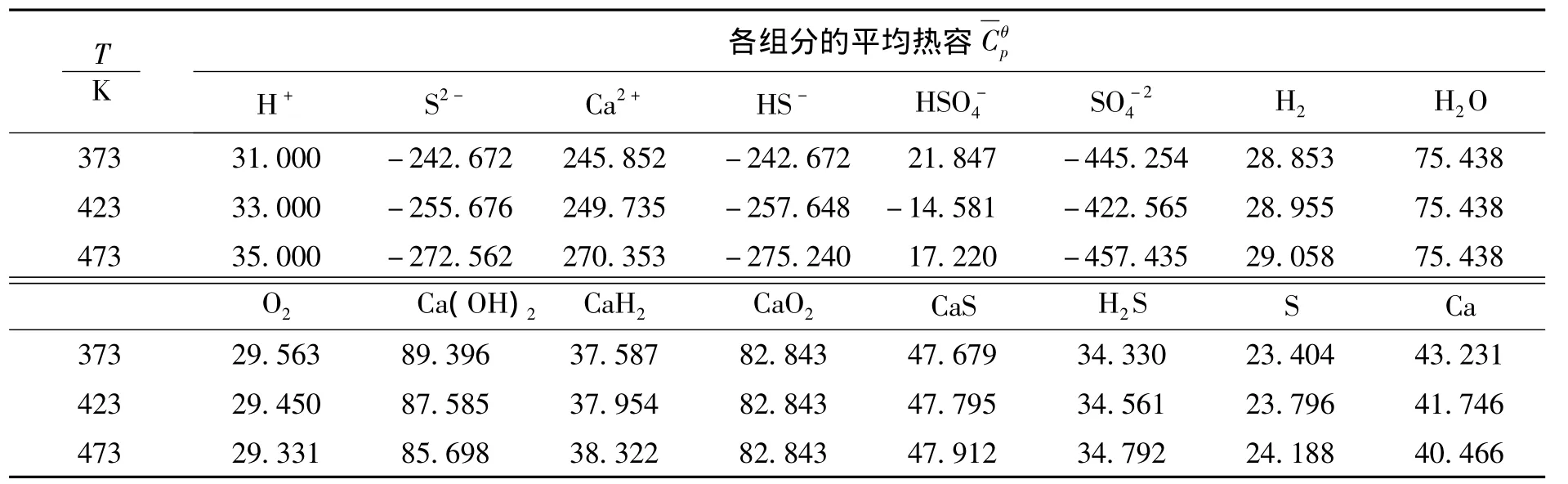
表4 不同温度条件下CaS-H2O系中各物质的平均热容Table 4 The average heat capacity of various substances inCaS-H2O system at 373、423 and 473 K
3 不同温度条件下的电极反应平衡式和电位-pH关系式
由于CaS溶解度很低,因此假设CaS-H2O体系中各离子活度为1,各气体分压为0.1 MPa,根据体系中可能存在的物质及它们之间的电极反应和热力学关系,体系中各电极反应平衡式和电位-pH关系式如表5.
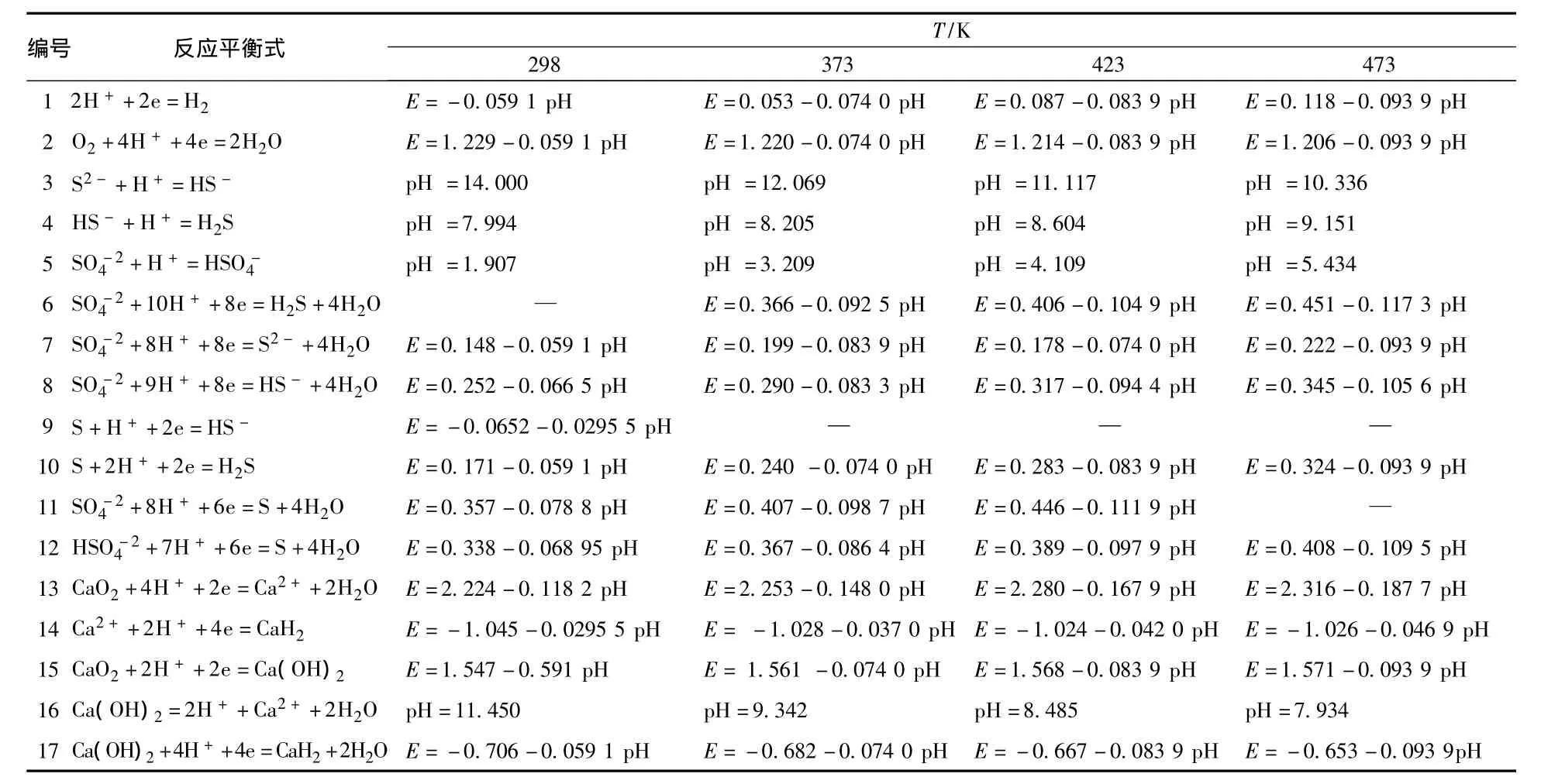
表5 CaS-H2 O系中的反应平衡式和电位-pH关系式Table 5 Relationship between reaction equilibrium and potential-pH in the CaS -H2 O system
考虑到电极Ca2+/Ca的电位极低,其稳定区远在水的稳定区之下,发生的电极反应对分析结果影响不大.在书写电极电位反应式时,主要以E=-1.4~1.4和pH=-2~16之间的电极反应为主.
4 不同温度条件下CaS-H2 O系电位-pH图的绘制
根据表5中电极反应方程式和相关的平衡关系,利用绘图软件origin8.0绘出电位-pH图,并在每条线上标出电极反应式的编号,获得298、373、423和473 K条件下的CaS-H2O系电位-pH图,如图1所示.
图1表明:由于电极Ca2+/Ca的平衡电位极低,即便是在高温条件下,Ca和CaS的稳定存在区也不在CaS-H2O系电位-pH图中pH=-2~16,E=-1.4~1.4的范围内.但是可以明显看出,含硫离子及其化合物几乎都存在于水的稳定存在区氢线1和氧线2之间.从图1(a)可以看出:在常温下,CaS的浸出反应可自发进行,根据pH值的大小硫分别以S2-、HS-和H2S的形式存在;升高电位,S2-,HS-和 H2S可氧化生成为,S或.同时由于碱金属Ca的特殊性,在水的稳定区,一般情况应该是以Ca2+的方式存在的,但是由于其极易与和OH-结合生成微溶物质CaSO4和Ca(OH)2,从而CaS-H2O系电位-pH图中物质稳定区主要以Ca(OH)2+S2-,Ca(OH)2+HS-,Ca2++HS-,Ca(OH)2+H2S,Ca2++H2S,Ca2++S,Ca2++,CaSO4,Ca(OH)2+的形式存在,变化不大.
从图1(b)、(c)、(d)可以看出:随着温度的升高,电位-pH图中各电极反应的E变化不大;S2-平衡 pH变小,H2S平衡 pH变大,HS-的 pH范围缩小,即随温度的升高,S2-和H2S的稳定区扩大,HS-的稳定区缩小,都将有利于HS-向S2-和H2S的转化.随着温度的升高,平衡线5右移,平衡线16左移,Ca2++和Ca(OH)2+的稳定区扩大,而CaSO4的稳定区缩小;因此升高温度,有利于微溶物质CaSO4的浸出,从而提高硫的浸出率.473 K时,在水的稳定存在区,pH>7.934的条件下,主要以Ca(OH)2稳定存在区和S2-,HS-,H2S以及稳定存在区为主.
对于炼钢脱硫废渣浸出去硫,为了降低钙的损耗并提高硫的浸出率,需要在减少钙的浸出量的同时,促进硫以离子形式进入浸出液或以气体形式逸出.从热力学上考虑,在一定的温度条件下,通过调整pH值的大小和电位的高低,可以确定CaS浸出方向.
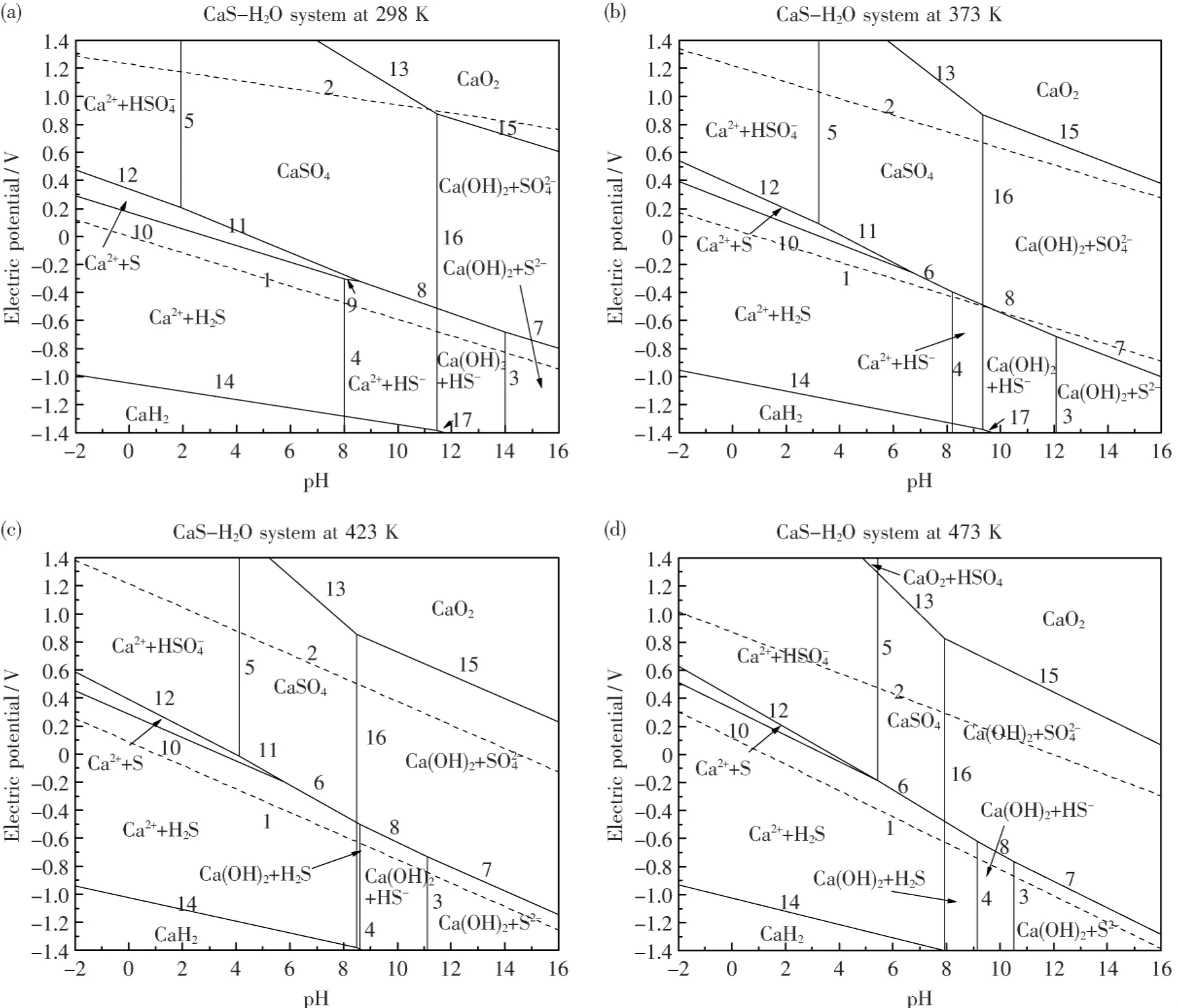
图1 不同温度条件下CaS-H2 O系电位-pH图Fig.1 Potential-pH diagrams of CaS-H2 O system at different temperatures
5 结论
(1)用热力学计算的方法绘制了298,373,423和473 K时的CaS-H2O系电位-pH图,明确了温度对各物质稳定区的影响.
(2)298 K时,硫化钙的浸出反应即可自发进行.随着温度的升高,S2-和H2S稳定区扩大,HS-稳定区缩小,有利于HS-向S2-和H2S的转化;同时CaSO4的稳定区缩小,有利于微溶物质CaSO4的浸出.当温度升至473 K时,在水的稳定存在区,pH>7.934的条件下,主要以Ca(OH)2稳定存在区和S2-,HS-,H2S以及稳定存在区为主.
(3)不同温度条件下电位-pH图的建立,直观地反映了钙和硫的稳定存在形式以及体系中电
极反应的平衡关系,为炼钢脱硫废渣的浸出去硫提供热力学参考.
[1]陈小文,白新德.升温条件下Zr-H2O系电位-pH平衡图[J].稀有金属材料与工程,2004,7(7):710-713.
(Chen Xiao-wen,Bai Xin-de.Potential-pH diagrams of Zr- H2O system at the increased temperatures[J].Rare Metal Materials and Engineering,2004,7(7):710 -713.)
[2]蒋汉瀛.湿法冶金过程物理化学[M].北京:冶金工业出版社,1984:34,55-60.
(Jiang Han-ying.Physical chemistry of process wet metallurgy[M].Beijing:Metallurgical Industry Press,1984:34,55-60.)
[3]何环宇,倪红卫,甘万贵,等.炼钢渣的冶金资源化利用及评价[J].武汉工程大学学报,2009,31(1):41-45.
(He Huan - yu,Ni Hong - wei,Gan Wan - gui,et al.Resource utilization and evaluation of the steelmaking waste slag reuse inmetallurgic flied[J].Journal ofWuhan Institute of Technology,2009,31(1):41 -45.)
[4] He Huan - Yu, Ni Hong - Wei, Zhang Hua, et al.Crystallized path of phases and mechanism of sulfur incorporation in refining spent slag[C].∥Asia Steel 2009 International Conference.Busan,Korea,2009:276.
[5]何环宇,倪红卫,甘万贵,等.精炼钢渣硫赋存形式及含硫相形成机理[J].钢铁,2009,44(3):32-35.
(He Huan - yu,Ni Hong - wei,Gan Wan - gui,et al.Sulfur’s existence form and sulf-phase forming mechanism in solidified refining slag[J].Iron and Steel,2009,44(3):32-35.)
[6]何环宇,倪红卫,刘吉刚,等.亚临界水对钢渣再生脱硫的作用[J].过程工程学报,2009:230-233.
(He Huan -yu,Ni Hong-wei,Liu Ji-gang,et al.Effectof subcritical water on regeneration desulfurization of spent slag[J].Chinese Journal of Process Engineering,2009:230-233.)
[7]钟竹前,梅光贵.化学位图在湿法冶金和废水净化中的应用[M].长沙:中南工业大学出版社,1986:1-48.
(Zhong Zhu-qian,Mei Guang-gui.Chemical bitmap applications in hydrometallurgical and waste water purification[M].Changsha:Central South University of technology press,1986:1-48.
[8]叶大伦.实用无机物热力学数据手册[M].北京:冶金工业出版社,2002:199-868.
(Ye Da-lun.Practical inorganic thermodynamic data sheet[M].Beijing:Metallurgical Industry Press,2002:199-868.)
[9]Criss CM,Cobble JW.The thermodynamic properties of high temperature aqueous solutions.V.the calculation of ionic heat capacities up to200°,entropies and heat capacitiesabove200°[J].JAm Chem Soc,1964,86:5390~5394.
Potential-pH diagram s for heating leaching process of calcium sulfide
HE Huan-yu,PEIWen-bo,LIU Xuan,WANG Hai-hua,CUIYi-fang
(Key Laboratory for Ferrous Metallization and Resources Utilization of Ministry of Ministry of Education,Wuhan University of Science and Technology,Wuhan 430081,China)
In order to study the leaching of sulfur from the steel desulfurization slag,the potential-pH diagrams of the CaS-H2O system at different temperature conditions were drawn based on thermodynamic calculation by the average heat capacitymethod.The influence of temperature on calcium,the stable region of sulphur and the electrode reaction balance were studied.The results show that,at the normal temperature,the sulfur can be leached spontaneously;as the pH decreases,the sulphur escapes in the form of H2S;while as the pH increases,the sulphur turns into leachate in form of S2-;the rising temperature is favorable to transform HS-into H2S and S2-,the leaching of CaSO4can increase the leaching ratio of sulfur.Compared with the normal temperature,athigher temperatures,when pH is above 7,it ismore profitable to convert calcium to Ca(OH)2,and italso beneficial to turn the sulphur into leachate in forms of S2-,HS-,SO-24,or escape in the form of H2S.
CaS-H2O system;thermodynamic calculation;potential-pH diagram
TF 09
A
1671-6620(2012)03-0165-06
2012-08-01.
何环宇 (1971—),女,武汉科技大学副教授,博士,E-mail:hujia18mei@163.com.

