油菜蜂花粉中黄酮的分离纯化及结构鉴定
陈莲君 徐德平
(江南大学食品学院,江苏 无锡 214122)
油菜蜂花粉中黄酮的分离纯化及结构鉴定
陈莲君 徐德平
(江南大学食品学院,江苏 无锡 214122)
研究油菜蜂花粉黄酮的组成,采用乙醇提取,石油醚萃取脱脂和柱层析分离方法对油菜蜂花粉黄酮进行研究,得3个黄酮类化合物,经1H-NMR、13C-NMR,分别鉴定出3个黄酮类化合物化学结构为山奈酚-3-O-β-D-吡喃葡萄糖苷、山奈酚-3-O-β-D吡喃葡萄糖基(1→2)-β-D-吡喃葡萄糖苷和槲皮素-3-O-β-D-吡喃葡萄糖苷,与 HPLC- MS检测结果一致。
油菜蜂花粉;黄酮;分离;结构鉴定;HPLC-MS;核磁共振;质谱分析
油菜(Brassica campestris L.)是十字花科植物油菜的嫩茎叶,原产中国,为中国大面积种植的农业经济作物。花粉(pollen)是植物有性生殖的雄性配子体,它浓缩了植物界所有的营养物质,被人们誉为“最完美的食物”。蜂花粉则是蜜蜂采集的花粉加入花蜜和唾液形成的粒状物,因此,又被人们誉为“微型营养库”[1]。油菜蜂花粉除了含有多种氨基酸、维生素和微量元素以及大量的蛋白酶、核酸等活性物质外,还含有大量黄酮类化合物,尤其黄酮苷的含量更高[2]。据报道[3-6],生物类黄酮具有多种活性,包括延缓衰老,治疗和预防癌症、心血管病,抑制前列腺疾病,降血糖,降血脂和防辐射等作用。
目前国内外对油菜蜂花粉中的黄酮研究虽然较多,但并不系统。本试验利用HPLC-MS首先确定油菜蜂花粉中黄酮的基本组成,再通过多种方法对主要组分进行分离并对其化学结构进行鉴定,从而为油菜蜂花粉的活性研究提供物质基础。
1 材料与方法
1.1 材料与试剂
油菜蜂花粉:南京老山药业有限公司;
聚酰胺:浙江省台州化工厂;
ODS柱填料:进口分装;
GF254硅胶板:山东烟台芝罘化工厂;
无水乙醇、丙酮、硫酸、茴香醛、冰醋酸、甲醇、石油醚(30~60℃)、正丁醇:分析纯,上海化学试剂采购供应站;
其它试剂:均为分析纯。
1.2 仪器设备
旋转蒸发器:RE52CS,上海亚荣生化仪器厂;
中药粉碎机:WFJ8-20,江阴市灵杏药化设备有限公司;
暗箱式紫外透射仪:ZF-90,上海顾村电光仪器厂;
恒流泵:HL-2,上海沪西分析仪器厂有限公司;
核磁共振仪:Brucker AVance500,中科院上海有机化学研究所;
质谱仪:LCQ型,美国Thermo-Finnegan公司;
气相色谱仪:GC-17AATF,日本岛津公司;
循环水多用真空泵:SHB-III,郑州长城科贸有限公司;
数显恒温水浴锅:HH-4,江苏省金坛市荣华仪器厂。
1.3 油菜花粉中黄酮的提取
称取油菜蜂花粉8kg,粉碎后过80目筛,以75%乙醇为溶剂[7],1∶5(m∶V)的料液比,回流提取2h,过滤出清液,渣再重复提取2次,合并清液减压浓缩至无乙醇时止。用石油醚脱脂多次,至石油醚液无色为止。取脱脂后的液体再用旋转蒸发器浓缩至无石油醚时止,再加95%乙醇使乙醇浓度为70%,4℃静置12h,取上清液浓缩至无醇味,得油菜蜂花粉黄酮粗提物。
1.4 油菜蜂花粉黄酮组成分析
取油菜蜂花粉黄酮粗提物适量,加色谱纯甲醇溶解用于HPLC分析。
色谱条件[8]:Waters600/2410色谱柱;流动相为V(甲醇)∶V(水)=60∶40;检测波长254nm;流速1mL/min;柱温为室温;进样量10μL。
1.5 油菜蜂花粉黄酮的分离和纯化
将油菜蜂花粉粗提物加适量蒸馏水稀释,过聚酰胺柱(60mm×100cm),流速10mL/min经,依次用去离子水、10%,30%,50%乙醇溶液进行洗脱,每梯度洗脱1 000mL,洗出液分步收集,TLC薄层检测。根据Rf值和显色反应,初步分为A、B和C 3个组分。将3个组分分别反复上ODS色谱柱,最终得到3种纯的化合物,分别为I,II,III。
1.6 化合物结构鉴定
将化合物I、II和III样品用DMSO-d6溶解后进行1HNMR和13C-NMR分析。
2 结果与讨论
2.1 油菜花粉黄酮组成
油菜花粉的黄酮粗提物经HPLC-MS检测结果见图1。由图1可知,3个主峰出峰时间分别为4.07,4.44,4.61min,推测油菜花粉中主要由3种黄酮组成。保留时间为4.07min的峰的分子量为610,保留时间为4.44min的峰的分子量为464,保留时间为4.61min的峰的分子量为448。从分子量和碎片裂解方式来看这3个峰对应的都是黄酮类物质,但具体是哪3种黄酮还需要进一步确定。
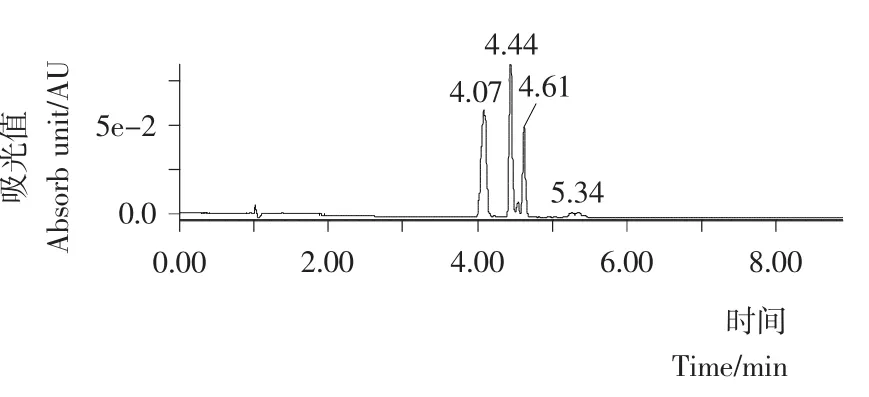
图1 油菜蜂花粉黄酮HPLC谱图(254nm)Figure 1 HPLC spectrum of flavonoids in bee pollen rape(254nm)
2.2 化合物的结构解析
2.2.1 化合物I 淡黄色粉末,盐酸-镁粉反应显紫红色,浓硫酸反应显黄色,可溶于甲醇、乙醇。由图2(a)可知,该化合物的分子量为610。
从1H-NMR谱可见δ8.13和7.16处各有2个H,其偶合常数值均为7.2,表明这4个H处于对位取代苯环上。δ6.46和6.23处各有1个 H,其偶合常数为2.0,说明这2个H为苯环上的间位H。δ5.48和5.38处各有2个H,推测这2个H应为糖上的端基H,说明存在2个糖基。δ3.2~4.8为糖上其余H的信号。
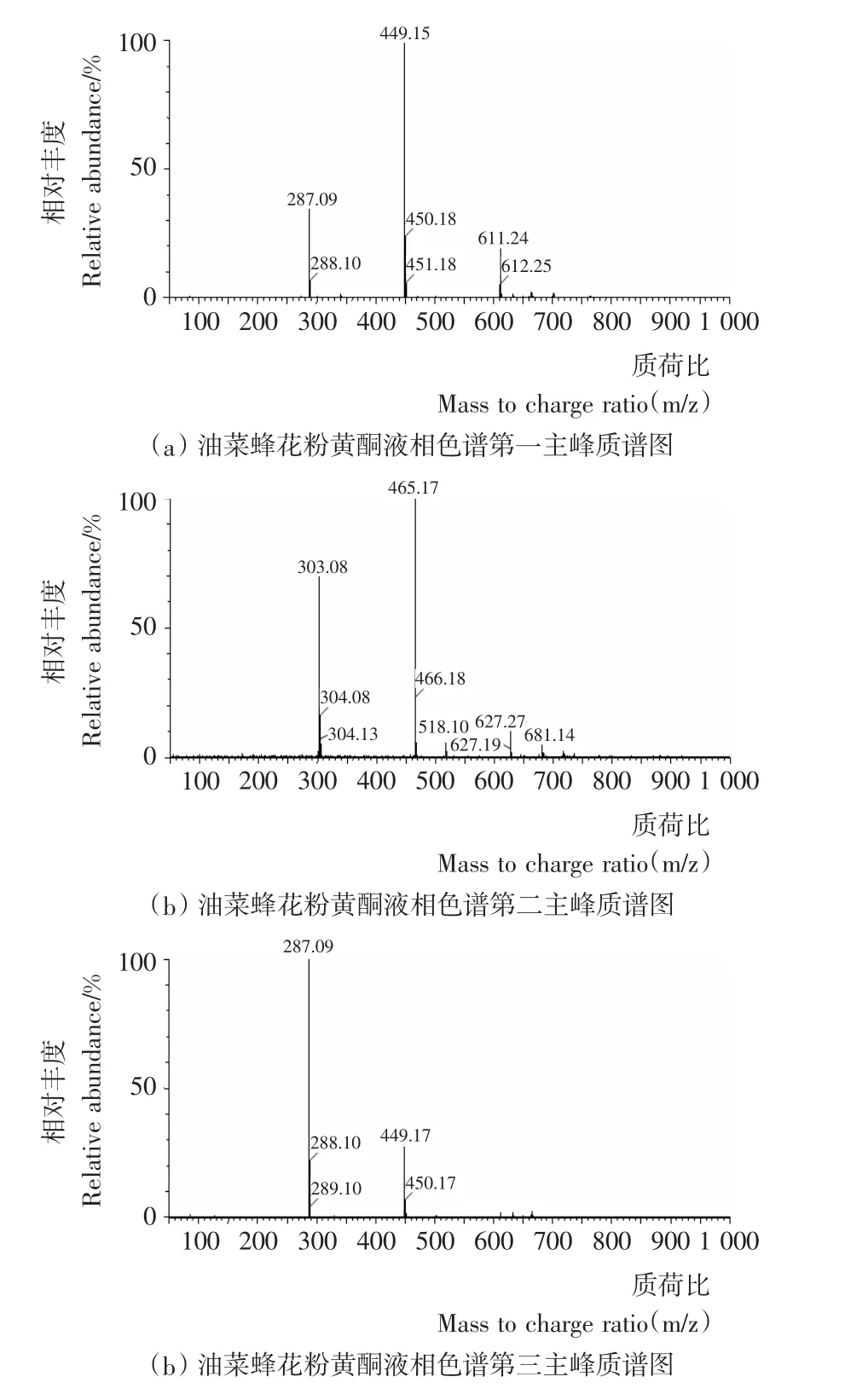
图2 液相色谱中各峰质谱(ES+)图Figure 2 Mass spectrum of Liquid chromatography
从13C-NMR谱上可见该化合物共有27个碳,其中有12个糖的碳信号,从余下的15个碳信号来看,应为黄酮类化合物,且δ133.8的碳信号表明化合物I为黄酮醇类物质。综合分析其波普数据和理化性质与文献[9]、[10]中山奈酚-3-O-β-D吡喃葡萄糖基(1→2)-β-D-吡喃葡萄糖苷的数据一致,故化合物I鉴定为山奈酚-3-O-β-D吡喃葡萄糖基(1→2)-β-D-吡喃葡萄糖苷。化合物的结构式见图3。
2.2.2 化合物II 淡黄色粉末,盐酸-镁粉反应显紫红色,浓硫酸反应显黄色,可溶于甲醇、乙醇。由图2(b)可知,该化合物分子量为464。
从1H-NMR谱可见δ7.96,7.95处各有一个 H,为dd峰,其偶和常数为7.6和1.8。δ7.81处有一个H,偶合常数为7.6,从这些数据可得这3个H为同一苯环上的3个H。δ7.96与7.68处的二个H为邻位关系。δ7.96与7.81处的H为间位。δ6.51和6.26处存在2个H,其J值为2.0。表明这2个H为苯环上的2个间位H。δ5.61处有1个H,判断该H为糖上端基H,δ3.4~4.8处为糖上其余H的信号。从以上数据可以推测出物质II为槲皮素-3-O-β-D-吡喃葡萄糖苷,与文献[11]报道的槲皮素-3-O-β-D-吡喃葡萄糖苷数据一致。化合物结构式见图3。
2.2.3 化合物III 淡黄色粉末,盐酸-镁粉反应显紫红色,浓硫酸反应显黄色,可溶于甲醇、乙醇。由图2(c)可知,该化合物的分子量为448。
从该化合物的1H-NMR谱可知δ8.07处有2个H,偶合常数为8.9,δ6.93处有2个H,其J值为8.9,表明这4个H位苯环上的AA′BB′系统的H,说明有对位取代苯的出现。δ6.44和6.20处各有2对H,J值都为2.0。表明这2个H为同一苯环体系中的间位H。δ5.68处有一个H,这为糖的端基质子,从其偶合常数7.1来看,该糖为β构型。δ3.4~4.8为糖上其余H的信号。
综合判断该化合物为黄酮类物质,与文献[12]、[13]所报道的山奈酚-3-O-β-D-吡喃葡萄糖苷的数据一致。化合物结构见图3。
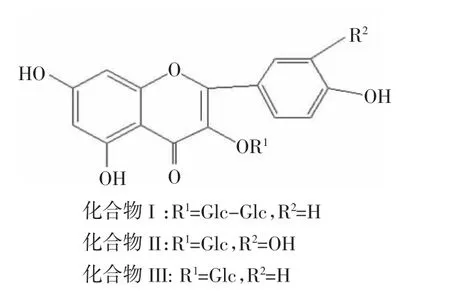
图3 化合物I、II、III的结构Figure 3 Structure of compound I、II、III
3 结论
采用75%乙醇回流提取,石油醚脱脂,经 HPLC-MS分析得出蜂花粉中的黄酮主要有3种成分,然后再经聚酰胺柱色谱和ODS柱色谱层析,从油菜花粉中分离得到3种黄酮化合物,证实了HPLC-MS的检测分析。并且通过核磁共振和质谱分析,与相关文献[9-13]对照,鉴定其为山奈酚-3-O-β-D-吡喃葡萄糖苷、山奈酚-3-O-β-D吡喃葡萄糖基(1→2)-β-D-吡喃葡萄糖苷和槲皮素-3-O-β-D-吡喃葡萄糖苷。
1 曹炜,尉亚辉.蜂产品保健原理与加工技术[M].北京:化学工业出版社,2002:128~136.
2 刘建涛,刘利.蜂花粉生物活性物质的研究进展[J].食品科学,2006,27(12):909~911.
3 郭娟丽,张培成,张智武.油菜花粉的化学成分研究[J].中国中药杂志,2009,34(10):1 235~1 237.
4 M Le ja,Mareczek A,G wyzgloik,et al.Antioxidative properties of bee pollen in selected plant species[J].Food Chemistry,2007(100):237~240.
5 Wu Y D,Lou Y J.Brassinolide,aplant sterol from pollen of Brassica napus L.,induces apoptosis in human prostate cancer PC-3cells[J].Pharmazie,2007,62(5):392~395.
6 刘成梅,游海.天然产物有效成分的分离与应用[M].北京:化学工业出版社,2003:170~180.
7 郭雪微,卢挺.油菜蜂花粉中黄酮等生物活性物质的提取工艺研究[J].北京中医药,2008,27(12):968~970.
8 郑敏燕,魏永生.油菜蜂花粉黄酮含量的 HPLC测定[J].分析测试学报,2004,23(2):95~97.
9 Markham K R,B Ternal,R Stanley,et al.Carbon-13NMR studies of flavonoids III[J].Tetrahedron,1978(34):1 389~1 397.
10 刘东红,杨开,叶兴乾,等.油菜花粉中黄酮苷类的制备分离和鉴定[J].中国粮油学报,2010,25(8):92~96.
11 张晓溶,彭树林,肖顺昌.单条草化学成分的研究[J].应用与环境生物学报,1998,4(2):145~147.
12 于敏荣,李铣,张海军,等.小花棘豆化学成分的研究[J].植物学报,1992,34(5):369~377.
13 韩慧英,张雪,王乃利,等.油菜花粉活性部位化学成分的研究[J].中草药,2006,37(增刊):196~199.
Separation purification and structure elucidction of flavonoids from rape pollen
CHEN Lian-jun XU De-ping
(Food College of Jiang Nan University,Wuxi,Jangsu214122,China)
Bee-collected rape pollen extracted with 75%EtOH,and the mixture was suspended in H2O and was extracted and degreased successively with petroleum ether.The compounds were isolated by polyamide column chromatography and Octadecyl silane chemically bonded to silica gel column chromatography.Three compounds were isolated from Bee-collected rape pollen and were determined by1HNMR、13C-NMR、MS.The structures of them were kaemferol-3-O-β-D-glucoside、kaemferol-3-O-β-D-glucosyl-(2→1)-β-D-glucoside and quercetin-3-O-β-D-glucoside.
rape pollen;flavonoids;separation purification;structure elucidation;HPLC-MS;NMR;mass spectrometry
10.3969/j.issn.1003-5788.2012.03.033
陈莲君(1988-),女,江南大学在读硕士研究生。E-mail:c_l_jhappy@sohu.com
2012-01-15

