6-位脂肪胺取代的萘酰亚胺衍生物与DNA的相互作用
解丽娟
(华侨大学 分子药物学研究所,福建 泉州 362021)
6-位脂肪胺取代的萘酰亚胺衍生物与DNA的相互作用
解丽娟
(华侨大学 分子药物学研究所,福建 泉州 362021)
利用紫外可见光谱、荧光光谱、圆二色谱和粘度测试,考察了8个6-位脂肪胺取代的萘酰亚胺衍生物与小牛胸腺DNA的相互作用.研究结果表明:小牛胸腺DNA对与其结合能力强的化合物3a~3d有荧光猝灭作用,对与其结合能力弱的3e~3h有荧光增强效应;圆二色谱显示这些萘酰亚胺化合物能引起DNA二级结构发生不同的变化.在紫外-可见吸收光谱和粘度测试中,这些化合物与DNA的相互作用没有差别.综合光谱学和粘度测试的结果,推断这些化合物是通过嵌插方式与DNA结合,由于结构不同,它们与DNA之间作用程度存在差异.
萘酰亚胺;小牛胸腺DNA;光谱;粘度;相互作用;嵌插方式
小分子化合物与DNA相互作用的研究一直是引人关注的领域[1-3].通过研究小分子化合物与DNA的相互作用,一方面可以了解引起DNA结构变化和影响其生理功能的因素;另一方面可以从分子水平了解小分子抗肿瘤化合物的作用机制,从而为防治肿瘤发生及开发新的高效抗肿瘤药物提供指导.萘酰亚胺类衍生物是一类著名的DNA嵌入剂和拓扑异构酶Ⅱ型抑制剂,对多种人和鼠的肿瘤细胞具有较高的抗肿瘤活性[4-8].近年来,因发现萘酰亚胺类化合物具有抗多药耐药性[7],对其研究日益引起人们的关注.文献[9-11]分别报道了不同结构的6-位脂肪胺取代的萘酰亚胺衍生物,但并未深入研究所报道的萘酰亚胺衍生物与DNA的相互作用.萘酰亚胺衍生物与DNA发生非共价结合后,两者的物理性质都会发生明显的变化,通过测定其变化,可以定性、定量地评价萘酰亚胺衍生物与DNA的结合过程,确定结合模式[12-15].Long等[12]提出并证明需要融合几组实验技术才能很好地确定化合物与DNA的结合模式.这些实验技术包括:1)评价DNA螺旋变化;2)反映DNA和结合的化合物之间的电性作用;3)确定分子嵌入DNA的取向.本文利用紫外吸收光谱、荧光发射光谱、圆二色谱和粘度测试法,分别考察包括文献[9-11]报道在内的8个6-位脂肪胺取代的萘酰亚胺衍生物与DNA的相互作用.
1 实验部分
1.1 原料与仪器
原料及溶剂均为市售分析纯,缓冲溶液自行配制;小牛胸腺DNA(CT-DNA,美国Sigma公司);柱色谱硅胶(200-300目,山东青岛海洋化工厂).
HP1100LC/MSD型质谱仪(美国HP公司),GCT CA156型和LCT型质谱仪(英国Micromass公司),Nicolet 20DXB型FR-IR红外光谱仪(美国Nicolet公司),Varian INOVA 400型核磁共振仪(400 MHz,TMS为内标,美国Varian公司),X-6型显微熔点测定仪(北京泰克仪器有限公司),F-4500型荧光分光光度计(日本日立公司),BS-210S型万分之一电子天平(德国Sartorius公司),UV-3100型分光光度计(日本岛津公司),J-810型圆二色谱仪(日本Jasco公司).
1.2 6-位脂肪胺取代的萘酰亚胺衍生物的合成
图1为8个6-位脂肪胺取代的萘酰亚胺衍生物结构图.图1中:3a,3b,3c和3f被Antonini等[10],Wu等[11]和 Norton等[9]分别报道过.
萘酰亚胺衍生物的具体合成方法:将4-溴-1,8-萘酐(277mg,1mmol)和N,N-二甲基乙二胺(112 μL,1.2mmol)溶于20mL乙醇中,加热回流2h,减压蒸除溶剂,得到中间体.该中间体(174mg,0.5 mmol)与要取代的脂肪胺(2mmol)和碳酸钾(69mg,0.5mmol)溶于15mL的乙二醇单甲醚中,加热回流8~12h;粗产物经硅胶柱柱层析精制,得到目标产物.最后,产物的结构经过高分辨质谱、核磁(氢谱和碳谱)、红外光谱的表征和验证.
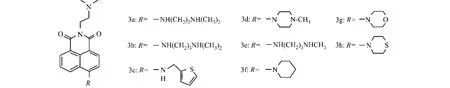
图1 6-位脂肪胺取代萘酰亚胺衍生物的结构Fig.1 Structure of 6-aliphatic amine substituted naphthalimide derivatives
1.3 测定方法[12-15]
1.3.1 紫外吸收光谱测定 紫外滴定实验在UV-3100型分光光度计上进行,使用1cm石英吸收池,温度为25℃.首先用空白溶剂(30mmol·L-1,pH=7.5的Tris-HCl缓冲溶液)对仪器进行基线校正,测量200~600nm范围内浓度为50μmol·L-1的萘酰亚胺衍生物的紫外吸收谱;然后,往溶液中滴加CT-DNA,改变其与萘酰亚胺衍生物的浓度比值.每次加完DNA后混合数遍,以使DNA和萘酰亚胺衍生物充分接触、反应;放置10min后,使两者反应达到平衡并测量、记录光谱数据.
1.3.2 荧光发射光谱测定 取0.1mL精确配制的,浓度为0.1~1.0mmol·L-1的萘酰亚胺衍生物DMSO溶液,与30mmol·L-1的Tris-HCl(pH=7.5)缓冲溶液混合于10mL的容量瓶中,制备两组萘酰亚胺衍生物的Tris-HCl-DMSO溶液.其中一组为加入小牛胸腺DNA(CT-DNA)的Tris-HCl溶液,另一组为不含DNA的相同浓度化合物的溶液,萘酰亚胺衍生物的浓度保持在1.0~10.0μmol·L-1之间,CT-DNA的浓度为50μmol·L-1,定容,室温避光放置一夜.将得到的一组样品液和空白对照液分别置于1cm石英比色池中进行测试,扫描速度为1 200nm·min-1,激发波长为最大吸收值,激发狭缝宽度5nm,发射狭缝宽度5nm,测其荧光发射谱.
1.3.3 圆二色谱测定 将浓度为10μmol·L-1的萘酰亚胺衍生物加入到100μmol·L-1的CT-DNA溶液中,比较化合物在加入DNA前后所引起的DNA自身圆二色谱(CD)谱图的变化.实验条件:扫描范围为200~600nm;扫描速度为500nm·s-1;响应时间为0.5s;狭缝宽度为2nm;积累次数为2次;CD谱的样品池厚度为1.0cm.
1.3.4 粘度测试 将CT-DNA溶于Tris-HCl缓冲溶液(30mmol·L-1,pH=7.5)中,于4℃下保存;全部溶解后,在超声仪中震荡10min,用PVDF膜(孔径0.45μm)过滤,以滤去不溶物,配制的CTDNA浓度为100μmol·L-1[16].粘度测定在乌氏粘度计上进行,放置于恒温水域槽中,水浴保持恒温25℃.吸取10mL,100μmol·L-1的CT-DNA置于粘度计中,用秒表记录滴下时间.然后,分别滴加浓度为1.0mmol·L-1的萘酰亚胺衍生物溶液,使其浓度和DNA浓度的比值逐渐增加,用吸耳球鼓泡以混匀溶液;记录萘酰亚胺衍生物滴下时间并重复测量3次,每次相差不超过0.2s,取其平均值.以(η/η0)1/3是相对于萘酰亚胺衍生物浓度与DNA浓度的比值作图.其中:η表示滴加萘酰亚胺衍生物后DNA的相对运动粘度;η0表示没有萘酰亚胺衍生物时DNA的相对运动粘度[17].
2 结果与分析
2.1 紫外吸收光谱分析
萘酰亚胺衍生物3a的紫外吸收光谱(UV-Vis),如图2所示.图2中:A为吸光度;曲线1~10的DNA与萘酰亚胺衍生物的浓度比值分别为0.02,0.04,0.06,0.10,0.14,0.20,0.30,0.40,0.50,1.00.
由图2可以发现:随着CT-DNA的不断滴加,萘酰亚胺衍生物3a的特征吸收带呈现明显的减色效应,不过并没有出现吸收峰位置红移和等吸收点,这表明萘酰亚胺衍生物与DNA的碱基电子产生相互作用.
其他萘酰亚胺衍生物的紫外吸收光谱在逐渐滴加CTDNA后也呈现类似的现象,表明不同6-位脂肪胺取代的萘酰亚胺衍生物可能与DNA以相同或近似的方式相结合.

图2 萘酰亚胺衍生物与CT-DNA相互作用的紫外吸收光谱Fig.2 UV-vis absorption spectra of interaction between naphthalimide derivatives and CT-DNA
2.2 荧光发射光谱分析
萘酰亚胺衍生物3a,3h与CT-DNA相互作用的荧光发射谱,如图3所示.图3中:I为荧光强度;曲线1~6的萘酰亚胺衍生物浓度分别为2.5,5.0,7.5,10.0,15.0,20.0μmol·L-1;曲线1′~6′则在上述萘酰亚胺衍生物浓度下均加入50μmol·L-1的DNA.从图3可知:像大多数DNA嵌入剂一样,随着CT-DNA的不断滴加,萘酰亚胺衍生物的荧光强度不断下降,发射峰没有位移变化.萘酰亚胺衍生物3b,3c和3d在滴加CT-DNA后,其荧光发射谱也产生相似的荧光淬灭现象.然而,萘酰亚胺衍生物3e,3f,3g和3h在滴加CT-DNA后,其荧光发射谱呈现明显的荧光增强现象.
分析萘酰亚胺衍生物结构可以发现,萘酰亚胺衍生物3a,3b和3d都有富含电子的叔胺氮原子存在,在测试条件下氮原子易质子化,使得萘酰亚胺衍生物容易和带负电荷的DNA相结合.萘酰亚胺衍生物3c尽管不含有这种氮原子,分子中的噻吩基团是苯的生物异构体,即富含电子,同时也容易容纳负电荷.因此,萘酰亚胺衍生物3a~3d容易与DNA相结合,发生电子转移和能量转移,导致发射光谱产生荧光猝灭现象.另外,萘酰亚胺衍生物3e~3h的结构没有这种特征,因此它们像溴化乙锭(EB)这种典型的DNA嵌入剂一样,在与DNA结合后荧光发射谱呈现荧光增强.
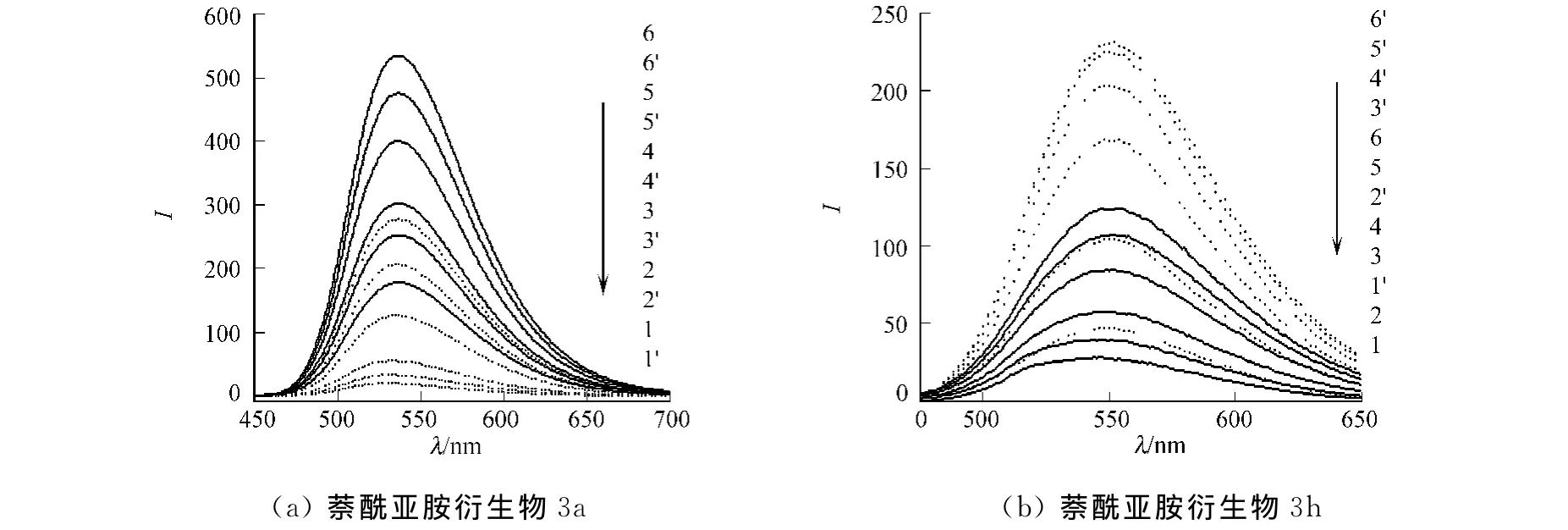
图3 萘酰亚胺衍生物与CT-DNA相互作用的荧光光谱Fig.3 Fluorescence spectra of interaction between naphthalimide derivatives and CT-DNA
萘酰亚胺衍生物与DNA之间的表观结合常数Kb,可以利用Scatchard方程[18-19]求得.经计算,萘酰亚胺衍生物3a~3h的每一位点固有的结合常数分别为0.194,0.231,0.183,0.226,0.048,0.018,0.025,0.018ML·mol-1,即萘酰亚胺衍生物3a,3b,3c和3d与DNA之间的结合常数值明显高于萘酰亚胺衍生物3e,3f,3g和3h与DNA之间的结合常数值.这个结果支持了关于导致萘酰亚胺衍生物发射光谱呈现差异的解释.
2.3 圆二色谱分析
在CT-DNA溶液中分别滴加萘酰亚胺衍生物3a,3d和3h,其圆二色谱如图4所示.图4中:θ为摩尔椭圆度;DNA浓度为100μmol·L-1;萘酰亚胺衍生物3a,3d和3h的浓度为10.0μmol·L-1;小图为诱导圆二色谱(ICD).图4对应于B型CT-DNA的二级结构构象.
从图4可知:279nm处的正峰是由于DNA的碱基对堆积而产生的,247nm处的负峰是由于DNA的双螺旋结构而产生的.在CT-DNA溶液中分别滴加萘酰亚胺衍生物3a,3d和3h后,萘酰亚胺衍生物3a和3d均引起CT-DNA的CD谱中正、负峰的摩尔椭圆度绝对值增加,标志萘酰亚胺衍生物嵌入DNA碱基对后使碱基堆积增强,双螺旋更紧凑;萘酰亚胺衍生物3h引起CD谱中正峰的摩尔椭圆度绝对值增加,负峰的摩尔椭圆度绝对值下降.这个现象进一步表明,萘酰亚胺衍生物因取代基团不同导致其和DNA结合存在差异.
在萘酰亚胺衍生物紫外最大吸收位置能够观察到诱导圆二色谱吸收带.由图4右上角的ICD放大图可以看到:萘酰亚胺衍生物的ICD信号的摩尔椭圆度绝对值不超过1.0L·(mol·cm)-1.通常,DNA嵌入剂的ICD信号值较小,最大不超过10.0L·(mol·cm)-1.因此,可以确定萘酰亚胺衍生物是通过嵌插方式与DNA结合的.根据ICD图谱可以得到DNA与嵌入剂结合的角度取向和位置信息.当嵌入剂的药效团与DNA双螺旋的对称轴平行(γ=0°)时,产生正的ICD信号;当嵌入剂的药效团与DNA双螺旋的对称轴垂直(γ=90°)时,产生负的ICD信号[20-21].结果显示:萘酰亚胺衍生物的药效团即萘酰亚胺母体环与DNA双螺旋的对称轴是垂直的.
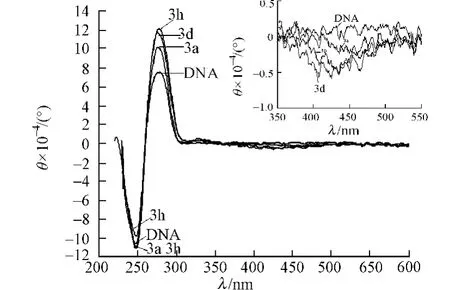
图4 萘酰亚胺衍生物与CT-DNA相互作用的圆二色谱图Fig.4 CD spectra of interaction between naphthalimide derivatives and CT-DNA
2.4 粘度测试分析
萘酰亚胺衍生物对CT-DNA溶液粘度的影响,如图5所示.图5中:DNA浓度为100μmol·L-1;反应温度为(25±0.1)℃.由图5可知,随着萘酰亚胺衍生物3a,3c,3d,3e和3h的滴加,都会引起DNA溶液的粘度不断增加,证明萘酰亚胺衍生物确实与DNA发生嵌插结合.
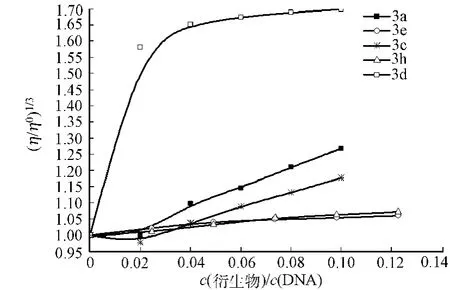
图5 萘酰亚胺衍生物对CT-DNA溶液粘度的影响Fig.5 Effect of naphthalimide derivatives on CT-DNA viscosity
3 结束语
综合光谱测试和粘度测试的结果可以确定,6-位脂肪胺取代的萘酰亚胺衍生物是通过嵌插方式与DNA相结合.不过,因为萘酰亚胺衍生物结构不同,它们与DNA结合程度存在差异.其中,含有富电子基团的萘酰亚胺衍生物与DNA结合能力强,没有这种取代基团的萘酰亚胺衍生物与DNA结合能力较弱,结果这两类萘酰亚胺衍生物与DNA作用后荧光光谱和CD谱呈现不同的现象.
[1]LI Nan,MA Ying,YANG Cheng,et al.Interaction of anticancer drug mitoxantrone with DNA analyzed by electrochemical and spectroscopic methods[J].Biophys Chem,2005,116(3):199-205.
[2]MAHESWARI P U,RAJENDIRAN V,STOECKLI-EVANS H,et al.Interaction of rac-[Ru(5,6-dmp)3]2+with DNA:Enantiospecific DNA binding and ligand-promoted exciton coupling[J].Inorg Chem,2006,45(1):37-50.
[3]WANG Bo-chu,TAN Jun,ZHU Lian-cai.Selective binding of small molecules to DNA:Application and perspectives[J].Colloid Surface B,2010,79(1):1-4.
[4]BRAÑA M F,CACHO M,GRADILLAS A,et al.Intercalators as anticancer drugs[J].Curr Pharm Des,2001,7(17):1745-1780.
[5]BRAÑA M F,RAMOS A.Naphthalimides as anticancer agents:Synthesis and biological activity[J].Curr Med Chem-Anti-Cancer Agents,2001,1(3):237-255.
[6]朱虹,丁健.萘酰亚胺类化合物作为抗肿瘤药物的研发现状[J].中国新药杂志,2007,16(10):742-747.
[7]INGRASSIA L,LEFRANC F,KISS R,et al.Naphthalimides and azonafides as promising anti-cancer agents[J].Curr Med Chem,2009,16(10):1192-1213.
[8]LÜ Min,XU Hui.Overview of naphthalimide analogs as anticancer agents[J].Curr Med Chem,2009,16(36):4797-4813.
[9]NORTON J T,WITSCHI M A,HUANG Sui,et al.Synthesis and anticancer activitives of 6-amino amonafide derivatives[J].Anti-Cancer Drugs,2008,19(1):23-36.
[10]ANTONINI I,VOLPINI R,BEN D D,et al.Design,synthesis,and biological evaluation of new mitonafide derivatives as potential antitumor drugs[J].Bioorg Med Chem,2008,16(18):8440-8446.
[11]WU Ai-bin,XU Yu-fang,QIAN Xu-hong,et al.Novel naphthalimide derivatives as potential apoptosis-inducing agents:Design,synthesis and biological evaluation[J].Eur J Med Chem,2009,44(11):4674-4680.
[12]IHMELS H,OTTO D.Intercalation of organic dye molecules into double-stranded DNA:General principles and recent developments[J].Top Curr Chem,2005,258:161-204.
[13]LONG E C,BARTON J K.On demonstrating DNA intercalation[J].Acc Chem Res,1990,23(9):271-273.
[14]PALCHAUDHURI R,HERGENROTHER P J.DNA as a target for anticancer compounds:Methods to determine the mode of binding and the mechanism of action[J].Curr Opin Biotechnol,2007,18(6):497-503.
[15]WHEATE N J,BRODIE C R,ALDRICH-WRIGHT J R,et al.DNA intercalators in cancer therapy:Organic and inorganic drugs and their spectroscopic tools of analysis[J].Mini-Rev Med Chem,2007,7(6):627-648.
[16]NISHIMURA T,OKOBIRA T,KELLY A M,et al.DNA binding of tilorone:1H NMR and calorimetric studies of the intercalation[J].Biochemistry,2007,46(27):8156-8163.
[17]LI Feng,CUI Jing-nan,QIAN Xu-hong,et al.Molecular design,chemical synthesis,and biological evaluation of′4-1′pentacyclic aryl/heteroaryl-imidazonaphthalimides[J].Bioorg Med Chem,2007,15(15):5114-5121.
[18]SCATCHARD G,ANN N Y.The Attractions of proteins for small molecules and ions[J].Acad Sci,1949,51(4):660-672.
[19]GUPTA M,ALI R.Fluorescence studies on the interaction of furocoumarins with DNA in the dark[J].J Biochem,1984,95(5):1253-1257.
[20]杨源源,张志超,盛辉,等.一种苊并杂环有机小分子嵌入DNA的几何学模式研究[J].高等学校化学学报,2007,28(3):453-457.
[21]刘振佳,司伊康,陈晓光.圆二色谱测定技术在小分子化合物与DNA相互作用研究中的应用[J].药学学报,2010,45(12):1478-1484.
Interaction between 6-Aliphatic Amine Substituted Naphthalimide Derivatives and DNA
XIE Li-juan
(Institute of Molecular Mediacine,Huaqiao University,Quanzhou 362021,China)
The DNA-binding behavior of eight 6-aliphatic amine substituted naphthalimide derivatives was investigated by UV-vis absorption spectra,fluorescence spectra,circular dichroism (CD)and viscosity measurement.The significant fluorescence quenching of 3a,3b,3cand 3dhaving stronger DNA-binding efficiency was observed upon addition of DNA,while the significant fluorescence enhancement of 3e,3f,3g and 3hhaving weaker DNA-binding efficiency was seen.CD results indicated that the change the secondary DNA structure induced by the derivatives was different.In UV-vis and viscosity measument,no obvious difference in the interaction of the derivatives and DNA was found.Taking the spectra and viscosity measurement results,it was concluded that the naphthalimide derivatives bound to DNA via intercalation and there was differential in the degree of the interaction.
naphthalimide;calf thymus DNA;spectra;viscosity;interaction;intercalated binding
陈志贤 英文审校:刘源岗)
R 961
A
1000-5013(2012)01-0039-05
2011-09-19
解丽娟(1971-),女,工程师,主要从事小分子抗肿瘤药物及基因载体的研究.E-mail:xielijuan@hqu.edu.cn.

