心痛舒含药血清预处理对乳鼠心肌细胞缺氧/复氧损伤及TNF-α、IL-1β的影响
任 婷 ,黄政德 *,田雪飞,陈楚淘
(1.湖南中医药大学医学院,湖南 长沙 410208;2.湖南中医药大学第一中医临床学院,湖南 长沙 410007;3.湖南中医药大学中西医结合学院,湖南 长沙 410208;4.湖南中医药大学研究生处,湖南 长沙 410208)
心痛舒含药血清预处理对乳鼠心肌细胞缺氧/复氧损伤及TNF-α、IL-1β的影响
任 婷1,黄政德2*,田雪飞3,陈楚淘4
(1.湖南中医药大学医学院,湖南 长沙 410208;2.湖南中医药大学第一中医临床学院,湖南 长沙 410007;3.湖南中医药大学中西医结合学院,湖南 长沙 410208;4.湖南中医药大学研究生处,湖南 长沙 410208)
目的 观察心痛舒含药血清预处理对缺氧/复氧乳鼠心肌细胞核因子-κBp65(NF-κBp65)及其下游调控因子肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)的影响,探讨心痛舒对心肌细胞缺氧/复氧损伤的保护作用机制。方法 原代培养SD乳鼠心肌细胞,建立模拟心肌细胞缺氧/复氧损伤模型,设正常组、模型组、阳性对照组、心痛舒含药血清预处理组共4组。罗丹明B染色法观察心肌细胞形态,ELISA法测定培养液上清TNF-α、IL-1β含量,半定量RT-PCR方法检测NF-κBp65 mRNA表达水平。结果 与模型组比较,阳性对照组、心痛舒含药血清预处理组TNF-α、IL-1β水平降低,NF-κBp65 mRNA的表达水平下降,差异有统计学意义(P<0.01);与阳性对照组比较心痛舒含药血清预处理组NF-κBp65 mRNA表达降低,差异有统计学意义(P<0.05)。结论 心痛舒含药血清预处理可通过抑制缺氧-复氧心肌细胞炎症反应途径发挥保护作用,其机制与抑制NF-κB活化,从而抑制下游炎性细胞合成有关。
心痛舒;心肌细胞;炎症因子;心肌细胞核因子-κBp65;肿瘤坏死因子-α;白介素-1β;乳鼠;作用机制
心肌细胞发生缺血再灌注损伤过程中,炎性介质的过表达是造成心肌炎症反应的重要原因[1],上游调控如核因子(NF-κB)的激活是诱导炎症反应发生的重要途径[2]。前期研究发现,心痛舒预处理对防治心肌缺血再灌注损伤(Ischemia/reperfusion injury,IRI)具有重要作用[3-6],而且可调节心肌细胞核因子(NF-κBp65)的表达水平。我们推测,心痛舒可能通过抑制NF-κB激活,使下游的炎症因子下调,从而抑制炎症反应,发挥抗心肌IRI保护作用。为此,本研究用血清药理学方法,采用培养乳鼠心肌细胞模拟缺氧/复氧损伤模型,进一步研究心痛舒含药血清预处理对心肌细胞缺氧/复氧损伤后NF-κB表达及其下游炎症因子的影响,从炎症反应调控角度深入探讨心痛舒抗心肌缺血再灌注损伤的保护作用机制。
1 材料与方法
1.1 药物与动物
(1)心痛舒(由丹参 20 g,檀香 6 g,赤芍 10 g,川芎 6 g,当归 6 g,红花 6 g,生地黄 12 g组成),中药材购自湖南中医药大学第一附属医院中药房,浸泡,水煎2次(檀香后下),药液经1000 r/min离心10min去除杂质,浓缩为含生药量2 g/mL。(2)SPF级12~24 h龄SD乳鼠20只,湖南中医药大学实验动物中心提供 (许可证号:SCXK湘2009-0004)。
1.2 试剂与仪器
DMEM、PBS和胰蛋白酶(Gibco公司,美国);特级胎牛血清(Hyclone公司,中国);罗丹明B(北京索来宝科技有限公司,中国);RT-PCR试剂盒(Takara生物公司,中国);肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)定量ELISA试剂盒(博士德生物工程公司,中国);超高速冷冻离心机(HERMLE公司,德国);凝胶图像处理系统(UVI公司,美国);紫外可见光分光光度计UV-754型(上海第三分析仪器厂,中国);图像分析仪(Bio-Rad公司,美国);荧光显微镜(Olympus公司,日本)。
1.3 SD乳鼠心肌细胞原代培养及鉴定
无菌切取SD乳鼠心室肌,4℃的PBS液中漂洗后加入1 mL的0.08%胰蛋白酶,于37℃恒温水浴箱中消化后去除上清液,再加入1 mL混合酶(0.06%胰蛋白酶+0.08%I型胶原酶)消化5min离心弃上清液后,采用离心差速贴壁法分离成纤维细胞和心肌细胞,将贴壁的心肌细胞以1.5×105/mL接种于6孔板,置于37℃、5%CO2培养箱中培养;将部分未贴壁的细胞以1×104/孔接种于96孔板内,进行噻唑蓝(MTT)实验,确定最佳工作浓度。48 h后进行细胞换液,观察心肌细胞搏动并采用免疫组化法检测心肌特异性肌钙蛋白T(cTnT),进行心肌细胞观察与鉴定。
1.4 心痛舒含药血清制备及其对心肌细胞的细胞毒性检测
参照 《药理实验方法学-新技术与新方法》[7]258中药物血清的制备方法。 取SD大鼠20只,雌雄各半,依据临床常用量按实验动物与人体表面积折算的等效剂量比值换算[7]258,利用mg/kg折算mg/m2转换因子进行计算,大鼠每只用量为:6.42 g/(kg·d)灌胃,每天2次,连续3 d;空白组予等量生理盐水灌胃。末次给药1 h后颈总动脉取血,分离血清,灭活后-20℃保存备用。噻唑蓝(MTT)比色法检测含药血清对乳鼠心肌细胞活力的影响,以对心肌细胞抑制率最小的含药血清浓度作为下一步实验的工作浓度。
1.5 心肌细胞H/R模型建立
参照 《药理实验方法学》[8]进行。配制低糖DMEM培养基,加入青链霉素双抗,不加血清;将培养基用高纯氮气充分饱和30min,流量为1 L/min,使培养液氧分压降至4 KPa;将上述饱和后的培养基快速置换细胞培养瓶内的原培养基;将细胞培养瓶置入塑料袋内,充满氮气,37℃密闭;1 h后收集上清液,将培养基换为DMEM培养基,加新培养液,复氧2 h,收集上清液。
1.6 分组与处理
随机分为4组。正常组:在完全培养基中加入10%大鼠正常血清,连续常规培养24 h;模型组:缺氧1 h,复氧2 h;阳性对照组:培养液中加入50mg/L的心脑舒通胶囊 (吉林敖东制药,批号:20100207,15mg)(GSTT)后予缺氧 1 h,复氧 2 h;心痛舒含药血清预处理组(心痛舒组):培养液中加入10%心痛舒含药血清后予缺氧1 h,复氧2 h。MTT检测时按药物血清梯度浓度分7组,检测后选择了10%浓度组为下一步实验浓度。
1.7 观察指标
1.7.1 罗丹明染色法观察心肌细胞形态 罗丹明B染色后在倒置显微镜下观察各组心肌细胞形态学变化并摄像(观察其搏动、形状、折光率等)。罗丹明染色步骤:用DMSO配制1mg/mL的罗丹明B液;将96孔板内的培液吸出,用PBS清洗;每孔加入200 μL的 PBS, 再加入 4 μL的罗丹明 B液;573 nm荧光下激发3min,然后拍照。
1.7.2 ELISA法检测 TNF-α、IL-1β的含量 取培养上清液以ELISA法检测炎症因子TNF-α、IL-1β含量。具体步骤如下:用包被缓冲液稀释包被抗原至最适浓度(5~20 μg/mL)各 0.3 mL 加于微反应板每个凹孔中,37℃水浴2~3 h,4℃贮存;移去包被液,凹孔用洗涤缓冲液(含0.05%吐温-20)洗涤;每凹孔加入用稀释缓冲液稀释的受检上清液各0.2 mL,37 ℃,作用 1~2 h;洗涤;加入酶结合物辣根过氧化物酶羊抗兔IgG:每凹孔加入稀释缓冲液稀释的酶结合物0.2 μL。37℃作用1~2 h;洗涤;加入邻苯二胺溶液0.2 μL底物溶液于每个凹孔,室温作用 30min;每凹孔加 2M H2SO40.05 μL;用酶联免疫检测仪记录490 nm处测量各孔A值。
1.7.3 RT-PCR法检测NF-κBp65 mRNA表达水平RT-PCR按说明书操作。NF-κBp65 mRNA引物(上海生物工程技术服务公司,中国),设计参考文献[9]。
上游引物:5'-AAGATCAATGGCTACACAGG-3',下游引物:5'-CCTCAATGTCTTCTTTCTGC-3'(GI:M61909,产物长度493bp,Tm:55.75℃ )β -actin, 正义链:5'-GTAGCCATCCAGGCTGTCTT-3',反义链:5'-CAGTGAGGCCAGGATAGAGAC-3',(GI:NM031144,产物长度 648bp,Tm:56.5℃)。
PCR产物相对量=PCR产物电泳条带面积积分吸光度/β-actin电泳条带面积积分吸光度。用美国BioRad公司Quantity One V4.5软件分析。
1.8 统计学分析
采用SPSS 13.0软件进行统计分析,数值变量资料以“”表示,采用单因素方差分析,以 P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化鉴定心肌细胞及含药血清工作浓度的确定
倒置显微镜下观察见心肌细胞通过伪足细胞相互交织成网,渐形成细胞簇,搏动规则、有力(图1①);免疫组化染色鉴定结果显示心肌细胞呈强阳性(图1②),纯度可达95%以上;阴性对照组呈阴性(图 1③)。

用MTT比色法检测乳鼠心肌细胞活力,结果显示,当药物血清浓度在低于10%时无细胞毒性,在15%以上时有细胞毒性,故取无细胞毒性的10%浓度,见表1。
表1 心痛舒对心肌细胞的毒性测定结果 (,n=5)
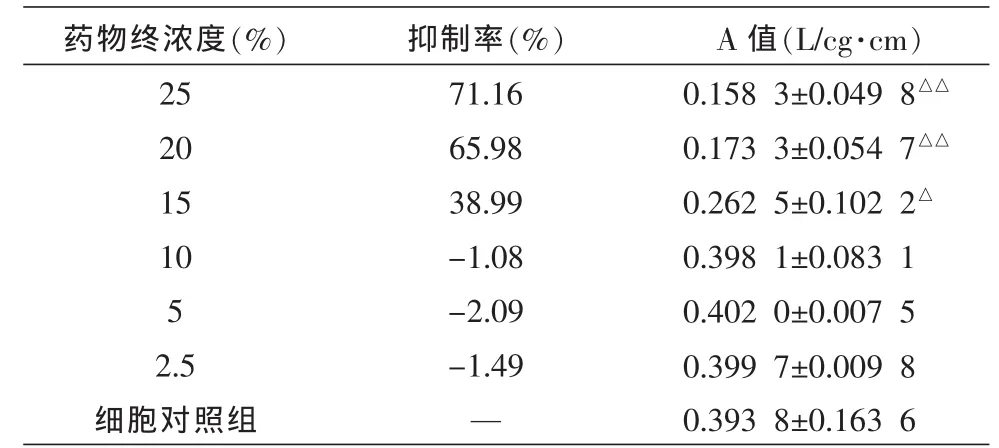
表1 心痛舒对心肌细胞的毒性测定结果 (,n=5)
注:与细胞对照组比较△P<0.05,△△P<0.01。
药物终浓度(%)2520151052.5细胞对照组抑制率(%)71.1665.9838.99-1.08-2.09-1.49—A 值(L/cg·cm)0.1583±0.0498△△0.1733±0.0547△△0.2625±0.1022△0.3981±0.08310.4020±0.00750.3997±0.00980.3938±0.1636
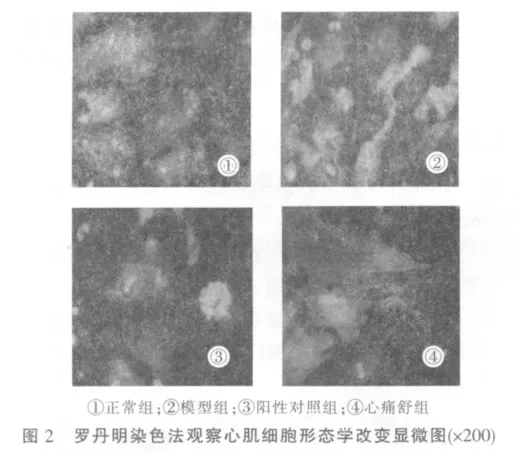
2.2 各组心肌细胞形态学观察
正常组细胞形状多样化,呈圆形、梭型及锥型,胞浆突起呈枝芽状,向细胞簇周围呈放射状生长,折光性强。缺氧复氧损伤后,胞体折光性下降,细胞形态极不规则,细胞变形,出现大量碎片。阳性对照组心肌细胞形状较规则,细胞生长欠佳,碎片较多。心痛舒组心肌细胞形状较规则,细胞生长尚可,碎片明显较少,心肌细胞形态较缺氧/再复氧组明显改善。见图2。
2.3 各组TNF-α、IL-1β含量变化
与正常组比较,H/R组培养液上清TNF-α、IL-1β水平明显升高,差异有统计学意义(P<0.01);与H/R组比较,阳性对照组、心痛舒组可明显降低TNF-α、IL-1β(P<0.01)。 阳性对照组与心痛舒组比较无统计学意义。见表2。
表2 心痛舒含药血清预处理对乳鼠心肌细胞H/R损伤后 TNF-α、IL-1β 水平的影响(,n=8,ng/mL)
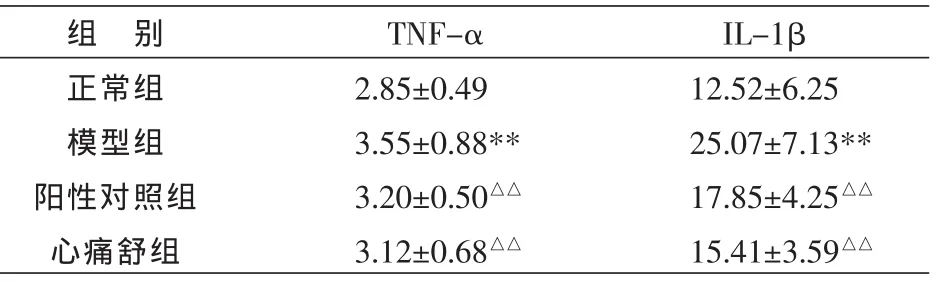
表2 心痛舒含药血清预处理对乳鼠心肌细胞H/R损伤后 TNF-α、IL-1β 水平的影响(,n=8,ng/mL)
注:与正常组比较**P<0.01;与模型组比较△△P<0.01。
组 别正常组模型组阳性对照组心痛舒组TNF-α 2.85±0.493.55±0.88**3.20±0.50△△3.12±0.68△△IL-1β 12.52±6.2525.07±7.13**17.85±4.25△△15.41±3.59△△
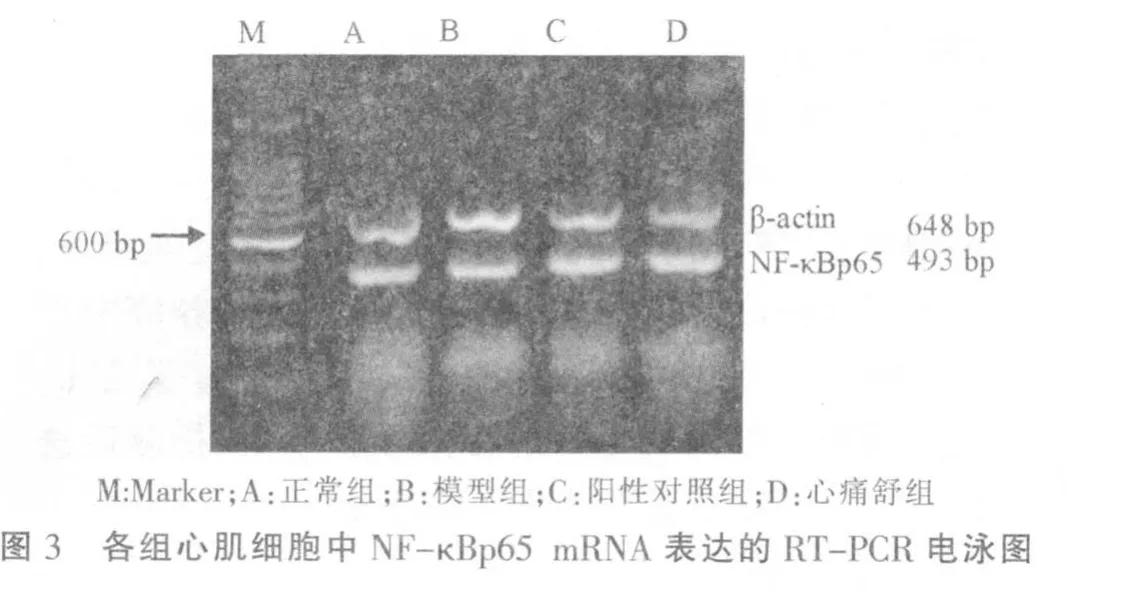
2.4 各组NF-κBp65 mRNA表达的比较
与正常组比较,模型组NF-κBp65 mRNA表达增高,差异有统计学意义(P<0.01);与模型组比较,阳性对照组、心痛舒组NF-κBp65 mRNA表达降低,差异有统计学意义(P<0.01)。心痛舒组与阳性对照组比较,NF-κBp65 mRNA 表达显著降低(P<0.05)。见表3,图3。
表3 各组心肌细胞中NF-κBp65 mRNA表达 (,n=8)
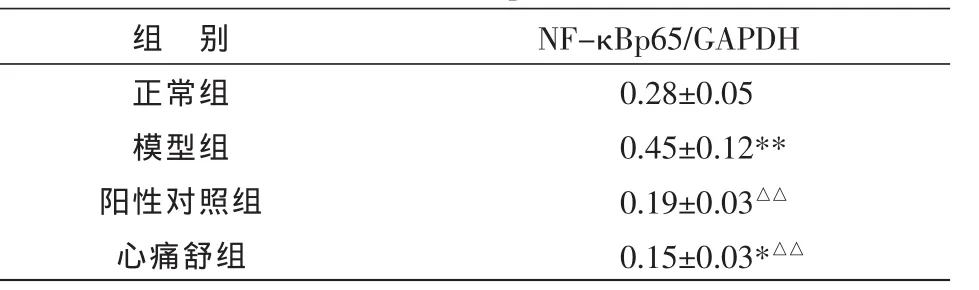
表3 各组心肌细胞中NF-κBp65 mRNA表达 (,n=8)
注:与正常组比较 **P<0.01;与模型组比较△△P<0.01;与阳性对照组比较*P<0.05。
组 别正常组模型组阳性对照组心痛舒组NF-κBp65/GAPDH 0.28±0.050.45±0.12**0.19±0.03△△0.15±0.03*△△
3 讨论
中药复方或有效成分可通过调节炎症因子的表达,从而参与抑制IRI的炎性损伤过程。其中NF-κB是一种重要的炎性调节因子。研究发现[10]NF-κB作为一种转录因子,可调节多种炎症相关蛋白基因的表达,参与MI/R的炎症反应。TNF-α、IL-1β是重要的炎性细胞因子,TNF-α作用于心肌细胞和内皮细胞,诱导产生细胞间黏附分子,促使中性粒细胞黏附而介导缺血/再灌注损伤[11]。IL-1β通过多种机制参与了缺血再灌注损伤过程[12]。缺血再灌注损伤中的氧化应激刺激可激活NF-κB,而活化的NF-κB又可导致诸多炎性介质如TNF-α、IL-1β的过度表达。因此,影响NF-κB的活性则可在转录水平影响多种炎性介质的转录,从而对组织的再灌注损伤产生影响。抑制NF-κB信号通路可能对于再灌注损伤具有潜在的治疗价值[13]。心痛舒是课题组在大量临床实践的基础上创立而成,是临床防治缺血性心脏病的有效方剂,全方由丹参、檀香、赤芍、川芎、当归、红花、生地黄等组成,具有活血祛瘀、行气止痛之功效。我们前期实验研究显示[14-20]心痛舒可通过诱导腺苷、降钙素基因相关肽及一氧化氮合酶等内源性触发物质的释放增多,促进蛋白激酶C活性增强及影响NF-κB蛋白表达,对缺血再灌注损伤心肌有明显的延迟保护作用,心痛舒预处理后,能显著减少家兔缺血再灌注损伤心肌的缺血面积和梗死面积。因此推测,心痛舒可通过抑制炎症因子TNF-α、IL-1β的上游调控NF-κB p65基因转录系统并抑制炎症反应,对缺氧复氧损伤心肌细胞起保护作用。
本研究采用体外培养心肌细胞,造成心肌细胞缺氧-复氧病理模型,模拟体内缺血再灌注样损伤,不仅避免了体内神经、体液等诸多因素的影响,而且也避免了整体动物模型的不稳定性,加强了模型的均一性,较能准确地反应受试药物对细胞模型的干预作用。本研究发现,正常培养条件下,心肌细胞培养基中 TNF-α、IL-1β水平均较低,H/R刺激使TNF-α、IL-1β含量均明显增加,提示炎症因子TNF-α、IL-1β是缺氧复氧损伤的重要因素,加重了心肌细胞功能障碍。心痛舒含药血清预处理能抑制NF-κBp65活性,降低 NF-κB p65mRNA 表达,减少炎症因子TNF-α、IL-1β生成,抑制炎症反应,从而对缺氧复氧损伤心肌细胞起保护作用,这可能是心肌缺氧/复氧损伤耐受性产生的重要分子机制之一。本研究提示心痛舒可通过抑制NF-κB激活,使下游炎性细胞因子表达下调,从而抑制缺氧/复氧导致的心肌细胞炎性损伤。
[1]郭双平,王文亮,翟宇强.核转录因子NF-κB的研究进展[J].中华病理学杂志,2000,29(5):379-380.
[2]金 戈,陈 珊,单 江.大鼠心肌缺血缺氧损伤核转录因子-κB与细胞间黏附分子-1的表达[J].毒理学杂志2005,6(2):120-122.
[3]黄政德,李鑫辉,张少泉,等.益气活血法对血瘀证兔缺血再灌注心肌细胞核因子KB蛋白表达影响[J].2008,26(8):1629-1631.
[4]黄政德,王庆高,刘东亮,等.加味丹参饮预处理对心肌细胞内钙超载的延迟保护作用[J].湖南中医药大学学报,2007,27(2):37-39.
[5]黄政德,葛金文,张玉生.加味丹参饮预处理对缺损伤家免心电图改变血再灌注的影响[J].湖南中医药导报,2003,9(11):56-58.
[6]黄政德,葛金文,张玉生.加味丹参饮预处理对缺血再灌注损伤家兔心功能的影响[J].湖南中医学院学报,2003,23(6):4-6.
[7]刘建文.药理实验方法学——新技术与新方法[M].北京:化学工业出版社,2003:258.
[8]徐淑云,卞如濂.药理实验方法学(第2版)[M].北京:人民卫生出版社,2002:45.
[9]Kraus J, Oschmann P, Leis S, et a1.High concentra-tions of sVCAM-1 and sICAM-1 in the cerebrospinal fluid of patients with intracerebral hemorrhage are associated with poor outcome[J].J Neurot Neurosurg Psychiatry,2002,73(3):346-347.
[10]Sehmidt K N, Traenckner E B M, Meier B, et a1.Induction of oxida-tire stress by odadaic acid is required for activation of transcription factor NF-κB[J].J BiolChem,1995,270(45):7136-7142.
[11]Bevillacqua M P.Endothelial-leukocyte adhesionmoLecules[J].Annu Rev Immunol,1993,55(1):768-804.
[12]殷惠军,王显刚,史大卓.蒺藜总皂苷对缺氧复氧心肌细胞NF-κB核移位及其调控下游基因表达的影响[J].现代中西医结合杂志,2006,15(1):11-13.
[13]孙图成,蒋雄刚,张凯伦,等.NF-κB激活对缺血再灌注心肌TNF-α和IL-1β表达的影响[J].华中科技大学学报(医学版),2009,38(6):752-759.
[14]黄政德,李鑫辉,张少泉,等.益气活血法对血瘀证兔缺血再灌注心肌细胞核因子KB蛋白表达影响[J].2008,26(8):1629-1631.
[15]李世兵,黄政德,邓奕辉.加味丹参饮对麻醉犬冠脉血流量及阻力影响[J].湖南中医杂志,2006,22(4):77-78.
[16]李世兵,黄政德,廖 菁.加味丹参饮对犬冠状动脉血流量和动静脉血氧饱和度及血氧含量的影响 [J].湖南中医药大学学报,2006,10(5):18-20.
[17]易刚强,黄政德,邓红霞.加味丹参饮对麻醉犬心肌缺血及相关血液生化指标的影响[J].湖南中医学院学报,2006,26(3):9-11.
[18]王庆高,黄政德,肖 健,等.加味丹参饮预处理对乳鼠缺氧/复氧心肌细胞的延迟保护作用及对蛋白激酶C的影响[J].中西医结合心脑血管病杂志,2007,10(10):953-955.
[19]王庆高,李成林,卢健棋,等.加味丹参饮预处理诱导大鼠心肌细胞HSP70mRNA的表达[J].环球中医药,2009,2(2):102-105.
[20]廖 菁,黄政德,胡 华,等.加味丹参饮对大鼠实验性心肌缺血损伤的抗凝血作用研究 [J].中国中医药信息杂志,2009,16(1):44-46.
Effects of preconditioning with serum containing Xintongshu on the newborn rat's myocardial cells with hypoxia and reoxygenation injury and the expression of TNF-αand IL-1β
REN Ting1,HUANG Zheng-de2,TIAN Xue-fei3,CHEN Chu-tao4
(1.Medical College,TCM University of Hunan, Changsha, Hunan 410208,China;2.First TCM Clinical College,TCM University of Hunan, Changsha, Hunan 410007,China;3.College of Integrated Chinese and Western Medicine,TCM University of Hunan,Changsha,Hunan 410208,China;4.Postgraduate Department,TCM University of Hunan,Changsha,Hunan 410208,China)
Xintongshu;myocardial cell;inflammatory cytokines;NF-κB p65;TNF-α;IL-1β;newborn rat;mechanism of iaction
R285.5
A
10.3969/j.issn.1674-070X.2012.11.003.011.05
〔Absrract〕Objective To observe the regulating effects of preconditioning with serum containing Xintongshu on the expression of nuclear factor-κBp65(NF-κBp65),tumor necrosis factor-α(TNF-α)and interleukin-1β(IL-1β),and to explore the protective mechanism of Xintongshu on the hypoxia and reoxygen injury myocardial cell model of newborn rat. Methods The myocardial cells were isolated from neonatal rats and cultured,then modelled with hypoxia andreoxygenation injury.The modeled myocardial cells were randomly divided into four groups,including normal control group,model control group,positive control group and preconditioning group treated with serum containing Xintongshu (Xintongshu group).The myocardial cell morphologic changes were observed by Rhodamine B stain.The TNF-α and IL-1β proteinsin culture media were detected by ELISA and the mRNA expression level of NF-κBp65 was detected by RT-PCR.Results Compared with model control group,the expression levels of TNF-α and IL-1β proteins and NF-κBp65 mRNA in positive control group and Xingtongshu group were decreased.There were statistical differences (P<0.01).Compared with positive control group,the expression levels of NF-κBp65 mRNA in Xingtongshu group were statistically decreased (P<0.05).Conclusion The preconditioning with serum containing Xintongshu can exert a protective effect by inhibiting the inflammatory reaction pathway of the hypoxia and reoxygenation myocardial cells.The effect may be related to the decrease of the NF-κB p65 mRNA expression level and further inhibition of thegeneration of inflammatory cells.
2012-09-20
国家自然科学基金资助项目(30973750);湖南省教育厅重点科研项目(09A071);湖南省重点学科中医内科学资助项目。
任 婷(1983-),女,湖南湘潭人,硕士研究生,讲师,主要从事心血管疾病的中医药防治研究。
* 黄政德,男,教授,博士研究生导师,E-mail:Hzd112@163.com。
(本文编辑 徐爱良)

