人工饲养中国猕猴中SRV、STLV和BV的流行病学调查
朱 林, 韩建保, 张喜鹤, 马建平, 吕龙宝, 张高红, 郑永唐1,,*
(1. 中国科学院和云南省动物模型与人类疾病机理重点实验室,中国科学院昆明动物研究所,云南 昆明 650223;
2. 中国科学院昆明灵长类研究中心,中国科学院昆明动物研究所, 云南 昆明 650223; 3.中国科学院研究生院, 北京 100049)
人工饲养中国猕猴中SRV、STLV和BV的流行病学调查
朱 林1,3,#, 韩建保1,#, 张喜鹤1,3, 马建平1,3, 吕龙宝2, 张高红1,*, 郑永唐1,2,*
(1.中国科学院和云南省动物模型与人类疾病机理重点实验室,中国科学院昆明动物研究所,云南 昆明650223;
2.中国科学院昆明灵长类研究中心,中国科学院昆明动物研究所,云南 昆明650223; 3.中国科学院研究生院,北京100049)
非人灵长类动物是十分重要的生物医学资源。由于与人类在生理生化、免疫、遗传等方面近似, 猕猴是重要的非人灵长类实验动物之一。然而, 猕猴作为自然宿主, 易感染D型逆转录病毒 (simian type D retrovirus,SRV)和T淋巴细胞白血病病毒(simian T lymphotropic virus,STLV)这两种逆转录病毒, 并可能会影响AIDS猕猴动物模型等的研究结果。猴B病毒(ceropithecine herpesvirus 1,BV)对猕猴及动物从业人员均有危害。云南省拥有较大规模的中国猕猴繁殖种群。基于以上原因, 建立SPF级别的中国猕猴种群十分必要。该文应用PCR技术筛查了人工饲养种群中411只中国猕猴的SRV、STLV和BV感染流行情况。结果表明: SRV、STLV和BV的阳性感染率分别为19.71% (81/411)、13.38% (55/411)和23.11% (95/411)。同时比较分析了不同性别及年龄组中国猕猴的病毒感染情况。该研究将有助于建立SPF级别的中国猕猴繁殖种群。
SRV; STLV; 猴B病毒; 中国猕猴; 流行病学调查
非人灵长类(non-human primates, NHP)动物是生物医学研究中不可替代的重要资源, 被广泛应用于人类疾病的模型研究、疫苗与药物的临床前评价,是研究HIV感染、免疫和病理的首选动物模型(Lackner & Veazey, 2007)。云南省有着丰富的非人灵长类动物资源, 人工饲养繁殖的非人灵长类动物主要包括中国猕猴、食蟹猴和北平顶猴等。然而, 中国猕猴作为天然宿主, 较易感染猴D型逆转录病毒(simian type D retrovirus,SRV)与猴T淋巴细胞白血病病毒(simian T lymphotropic virus,STLV)这两种逆转录病毒以及对人有致死性危害的B病毒(ceropithecine herpesvirus 1,BV)。SRV属于逆转录病毒科正逆转录病毒亚科β逆转录病毒属, 目前有7种血清型。SRV是猴艾滋病(AIDS)的致病因子之一。STLV属于逆转录病毒科正逆转录病毒亚科δ逆转录病毒属, 该病毒与HTLV-1有很多相似性。感染SRV与STLV的猕猴对于诸如建立猕猴的AIDS动物模型的研究会掺加不必要的混杂因素,进而影响实验结果。BV又称为猴疱疹病毒1型,属于疱疹病毒科疱疹病毒亚科单纯疱疹病毒属。感染BV的宿主主要是猕猴与食蟹猴, 以及平顶猴等猕猴属动物, 宿主感染BV的案例也见有报道(Weigler, 1992)。然而, 通过病毒基因组序列比较以及RFLP分析的结果表明, 在感染BV的不同宿主中, 从猕猴体内分离得到的BV毒株对人的致病性最高(Smith et al, 1998)。来源猕猴的BV感染人的案例时有报道(Davenport et al, 1994)。B病毒对人的高致死率会对从事动物实验的相关人员造成的潜在危害(Cohen et al, 2002; Krug et al, 2009)。因此, 对人工饲养繁殖的猕猴开展BV的检测对于相关动物从业人员的生命健康具有十分重要的意义。
猕猴感染SRV、STLV-1和BV后常表现为潜伏感染, 很难观察到临床症状。与此同时, 由于血清学常规检测技术存在灵敏性低的缺点, 对人工饲养繁殖中国猕猴群体中的SRV、STLV和BV的感染状况并不十分准确。基于上述原因,作者论文采用较血清学检测更为敏感的PCR方法, 调查分析了来源于中国科学院昆明动物研究所灵长类研究中心的411只人工饲养繁殖的中国猕猴中上述3种病毒的感染状况及其在年龄及性别分布的差异。对于人工饲养繁殖的中国猕猴种群进行定期的病毒感染情况的流行病学调查, 将会极大地有助于建立SPF级别的中国猕猴种群, 从而满足诸如中国猕猴AIDS模型等生物医学研究的需要。
1 材料与方法
1.1 实验材料
1.1.1 样品来源 血液样品采自中国科学院昆明灵长类研究中心人工饲养的411只中国猕猴(SCXK滇2008-0001), 其中雌性为230只, 雄性为181只。实验样品中幼年组、成年组和老年组中猕猴的数量分别为188、211和2只。采用室内异笼饲养的方式, 采样时间为2010年年末。
1.1.2 仪器与试剂 高速冷冻离心机(Centrifuge 5417R, Eppendorf, 德国)、涡旋震荡仪(Vortex Genius 3, IKA, 德国 )、 PCR仪(DNA Engine Peltier Thermal Cycler, Bio-Rad, 美国)、电泳槽(北京六一仪器厂, 中国)和凝胶成像仪(ChemiDoc XRS System, Bio-Rad, 美国) 和等仪器。Gentra Puregene Kit(QIAGEN, 德国)和Premix Taq Version 2.0(loading dye mix)(Takara, 日本)试剂。
1.2 实验方法
1.2.1 基因组DNA提取 中国猕猴血液样品基因组DNA提取参照QIAGEN 公司Gentra Puregene Kit推荐方法进行, 提取的基因组DNA置−20 ℃保存备用。
1.2.2 PCR检测SRV、STLV和BV 为了减少PCR操作过程中可能的污染, 实验采用Premix Taq 进行PCR反应, 反应体系如下:2 μL模板DNA, 25 μL Premix Taq, 20 μmol/L的正向与反向引物各为1μL,补加灭菌超纯水至50 μL。SRV检测参照Lerche et al (1997)和Lerche et al (2001)的方法; STLV的检测参照Voevodin et al (1996)的方法; B病毒的检测参照Miranda et al (2005)的方法。Rhesus β-globin作为内参。Premix Taq中含有电泳时所必需的色素试剂,反应结束后, 直接将PCR扩增产物在含有溴化乙锭(EB)的琼脂糖凝胶中电泳, 然后在凝胶成像仪中检测。
1.2.3 绘图与数据处理 实验操作完成后, 用SigmaPlot 5.0及SPSS 13.0进行数据分析与图像处理, 采用Fisher’s 确切检验作为统计方法,P<0.05为显著性统计学差异。
2 结 果
2.1 SRV、STLV和BV三种病毒PCR检测的电泳图谱
以基因组DNA为模板, 用SRVgag引物对其进行巢氏PCR扩增。外引物对其进行第1轮扩增。然后, 以第1轮产物为模板, 用内引物对其进行巢氏PCR第2轮扩增, SRV的PCR产物片段长度为222 bp (图1)。

图1 PCR检测猕猴PBMC中SRV病毒DNAFig. 1 Detection of the SRV DNA in PBMC of rhesus macaque by PCR
以基因组DNA为模板, 用BV DPOL基因特异性引物对其进行PCR扩增, PCR产物片段长度为356 bp (图2)。

图2 PCR检测猕猴PBMC中BV病毒DNAFig. 2 Detection of the BV DNA in PBMC of rhesus macaque by PCR
以基因组DNA为模板, 用STLVenv基因特异性引物对其进行巢氏PCR扩增。外引物对其进行第1轮扩增。然后, 以第1轮产物为模板, 用内引物对其进行巢氏PCR第2轮扩增, PCR产物片段长度为215 bp(图3)。

图3 PCR检测猕猴PBMC中STLV病毒DNAFig. 3 Detection of the STLV DNA in PBMC of rhesus macaque by PCR
2. 2 不同年龄组中国猕猴感染SRV、STLV 和BV的检测结果
如表1 所示, 感染SRV、STLV和BV的中国猕猴阳性样品数分别为81、55和5份, 阳性感染率分别为19.71%、13.38%和23.11%。3种病毒在幼年组(1~3岁)中的阳性感染率均高于成年组(4~10岁)中的阳性感染率。SRV在老年组(11岁以上)中的阳性感染率高于幼年组与成年组,P=0.211>0.05,无显著性差异。STLV在成年组中的阳性感染率低于幼年组与老年组,P=0.009<0.05, 有显著性差异。BV在3个年龄组中的阳性感染率较为接近,P=0.261>0.05, 无显著性差异。
感染SRV的中国猕猴主要集中在8~9岁与13~16岁。感染STLV的中国猕猴多集中于3~4岁。感染BV的中国猕猴主要集中6岁(图4)。
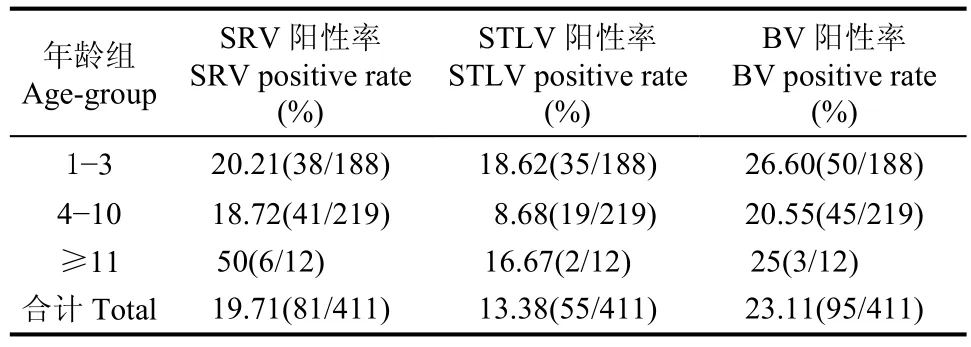
表1 不同年龄组的中国猕猴SRV、STLV 和BV的感染率Tab. 1 The infection rate of SRV, STLV and BV in different age-group of Chinese rhesus macaque
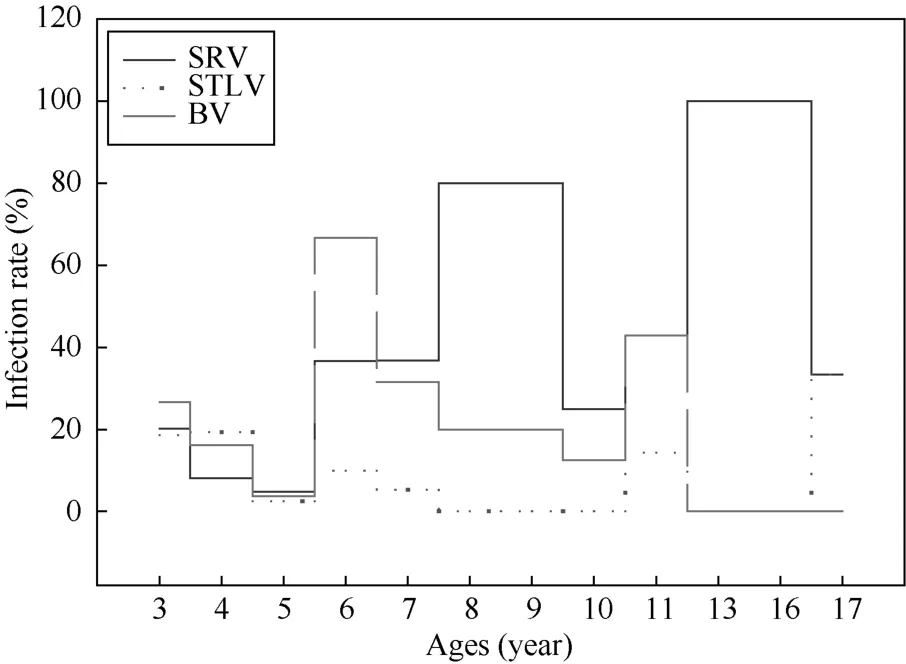
图 4 感染SRV、STLV和BV的中国猕猴的年龄分布图Fig. 4 The histogram of age distribution of Chinese rhesus macaque infected with SRV, STLV and BV
2.3 不同年龄组的雄性/雌性中国猕猴SRV、STLV和BV的检测结果
如表2所示, 3种病毒在雄性幼年组(1~3岁)中的阳性感染率均高于雄性成年组(4~10岁)中的阳性感染率, SRV的雄性阳性感染率在组间差异较大,P=0.002<0.05, 有显著性差异; BV的雄性阳性感染率在组间差异较大,P=0.002<0.05, 有显著性差异; STLV雄性阳性感染率的组间差异较小,P=0.071>0.05, 无显著性差异。SRV与STLV在雌性幼年组(1~3岁)中的阳性感染率均高于雌性成年组(4~10岁)中的阳性感染率。BV在雌性幼年组(1~3岁)中的阳性感染率低于雌性成年组(4~10岁)中的阳性感染率。SRV的雌性阳性感染率在组间差异较小,P=0.861>0.05, 无显著性差异; STLV雌性阳性感染率的组间差异较小,P=0.028<0.05, 有显著性差异; BV雌性阳性感染率的组间差异较小,P=0.769>0.05, 无显著性差异。
2.4 中国猕猴共感染SRV、STLV和BV的检测结果
如表3所示, 在检测到SRV/STLV、SRV/BV和STLV/BV共感染的中国猕猴中, SRV/BV的共感染率较高, 阳性感染率为9.25%, 共感染之间的差异性有统计学意义,P=0.000<0.05。3种病毒均呈阳性的仅有1例。

表2 不同年龄组的雄性/雌性中国猕猴SRV、STLV和BV的感染率Tab. 2 The infection rate of SRV, STLV and BV in different age-group of male Chinese rhesus macaque

表3 中国猕猴SRV、STLV和BV的共感染率Tab. 3 The co-infection rate of SRV, STLV and BV in Chinese rhesus macaque
3 讨 论
SRV可存在于唾液、尿液、血液、泪液、脑脊液及乳汁中。SRV主要经由唾液进行传播(Lerche et al, 1987), 表现为群体间进行毛发整理以及撕咬等行为方式。母婴传播也是传播途径之一(Tsai et al, 1990)。因此, 检测人工饲养的猕猴繁殖群中雌性猕猴的SRV阳性感染率对于建立SPF级别的猕猴群体而言具有重要的意义。在此次检测的411份样品中, 雌性猕猴的SRV阳性感染率为10.71%。血清学调查显示, 人工饲养的猕猴群体中SRV的阳性感染率有较大差异(Lerche et al, 1987; Chen et al, 1992)。Zhou et al (1999)对云南省野生猕猴进行的血清流行病学调查的数据表明, SRV的感染率为4.7%,低于人工饲养的猕猴群体中SRV的阳性感染率。然而, SRV的血清学调查在检测方法上有其局限性。部分宿主在感染SRV后, 能够长期持续病毒外排而血清检测为阴性(Moazed & Thouless, 1993; Lerche et al, 1987)。因此, 血清学调查会遗漏这些已经感染SRV的宿主, 从而导致病毒在携带病毒的宿主中持续存在, 影响整个繁殖群体。Western Blot作为血清学调查结果的确证实验时, 应同时检测至少1个Gag蛋白(p24, p27)和1个Env蛋白(gp20, gp70), 2种蛋白同时为阴性时, 可确认为SRV阴性。Li et al (1999)用Western Blot的方法对来源于云南省思茅县竹林乡的41只野生中国猕猴作了SRV血清抗体检查。其中, 9只确定为阳性的猕猴血清中有gp20,所筛查研究的41只动物中均未见gp70和p27的。与此相反, Chen et al (1992)的Western Blot结果表明, SRV阳性的中国猕猴血清中有p27而无gp20与gp70。这可能与感染SRV的亚型有关。值得注意的是, 宿主感染SRV不等同于具有传播病毒的能力,这是因为, 一部分猕猴体内的抗体能够有效地中和病毒(Wilkinson et al, 2003)。因此, 在任何情况下, PCR检测结果为阳性的宿主都应当被认为是建立SPF级别种群的威胁之一。近年来, Real-Time PCR在SRV前病毒检测以及基因分型研究中体现了更高的灵敏性与准确性(White et al, 2009)。因此, 整合血清学调查与PCR检测这两种方法将会提高猕猴群体感染SRV的诊断率。
对野生状态的平顶猴和食蟹猴的血清学调查显示, STLV感染率分别为13.3%和5.3% (Richards et al, 1998; Schillaci et al, 2005)。野生宿主较低的感染率使得从人工饲养猕猴种群中去除STLV较为容易。成熟STLV病毒粒子多为细胞内病毒, 游离病毒较少(Gabet et al, 2003)。由于体液中游离病毒较少, 相应会减少STLV在人工饲养猕猴中的传播几率(Parrish et al, 2004)。STLV多经由性传播的方式进行传播, 包括精液与宫颈分泌液, 也可通过母婴传播。在狒狒群体中的研究表明, STLV主要在雌性狒狒中传播, 这可能是由于狒狒在打斗撕咬时, 口腔黏膜暴露于感染STLV的狒狒的血所致(d'Offay et al, 2007)。我们此次调查的数据显示, 老年雌性中国猕猴年龄组的STLV阳性感染率为0%, 幼年组阳性感染率为11.70%, 显著高于成年组的阳性感染率。Li et al (2000)对537 只来源于云南、贵州和四川3省的野生猕猴, 365 只来源于云南省灵长类中心的繁殖猕猴以及44只SRV阳性猕猴作了STLV血清抗体检查, 结果表明, 10 岁以上猕猴的STLV抗体阳性率为15.5% , 高于10 岁以下的阳性感染率(6.2%); 雌猴的STLV抗体阳性率为17.5%, 高于雄猴的阳性感染率(5%); SRV阳性猕猴的STLV抗体阳性率为34.1% , 高于野生猕猴(8.8%)。我们此次的调查结果表明, 老年组(11岁以上)猕猴的STLV阳性率为16.67% , 高于成年组(4~10岁)的阳性感染率(8.68%), 与幼年组(1~3岁)的阳性率接近。雌猴的STLV阳性率为7.79%, 高于雄猴的阳性感染率(5.6%)。共感染SRV/STLV的比率较低(1.7%)。我们的结果与之相比, 在感染STLV的猕猴在性别与年龄上的分布趋势上近似。Rao et al (2004)的结果也表明, 成年后的猕猴随着年龄的增长, 感染STLV的阳性率也随之升高。猕猴等宿主从感染STLV到血清阳转的时间从几个月至几年不等(Liška et al, 1997)。因此, 在对STLV进行血清学调查时, 应考虑到STLV的这种特点。PCR可以检测PBMC中的STLV前病毒(Meertens et al, 2001), 这对于血清学调查是十分有效的补充。此外, Real-Time PCR在检测慢性感染期的STLV前病毒载量时有较高的灵敏性(Souquière et al, 2009)。
BV的传播方式主要通过性接触以及撕咬与梳理毛发等口腔接触暴露的方式进行传播(Weigler et al, 1995)。Zhou et al (1999)对云南省野生猕猴进行的血清流行病学调查的数据表明, BV感染率为44.6%。Liu et al (2007)对来源于广东省某一猴场的629血清样本进行了检测, 其中11周岁猕猴的BV感染率89%, 青年猴(3~10周岁)BV感染率39.2%,幼龄猴(2周岁)BV感染率7.6%。随着年龄的增长,猕猴种群中BV感染率越高。血清学调查研究表明,成年猕猴的阳性率为80%~90%, 并且阳性率与年龄呈正相关关系(Weigler et al, 1993)。我们此次调查的数据也反映了上述的趋势, 老年猕猴的阳性感染率25%, 而成年猕猴的阳性感染率20.55%。有趣的是, 此次调查的数据显示幼年猕猴的阳性感染率为26.60%, 高于成年猕猴与老年猕猴的阳性感染率。Kessler & Hilliard(1990)研究表明, 幼年猕猴感染BV的阳性感染率较高, 1岁猕猴的感染率为52%, 2岁猕猴的感染率为65%, 而3岁猕猴的感染率高达100%。值得注意的是, 猕猴感染BV后, 症状不明显。以生殖道为例, 虽然没有观察到疱疹性病变,但是用Real-Time PCR的方法却检测到了病毒的存在(Huff et al, 2003)。BV对人致死性的危害, 使得相关动物从业人员, 应注意自身防护(Cohen et al, 2002)。此次调查也发现存在SRV/STLV、SRV/BV及STLV/BV共感染中国猕猴, 其中SRV/BV的共感染率较高, 阳性感染率为9.25%。3种病毒均为阳性的情况仅有1例。
猕猴携带的人畜共患病不仅对实验动物与动物从业人员的生命健康造成危害, 而且对于疾病动物模型的研究引入不必要的混杂因素。国内以往的研究主要集中于野生中国猕猴感染SRV、STLV与BV的血清流行病学研究。本文运用较血清学检测方法更为敏感的PCR方法对猕猴AIDS相关的2种逆转录病毒SRV和STLV以及对人有致死性危害的BV进行了检测, 研究分析了这3种病毒在中国猕猴不同年龄段与性别分布的差异, 研究结果将对建立适合AIDS研究的中国猕猴种群大有裨益, 同时也将对建立SPF级别的中国猕猴种群具有深远的意义。
致谢:感谢中国科学院昆明灵长类研究中心的工作人员协助采集中国猕猴血液样本。
Chen Z, Ben K, Tian B, Zheng Y. 1992. Serological survey of a captive macaque colony in China for antibodies to simian type Dretroviruses[J]. J Med Primatol,21(7-8): 377-380.
Cohen JI, Davenport DS, Stewart JA, Deitchman S, Hilliard JK, ChapmanLE, B Virus Working Group. 2002. Recommendations for prevention of and therapy for exposure to B virus (Cercopithecine herpesvirus 1)[J]. Clin Infect Dis,35(10): 1191-1203.
Davenport DS, Johnson DR, Holmes GP, Jewett DA, Ross SC, Hilliard JK. 1994. Diagnosis and management of human B virus (Herpesvims simiae) infections in Michigan[J]. Clin Infect Dis,19(1): 33-41.
d'Offay JM, Eberle R, Sucol Y, Schoelkopf L, White MA, Valentine BD, White GL, Lerche NW. 2007. Transmission dynamics of simian T-lymphotropic virus type 1 (STLV1) in a baboon breeding colony: predominance of female-to-female transmission[J]. Comp Med,57(1): 105-114.
Gabet AS, Gessain A, Wattel E. 2003. High simian T-cell leukemia virus type 1 proviral loads combined with genetic stability as a result of cell-associated provirus replication in naturally infected, asymptomatic monkeys[J]. Int J Cancer,107(1): 74-83.
Huff JL, Eberle R, Capitanio J, Zhou SS, Barry PA. 2003. Differential detection of B virus and rhesus cytomegalovirus in rhesus macaques[J]. J Gen Virol,84(Pt 1): 83-92.
Kessler MJ, Hilliard JK. 1990. Seroprevalence of B virus (Herpesvirus simiae) antibodies in a naturally formed group of rhesus macaques[J]. J Med Primatol,19(2): 155-160.
Krug PW, Schinazi RF, Hilliard JK. 2009. Inhibition of B virus (Macacine herpesvirus 1) by conventional and experimental antiviral compounds[J]. Antimicrob Agents Chemother,54(1): 452-459.
Lackner AA, Veazey RS. 2007. Current concepts in AIDS pathogenesis: insights from the SIV/macaque model[J]. Annu Rev Med,58(1): 461-476.
Lerche NW, Cotterman RF, Dobson MD, Yee JL, Rosenthal AN, Heneine WM. 1997. Screening for simian type-D retrovirus infection in macaques, using nested polymerase chain reaction[J]. Lab Anim Sci,47(3): 263-268.
Lerche NW, Marx PA, Osborn KG, Maul DH, Lowenstine LJ, Bleviss ML, Moody P, Henrickson RV, Gardner MB. 1987. Natural history of endemic type D retrovirus infection and acquired immune deficiency syndrome in group-housed rhesus monkeys[J]. J Natl Cancer Inst,79(4): 847-854.
Lerche NW, Switzer WM, Yee JL, Shanmugam V, Rosenthal AN, Chapman LE, Folks TM, Heneine W. 2001. Evidence of infection with simian type D retrovirus in persons occupationally exposed to nonhuman primates[J]. J Virol,75(4): 1783-1789.
Li SD, Zhou YM, Duan XS. 1999. Study on detecting SRV serum antibodies in rhesus monkeys by western blot[J]. Chn J Lab Anim Sci,9(2): 1-3. [李绍东,周亚敏,段幸生. 1999.蛋白印迹法检测恒河猴SRV血清抗体的研究[J].中国实验动物学杂志,9(2): 1-3.]
Li SD, Zhou YM, Duan XS. 2000. Sero-epidemiology of STLV-1 in rhesus monkeys[J]. Acta Lab Anim Sci Sin,8(4): 246-250. [李绍东,周亚敏,段幸生. 2000.恒河猴STLV-1血清抗体流行病学研究[J].中国实验动物学报,8(4): 246-250.]
Liška V, Fultz PN, Su LY, Ruprecht RM. 1997. Detection of simian T cell leukemia virus type I infection in seronegative macaques[J]. AIDS Res Hum Retroviruses,13(13): 1147-1153.
Liu XM, Zhang Y, Liu ZH, Zhao WB, Min FG, Wu YE, Pan JC, Huang R. 2007. A survey on infection rate of BV in rhesus monkeys by serologic antibody[J]. Lab Anim Sci,24(4): 33-34. [刘香梅,张钰,刘忠华,赵维波,闵凡贵,吴玉娥,潘金春,黄韧. 2007.恒河猴B病毒血清抗体流行病学调查[J].实验动物科学,24(4): 33-34.]
Meertens L, Rigoulet J, Mauclère P, Van Beveren M, Chen GM, Diop O, Dubreuil G, Georges-Goubot MC, Berthier JL, Lewis J, Gessain A. 2001. Molecular and phylogenetic analyses of 16 novel simian T cell leukemia virus type 1 from Africa: close relationship of STLV-1 from Allenopithecus nigroviridis to HTLV-1 subtype B strains[J]. Virology,287(2): 275-285.
Miranda MB, Handermann M, Darai G. 2005. DNA polymerase gene locus of Cercopithecine herpesvirus 1 is a suitable target for specific and rapid identification of viral infection by PCR technology[J]. Virus Genes,30(3): 307-322.
Moazed TC, Thouless ME. 1993. Viral persistence of simian type D retrovirus (SRV-2/W) in naturally infected pigtailed macaques (Macaca nemestrina)[J]. J Med Primatol,22(7-8): 382-389.
Parrish SWK, Brown AE, Chanbancherd P, Gettayacamin M, Parrish JH. 2004. Transmission of STLV in a closed colony of macaques[J]. Am J Primatol,63(2): 103-109.
Rao JH, Liu XM, Jin SJ, Wang HY, Tian KG. 2004. Preliminary investigation on STLV-1 infection in M. mulatta and M. faseicularis[J]. Lab Anim Sci Manag,21(4): 25-26. [饶军华,刘晓明,金石军,王海英,田克恭. 2004.猕猴、食蟹猴群中STLV-1病毒感染状况的研究[J].实验动物科学与管理,21(4): 25-26.]
Richards AL, Giri A, Iskandriati D, Pamungkas J, Sie A, Rosen L, Anthony RL, Franchini G. 1998. Simian T-lymphotropic virus type I infection among wild-caught Indonesian pig-tailed macaques (Macaca nemestrina)[J]. J Acquir Immune Defic Syndr Hum Retrovirol,19(5): 542-545.
Schillaci MA, Jones-Engel L, Engel GA, Paramastri Y, Iskandar E, Wilson B, Allan JS, Kyes RC, Watanabe R, Grant R. 2005. Prevalence of enzootic simian viruses among urban performance monkeys in Indonesia[J]. Trop Med Int Health,10(12): 1305-1314.
Smith AL, Black DH, Eberle R. 1998. Molecular evidence for distinct genotypes of monkey B virus (Herpesvirus simiae) which are related to the macaque host species[J]. J Virol,72(11): 9224-9232.
Souquière S, Mouinga-Ondemé A, Makuwa M, Hermine O, Kazanji M. 2009. Dynamic interaction between STLV-1 proviral load and T-cell response during chronic infection and after immunosuppression in non-human primates[J]. PLoS One,4(6): e6050.
Tsai CC, Follis KE, Snyder K, Windsor S, Thouless ME, Kuller L, Morton WR. 1990. Maternal transmission of type D simian retrovirus (SRV-2) in pigtailed macaques[J]. J Med Primatol,19(3-4): 203-216.
Voevodin A, Samilchuk E, Schätzl H, Boeri E, Franchini G. 1996. Interspecies transmission of macaque simian T-cell leukemia/lymphoma virus type 1 in baboons resulted in an outbreak of malignant lymphoma[J]. J Virol,70(3): 1633-1639.
Weigler BJ. 1992. Biology of B virus in macaque and human hosts: a review[J]. Clin Infect Dis,14(2): 555-567.
Weigler BJ, Hird DW, Hilliard JK, Lerche NW, Roberts JA, Scott LM. 1993. Epidemiology of cercopithecine herpesvirus 1 (B virus) infection and shedding in a large breeding cohort of rhesus macaques[J]. J Infect Dis,167(2): 257-263.
Weigler BJ, Scinicariello F, Hilliard JK. 1995. Risk of venereal B virus (cercopithecine herpesvirus 1) transmission in rhesus monkeys using molecular epidemiology[J]. J Infect Dis,171(5): 1139-1143.
White JA, Todd PA, Rosenthal AN, Yee JL, Grant R, Lerche NW. 2009. Development of a generic real-time PCR assay for simultaneous detection of proviral DNA of simian Betaretrovirus serotypes 1, 2, 3, 4 and 5 and secondary uniplex assays for specific serotype identification[J]. J Virol Methods,162(1-2): 148-154.
Wilkinson RC, Murrell CK, Guy R, Davis G, Hall JM, North DC, Rose NJ, Almond N. 2003. Persistence and dissemination of simian retrovirus type 2 DNA in relation to viremia, seroresponse, and experimental transmissibility in Macaca fascicularis[J]. J Virol,77(20): 10751-10759.
Zhou YM, Li SD, Duan XS. 1999. Seroepidemiological study on viruses of the wild rhesus monkeys in Yunnan province[J]. J Yunnan Univ:Nat Sci,21(3): 1-6. [周亚敏,李绍东,段幸生. 1999.云南省野生恒河猴病毒血清流行病学研究[J].云南大学学报:自然科学版,21(3): 1-6.]
Epidemiological survey of a captive Chinese rhesus macaque breeding colony in Yunnan for SRV, STLV and BV
ZHU Lin1,3,#, HAN Jian-Bao1,#, ZHANG Xi-He1,3, MA Jian-Ping1,3, LÜ Long-Bao2, ZHANG Gao-Hong1,*, ZHENG Yong-Tang1,2,*
(1. Key Laboratory of Animal Models and Human Disease Mechanisms of Chinese Academy of Sciences & Yunnan Province, Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming 650223, China; 2. Kunming Primate Research Center of Chinese Academy of Sciences, Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming, 650223, China; 3. Graduate School of Chinese Academy of Science, Beijing 100049, China)
Nonhuman primates are critical resources for biomedical research. Rhesus macaque is a popularly used laboratory nonhuman primate that share many characteristics with humans. However, rhesus macaques are the natural host of two exogenous retroviruses, SRV (simian type D retrovirus) and STLV (simian T lymphotropic virus). SRV and STLV may introduce potentially significant confounding factors into the study of AIDS model. Moreover, B virus (ceropithecine herpesvirus 1) is likely to harm not only rhesus macaque but also humans in experiments involving rhesus macaque. Yunnan province has large-scale breeding colonies of Chinese rhesus macaque. Therefore there is an urgent need for SPF Chinese rhesus macaque colonies. Here we investigated SRV, STLV and BV infections in 411 Chinese rhesus macaque by PCR technique. The results showed that the prevalence of SRV, STLV and BV among Chinese rhesus macaque breeding colony was 19.71% (81/411), 13.38% (55/411) and 23.11% (95/411), respectively. Comparison of viruses infection in different age-groups and male/female of Chinese rhesus macaque was also analyzed. This study will contribute to establishment of SPF Chinese rhesus macaque breeding colony.
SRV; STLV; B virus; Chinese rhesus macaque; Epidemiological survey
R512.91; Q959.848; Q95-33
A
0254-5853-(2012)01-0049-06
10.3724/SP.J.1141.2012.01049
2011-12-05;接受日期:2012-01-16
国家科技重大专项课题(2009ZX09501-029, 2012ZX10001-007);中国科学院重要方向课题(KSCX1-YW-10, KSCX2-EW-R-13);“西部之光”人才计划项目
∗通信作者(Corresponding authors):郑永唐, Tel/Fax:0871-5195684, E-mail: zhengyt@mail.kiz.ac.cn;张高红, Tel:0871-5125855, E-mail: zhanggh@mail.kiz.ac.cn #并列第一作者(Authors contributed equally to the work)
朱 林(1981-),男,博士研究生,从事HIV-1杀微生物剂的研究;韩建保(1978-),男,硕士,研究实习员,从事艾滋病动物模型研究

