白喉乌头水浸提液对禾本科牧草种子萌发的化感作用
徐彩芹,安沙舟,何 君
(新疆农业大学草业与环境科学学院 新疆草地资源与生态实验室,新疆 乌鲁木齐830052)
白喉乌头(Aconitumleucostomum)为毛茛科乌头属多年生草本植物,是新疆草地的主要有毒植物之一,牲畜误食会造成中毒和死亡现象。其在伊犁州天然草地上分布广泛,仅在新源县其危害面积就达13.5万hm2,约占全县可利用草地的30%,且每年以0.30万~0.36万hm2的速度蔓延[1]。严重影响了草地的产量与质量、牲畜的生长与繁殖和当地草地畜牧业的发展及生态安全。因此,对白喉乌头的控制及防除已成为新疆当前草地生态健康、可持续发展和畜牧业生产畅通的瓶颈。为了找出白喉乌头的防除方法,李宏等[2]研究表明,围栏封育2年可以有效控制白喉乌头的生长和繁殖;在围栏封育的同时,再采取连续彻底挖除的措施更为有效。王显瑞等[3]对白喉乌头种群生长动态进行了研究,结果表明,高度是影响白喉乌头地上生物量的最重要的因素,可以通过控制白喉乌头的高度来控制其繁殖。但关于白喉乌头化感作用的研究甚少。化感作用是一种植物通过向环境释放化学物质而对另一种植物(包括微生物)所产生的有害和有益的两方面作用[4]。已有大量研究表明[5-8],优势种的毒害草的化感作用和过度放牧是形成草地退化的成因之一。因此,本研究从植物相生相克原理出发,研究白喉乌头水浸提液对几种禾本科植物种子萌发的影响,探讨其对山地草甸草地群落结构的影响,以期为揭开过度放牧下,白喉乌头快速蔓延的现象提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供体植物 白喉乌头于2010年6月采自新疆新源县那拉提镇阿乌赞夏季草地(83°46′E,43°11′N),海拔1 965m,年降水量600~800mm,无霜期80~110d,年日照时数为2 400~2 700h。
1.1.2 受体植物 受体植物为黑麦草(Loliumperenne)、草地早熟禾(Poapratensis)、苇状羊茅(Festucaarundinacea)和无芒雀麦(Bromusinermis),其中前3种牧草种子由新疆克劳沃草业有限责任公司提供,无芒雀麦种子由新疆农业大学草业与环境科学学院提供。
1.2 研究方法
1.2.1 水浸提液制备方法 从天然草地挖取生长健康的白喉乌头,冲洗干净,自然晾干,分为地上和地下部分,即根和茎叶两部分后,分别将其剪成<2cm的小段,放入锥形瓶,加蒸馏水配成0.012 5、0.025 0、0.050 0和0.100 0g·mL-14个质量浓度的溶液,在室温(20~24℃)下放置48h(每隔12h摇动5min),用2层滤纸过滤2次后,即为白喉乌头根部和茎叶水浸提液,放入4℃冰箱中保存备用。
1.2.2 种子萌发试验 用培养皿滤纸法[9]测试不同质量浓度不同部位白喉乌头水浸提液对供试种子萌发的影响。在直径为12cm的培养皿中铺2层滤纸,每皿放饱满的供试种子100粒,分别加入配置好的水浸提液6mL,以蒸馏水为对照,每处理3个重复。放入人工气候箱,光照12h·d-1,温度:白天25℃、夜晚15℃,每24h记录受体种子萌发数,并等量补充少量水浸提液(对照加蒸馏水),以胚根长度大于种子长度或等长,胚芽长度为种子长的一半视为种子萌发,试验结束时(草地早熟禾21d,无芒雀麦、黑麦草和苇状羊茅则为14d)计算萌发率和萌发指数。
1.3 数据统计分析
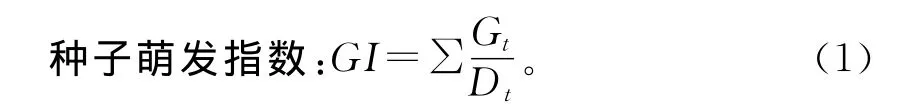
式中,Gt为第n天的发芽数,Dt为相应的发芽天数。
采用DPS 6.5软件对处理组和对照组之间进行方差分析。
萌发率和萌发指数参照Williamson和Richardson[10]的方法计算化感作用效应指数(RI)。

式中,C为对照值,T为处理值。RI>0为促进,RI<0为抑制,绝对值的大小与作用强度一致。为综合比较供体材料间的化感作用强度及受体植物对化感作用敏感性,参照马瑞君等[11]的方法,用综合化感效应指数(M)表示,即对萌发率和萌发指数的RI值采取相加平均法进行再处理,所得结果含意不变,即M>0为促进,M<0为抑制,绝对值的大小与作用强度一致。
2 结果与分析
2.1 白喉乌头水浸提液对4种牧草种子萌发率的影响 白喉乌头叶的水浸提液对供试4种牧草种子萌发率的影响,除水浸提液质量浓度≥0.050 0g·mL-1时,对无芒雀麦种子萌发率具有显著抑制作用(P<0.05)外,其他3种牧草种子萌发率均表现为质量浓度≥0.100 0g·mL-1时,才具有显著的抑制作用(P<0.05)(表1)。
白喉乌头根水浸提液,无芒雀麦在质量浓度>0.025 0g·mL-1时,表现为差异性显著(P<0.05);草地早熟禾在质量浓度≥0.050 0g·mL-1时,抑制作用显著(P<0.05),而黑麦草在0.100 0 g·mL-1质量浓度时,才表现为显著差异(P<0.05)(表1)。总体比较而言,相同质量浓度水平下,白喉乌头根的水浸提液抑制作用强于叶。
2.2 白喉乌头水浸提液对4种牧草种子萌发指数的影响 随着处理液质量浓度的升高,种子萌发时间延长,出芽延后,这一现象严重影响了种子萌发指数,进而影响植物对地上和地下资源竞争力。与对照相比,白喉乌头的叶水浸提液在低质量浓度差异性不显著,当质量浓度≥0.0500g·mL-1时,抑制作用显著(P<0.05),而根水浸提液在≥0.012 5 g·mL-1时,具有显著抑制作用(P<0.05),且抑制作用随着水浸提液质量浓度的增加而加大(表2)。

表1 白喉乌头水浸提液对牧草种子萌发率的影响Table 1 Effects of Aconitum leucostomum aqueous extract on forage seed germination
2.3 不同牧草对白喉乌头化感效应综合分析从综合化感效应指数(M)分析,萌发率的平均值为-0.18,种间抑制为无芒雀麦>草地早熟禾>黑麦草>苇状羊茅;萌发指数M值的平均值为-0.22,种间敏感程度为无芒雀麦>黑麦草>草地早熟禾>苇状羊茅。由此可见,萌发指数对化感作用更为敏感;分析得知,种子萌发期的综合化感效应指数平均值为-0.20,种间敏感程度为无芒雀麦>黑麦草>草地早熟禾>苇状羊茅(表3)。

表2 白喉乌头水浸提液对牧草种子萌发指数的影响Table 2 Effects of Aconitum leucostomum aqueous extract on forage seed germination index

表3 4种牧草对白喉乌头水浸提液化感作用的敏感指数Table 3 Allelopathy effects of Aconitum leucostomum aqueous extract on sensitivity index of four forage species
3 讨论与结论
3.1 白喉乌头化感物质的释放途径 化感作用在毒害草入侵过程中常常起着重要作用,雨雾淋溶是植物生长过程中经常发生的自然过程,许多研究[12-15]证实:利用降水,从化感植物残株中得到的淋溶液能显著抑制其他植物生长。本研究表明,白喉乌头根和叶水浸提液对4种牧草的化感作用在低质量浓度时差异不显著,高质量浓度时差异显著(P<0.05),与叶片相比,白喉乌头根部含有更多或活性更强且较为稳定的化感物质,且根量越多,含有的化感物质越多,对其周围优良牧草种子萌发的抑制作用越强。总体分析化感效应表现为抑制作用。在新疆那拉提阿乌赞夏季草地中,植物生长季雨水充沛,从而推断雨水淋溶可能是白喉乌头向环境释放化感物质的途径之一。
3.2 白喉乌头对4种牧草化感作用综合分析本研究表明,返青期的白喉乌头对无芒雀麦、苇状羊茅、草地早熟禾和黑麦草具有化感作用,其中,无芒雀麦最易受白喉乌头的化感作用的影响,而苇状羊茅具有一定的耐受力。由于受白喉乌头化感作用的影响,牧草种子发芽延后,因而对萌发指数大多表现为抑制作用显著(P<0.05)。抑制作用主要表现为对根的抑制较明显,质量浓度越高,根长越短,表现为高质量浓度时较多种子芽长约3cm,却无根长或根极短,未能达到种子萌发的标准,且对萌发指数的影响大于萌发率。综合分析化感效应指数,4种牧草的对白喉乌头化感作用的敏感程度为无芒雀麦>黑麦草>草地早熟禾>苇状羊茅。由此可见,无芒雀麦和黑麦草受抑制程度较强。
综上所述,造成白喉乌头蔓延的原因一方面是由于过度放牧以及牲畜的选择性取食,使白喉乌头在地上部分处于明显的竞争优势;另一方面,在地下,牧草与杂草之间对地下水肥资源激烈的竞争,加之白喉乌头根部的化感物质显著抑制牧草根的生长,进而影响牧草种子萌发期根在地下竞争的能力。由此可见,白喉乌头的化感作用是使其在整个草地群落中形成优势种的原因之一。
[1]罗开雷,安沙舟,李学贤,等.有毒植物白喉乌头化学防除的初步研究[J].新疆农业科学,2006,43(5):391-393.
[2]李宏,王显瑞,木克松,等.围栏封育和挖除对有毒植物白喉 乌 头 的 影 响 [J].草 业 科 学,2009,26(11):152-156.
[3]王显瑞,安沙舟,张鲜花.白喉乌头种群生长动态初步研究[J].草业科学,2010,27(6):32-37.
[4]Rice E L.Allelopathy[M].New York:Academic Press,1974:166-179.
[5]张宝琛,白雪芳,顾立华,等.生化他感作用与高寒草甸上人工草场自然退化现象的研究[J].生态学报,1989,9(2):115-119.
[6]周淑清,黄祖杰,王惠,等.狼毒在土壤里腐解过程中对红豆草生化他感作用的研究[J].草业科学,2009,26(3):91-94.
[7]翟书华,岑晓江,张光飞.紫茎泽兰浸提液对针叶植物种子萌发的化感作用研究[J].昆明学院学报,2008,30(4):64-65.
[8]方芳,郭水良,黄华,等.开花期加拿大一枝黄花水浸提液对3种作物种子萌发和幼苗生长的影响[J].植物研究,2007,27(5):569-573.
[9]王彦荣.GB/T 2930.11-2001,牧草种子检验规程[S].北京:中国标准出版社,2001.
[10]Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Chemical Ecology,1988,14(1):181-187.
[11]马瑞君,王明理,赵坤,等.高寒草场优势杂草黄帚橐吾水浸液对牧草的化感作用[J].应用生态学报,2006,17(5):845-850.
[12]王乃亮,马瑞君,孙坤,等.5种菊科植物水浸液对黄帚橐吾种子萌发期化感作用的研究[J].兰州大学学报(自然科学版),2006,42(5):56-61.
[13]张震,徐丽,马艳婷,等.喜旱莲子草组织水浸液对黑麦草种子和幼苗的化感效应[J].西北植物学报,2009,29(1):148-153.
[14]朱慧,马瑞君,陈树思,等.高寒草场主要牧草对黄帚橐吾水浸液化感胁迫的生理影响[J].草业学报,2007,16(5):102-106.
[15]赵庆芳,郭鹏辉.党参水浸液对不同作物的化感作用研究[J].安徽农业科学,2007,35(24):7511-7513.
——以渤海S油田为例
——黔南扁穗雀麦

