早春短命植物绵果荠无菌苗组织培养相关因素研究
曼苏尔·那斯尔,谭敦炎,廖 康
(新疆农业大学,新疆 乌鲁木齐830052)
短命植物是生长在干旱荒漠地带的一类生活周期或年生长期很短的特殊植物类群的总称[1-4]。我国短命植物仅分布于新疆北部荒漠及其毗邻的草原带[5],是新疆北部地区沙漠稳定沙面的主要贡献者和沙漠受干扰破坏后植被恢复的先锋植物[6]。短命植物是光合效率高、物质积累快、营养周期短的植物资源,是一类优良的春季牧草[7]。绵果荠(Lachnolomalehmannii)隶属于十字花科绵果荠属,分布于亚洲中部,在我国仅分布于新疆北部准噶尔荒漠。每年4月上旬种子开始萌发,5月上旬进入花期,6月上旬进入果熟期,生活周期为60~70d,是典型的一年生早春短命植物[8]。该物种具有生活周期短、萌发期早、染色体数少(2n=2x=14)、较强的抗盐、耐旱及耐高温等特性,是一种潜在的特殊遗传资源,可作为模式植物的筛选物种。因而,其组织培养再生体系的建立对于从细胞水平探讨该物种对准噶尔荒漠环境适应的机制和演变规律具有重要的理论价值,并对采用现代生物技术开发特殊遗传资源和保存种质具有十分重要的意义。无菌苗的获得是植物生物技术尤其是组织培养的首先步骤和关键技术。但目前为止,该物种的此类研究尚未见报道。绵果荠种子自然萌发率低、植株矮小、全身着生绵毛等的生理和形态特征,给外植体消毒带来不便。本试验以绵果荠种子为研究材料,研究无菌苗获得的相关因素,以期探索高效且稳定的消毒方法和培养条件,为绵果荠植株再生体系的建立提供技术基础。
1 材料与方法
1.1 试验材料 2008年6月,在新疆阜康彩南的自然种群(44°22′24.7″N,88°08′30.1″E,海拔459 m)采集成熟的绵果荠果实,在室温(25℃)下贮藏备用。
阜康彩南位于新疆准噶尔盆地东部沙漠覆盖区,进入古尔班通古特沙漠腹地,受西风带及北冰洋水汽的影响,是内陆冷荒漠,典型的温带荒漠气候。年平均气温为6.4℃,最高温为40.9℃,最低温为-40.3℃,年降水量为134.3mm,年潜在蒸发量1 965mm,无霜期175d[9]。
1.2 方法
1.2.1 种子表面消毒处理 流水冲洗种子15min后,在无菌条件下无菌水清洗4次,设置31种不同的消毒方法处理(表1),再用无菌水清洗4次,接种到 MS[10]培养基上,在温度为(25±1)℃、全黑暗中培养3d后转入16h·d-1光下进行培养,14d后进行统计分析。

表1 不同消毒处理对绵果荠种子发芽率和污染率的影响Table 1 Effects of different disinfection methods on seed germination and pollution rate of Lachnoloma lehmannii
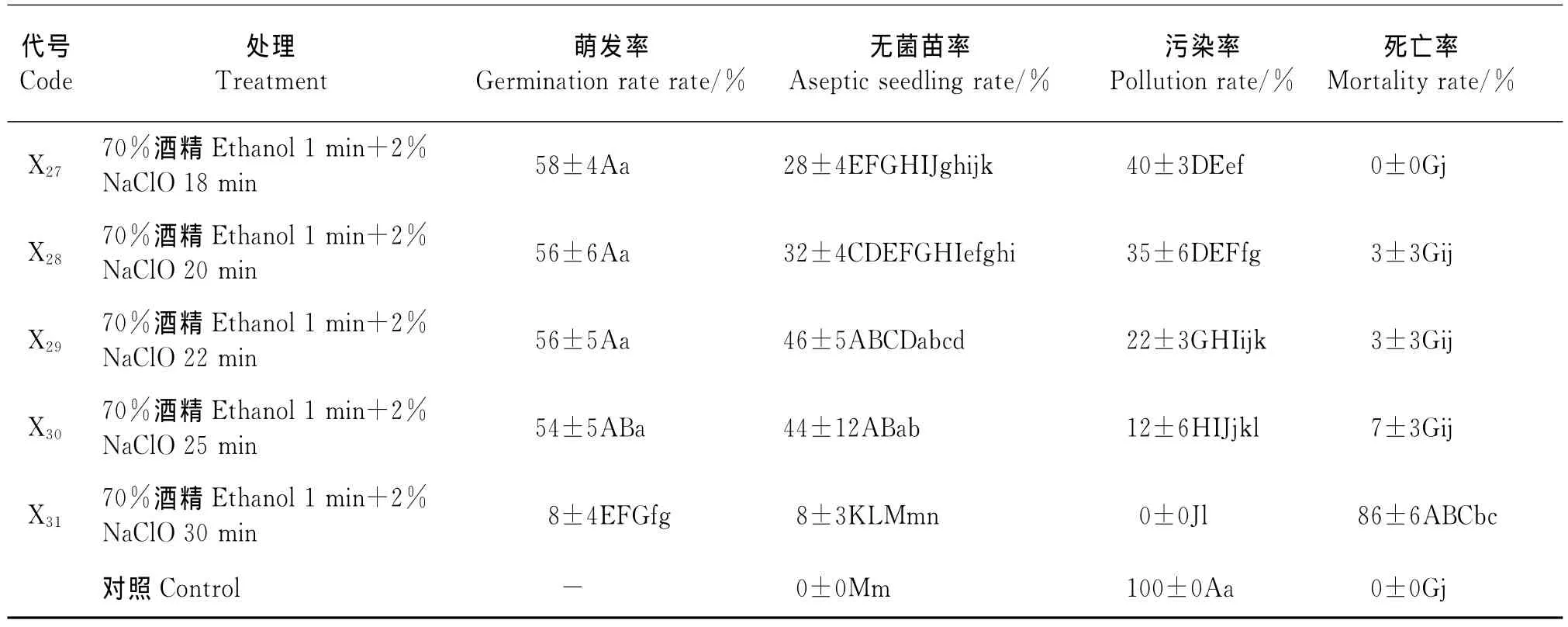
续表1
1.2.2 消毒前流水冲洗的影响 种子分别用流水冲洗处理0min、1~2min(W1)、10min(W2)、20min(W3),并用X12方法进行消毒后接种到MS培养基上培养14d(表1),培养条件同1.2.1。
1.2.3 光照对种子萌发和幼苗生长的影响 种子经W1方法流水冲洗和X12方法表面消毒后接种到MS培养基上,全黑暗培养0、3、6、10和14d,处理后再转至光照周期下培养。14d后进行统计分析,培养温度均为(25±1)℃,光照培养的光周期为16h·d-1。
1.2.4 培养温度对种子萌发率和幼苗生长的影响同样方法种子消毒后接种于MS培养基上,置于对照(25℃±1℃)、T1(15℃/5℃)、T2(20℃/10℃)和T3(25℃/15℃)4种不同温度的光照培养箱内进行14d的培养。光周期为16h·d-1,光照强度均为2 000lx。
1.2.5 植物生长调节剂对种子萌发和幼苗生长的影响 将种子15min流水冲洗和X12方法消毒后,接种于对照(无生长调节剂的 MS)、GR1(MS+0.5 mg·L-1IBA)、GR2(MS+1.0mg·L-1IBA)、GR3(MS+1.0mg·L-1IBA+0.1mg·L-1BAP)、GR4(MS+1.0mg·L-1IBA+0.2 mg·L-1BAP)和GR5(MS+1.0mg·L-1IBA+0.5mg·L-1BAP)5种培养基上,在温度为(25±1)℃、光周期为16h·d-1的培养室内进行14 d的培养。
1.2.6 培养方式的筛选 种子W1方法流水冲洗和X12方法表面消毒后接种到MS基本培养基上,并在变温为15℃/5℃(白天/晚上)、光照为16h·d-1的培养箱培养5d,种子萌发后转移到温度为(25±1)℃、光照为16h·d-1的培养室内培养;对照始终在(25±1)℃、光照为16h·d-1的培养室内培养,14d后比较幼苗生长情况。
1.3 观察与测定
1.3.1 种子萌发和污染状况的观察 种子接种48h后开始观察,隔24h记录该天萌发瓶数、该天萌发外植体数目、种子起始萌发(胚根露白至胚根伸长0.05 cm)的天数和持续的天数,并记录污染瓶数和污染外植体数目及其持续天数等指标。培养到第14天后统计种子萌发率、无菌苗率、污染率和死亡率等指标。
1.3.2 幼苗生长的观察和测定 萌发到第14天后测定子叶、下胚轴和根的鲜质量及子叶面积、下胚轴和根的长度等指标。子叶面积用叶形纸称量法测定[11]。
1.4 数据处理 试验中同一个处理为5瓶,每瓶接种10粒种子,重复3次。数据采用SPSS 16.0软件进行分析和绘图。
2 结果与分析
2.1 不同消毒剂和消毒方法对种子消毒效果的影响 不同处理种子萌发起始时间无明显差异,均为3~5d,但细菌的发生时间不同,在幼苗后期也出现长菌现象(表1),31种消毒方法中,单独使用NaClO或HgCl2的消毒效果比与酒精配合使用的明显要差。NaClO和HgCl2两种消毒剂中,虽然NaClO与酒精配合处理外植体的死亡率较低,种子初始萌发率较高,但其消毒效果不彻底,出现外植体和幼苗后期发霉。随着消毒时间的延长,虽然其污染率开始下降,但同时死亡率也呈直线上升趋势,因此获得无菌苗率仍然很低。NaClO和酒精的配合中消毒效果较好的为X25,14d后该处理的无菌苗率为48%、种子萌发率为56%、污染率为25%、死亡率为3%。虽然种子对HgCl2与酒精配合消毒的反应较敏感,不同处理时间的消毒效果差异显著,但该配合的消毒效果彻底,无菌苗率高。HgCl2与酒精配合处理中处理X12的消毒效果最好,也是本试验中最理想的配合。该处理的无菌苗率为60%、种子萌发率为60%、污染率为0、死亡率为3%;其次为X11。而无消毒处理(对照)的外植体第2天开始细菌生长至第5天彻底污染(100%),无法记录种子萌发率。

图1 流水处理对绵果荠种子萌发和污染的影响Fig.1 Effects of running tap water treatment on seed germination and pollution rate of Lachnoloma lehmannii
2.2 流水处理对种子消毒效果的影响 不同处理中种子萌发起始时间无明显差异,均为3~5d。污染的外植体出现在3~7d。自来水处理的外植体污染率明显低于对照(图1),二者间存在极显著差异(P<0.01),即对照的污染率为26%,处理的外植体污染率均为0。自来水处理的种子萌发率极显著高于对照,随着自来水冲洗时间的延长种子萌发率呈下降的趋势,培养到第14天后处理W1的最后萌发率最大,为78%,比对照高34%。
2.3 光照对种子萌发率和幼苗生长影响 在黑暗条件下种子萌发起始时间推迟(第4-7天),持续时间较长(3~4d),到第14天未出现真叶。光照条件下种子萌发起始时间较早(2~4d),持续时间较短(2~3d),真叶发生也较早(11~13d)。不同的全黑暗处理种子萌发率有极显著差异(P<0.01)。随着全黑暗天数的延长种子萌发率呈下降趋势(图2),14d培养后对照的种子萌发率为73%,比14d全黑暗处理的高40%。

图2 黑暗培养对绵果荠种子萌发的影响Fig.2 Effects of darkness culture on seed germination rate
不同处理的无菌苗子叶面积有极显著差异(P<0.01)。随着黑暗处理天数的延长子叶面积呈下降趋势。培养14d后对照(暗处理天数为0d)的子叶面积为0.8cm2,是14d黑暗处理的2.5倍(图3)。同样随着黑暗处理天数的延长子叶鲜质量也呈现下降趋势。不同处理间差异极显著(P<0.01)。对照子叶鲜质量为35mg,是14d黑暗处理的2.5倍(图3)。不同处理的无菌苗下胚轴长度也有极显著差异(P<0.01),下胚轴长度随着黑暗培养天数的延长大致呈上升趋势。14d黑暗处理的无菌苗下胚轴长度为4.4cm,是对照的1.95倍(图3)。同样下胚轴鲜质量也随黑暗处理天数的延长呈上升趋势,不同处理间差异极显著(P<0.01),14d黑暗处理的下胚轴鲜质量为76mg,是对照的2.1倍(图3)。不同处理的无菌苗根长度有极显著差异(P<0.01)。随黑暗处理天数的延长,根长呈上升趋势,14d黑暗处理的无菌苗根长度为16.4cm,是对照的1.95倍(图3)。无菌苗根鲜质量随黑暗处理天数的延长呈下降趋势,不同处理的根鲜质量有显著差异(P<0.05)。对照的胚根鲜质量为25mg,是14d黑暗处理的2.4倍(图3)。
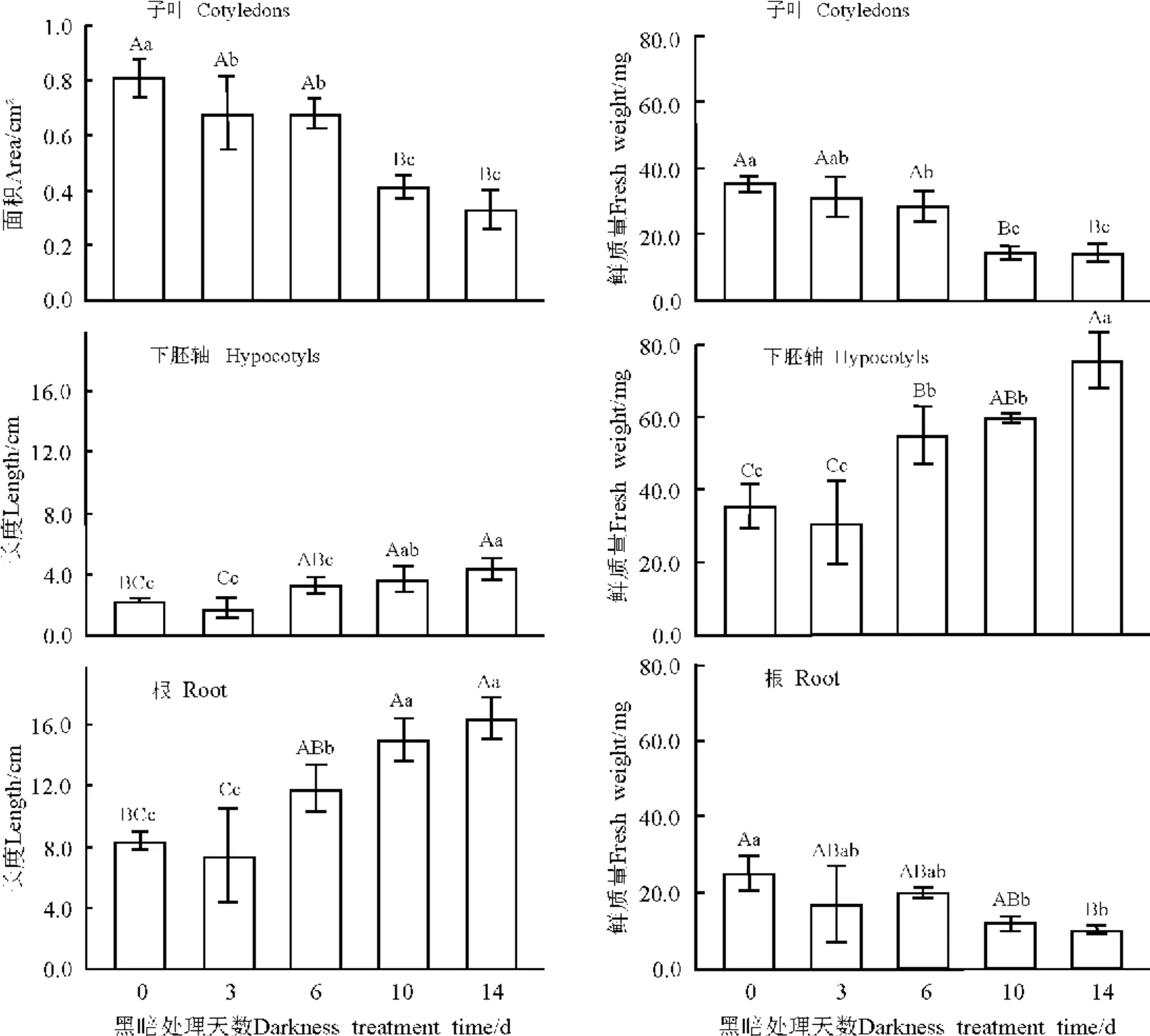
图3 黑暗培养天数对绵果荠幼苗生长的影响Fig.3 Effects of time of darkness culture on the seedling growth
2.4 温度对种子萌发和幼苗生长的影响 不同温度下种子萌发起始的早晚和幼苗生长势有一定的差异。处理T1的种子萌发起始时间为4~6d,培养到14d未出现真叶。与对照的幼苗相比,处理T1的株高较矮、子叶面积较小、整株颜色较深。处理T2和T3与对照的种子萌发起始时间和幼苗生长势无显著差异,萌发起始时间均为3~5d。对照和T3在第11-13天开始发生真叶。不同温度处理的种子萌发率之间无显著差异(P>0.05)(图4)。对照与T2和T3处理间种子萌发率无显著差异,但与处理T1间显著差异(P<0.05),14d后处理T1的最后种子萌发率达到了90%,比对照种子萌发率高16%。

图4 温度对绵果荠种子萌发的影响Fig.4 Effects of temperature on seed germination
2.5 植物生长调节剂对种子萌发和幼苗生长的影响 生长素的单独使用(GR1、GR2)对种子萌发无明显影响,而生长素与细胞分裂素配合使用有显著影响,随着细胞分裂素质量浓度的提高,种子萌发率呈下降趋势(图5)。处理GR3的种子萌发率达到了83%,比对照高23%。
不同处理间子叶面积有极显著差异(P<0.01)。生长素单独使用的子叶面积均明显小于对照。而生长素与细胞分裂素配合使用的子叶面积均明显大于对照。处理GR3的子叶面积最大,为1.21 cm2,是对照的1.6倍。但是,随着配合使用的细胞分裂素质量浓度的提高子叶面积呈下降趋势(图5)。
生长素单独使用对绵果荠无菌苗下胚轴长度无显著影响(图6)。与生长素配合使用的细胞分裂素的不同质量浓度处理之间虽然无显著差异,但下胚轴长度明显小于对照,对照的下胚轴长为2.3cm,是处理GR5的2.9倍。
不同处理和对照的无菌苗根长的变化趋势表现为对照>生长素单独使用>生长素和细胞分裂素配合使用,彼此间存在极显著差异(P<0.01)。不同质量浓度生长素的单独处理之间无显著差异,但与对照相比差异极显著,对照的根长度为8.39cm,是GR2的1.9倍。生长素配合使用的细胞分裂素的不同质量浓度处理之间也无显著差异,但与对照相比差异极显著,对照的下胚轴长度为GR5的9.7倍(图6)。

图5 植物生长调节剂对绵果荠种子萌发和子叶面积的影响Fig.5 Effects of plant growth regulator on seed germination and cotyledons area

图6 植物生长调节剂对绵果荠幼苗下胚轴和根长的影响Fig.6 Effects of plant growth regulator on fresh weight of seedling hypocotyl and root
2.6 培养方式的筛选 观察得知,将种子先放在变温15℃/5℃、光照为16h·d-1的培养箱培养5 d,种子萌发后转移到温度为(25±1)℃、光照为16 h·d-1的室内培养的种子萌发起始时间比对照迟1 d,但是种子萌发率却明显高于对照,且幼苗生长较整齐(图7)。

图7 不同培养方式下绵果荠的幼苗生长(14d的幼苗)Fig.7 Seedling growth of Lachnoloma lehmannii in different culture way(14-d-seedling)
3 讨论
获得无菌材料时,外植体消毒的基本要求是既要杀死表面的全部微生物,使污染率降到最低,又要使外植体保持活力[12-13]。因此,应当正确选择消毒剂的浓度和处理时间,以尽量减少组织的死亡。据Muralidharan和 Mascarenhas[14]的报道,在常用的几种消毒剂中,HgCl2的消毒效果最好。同样本试验也发现HgCl2的消毒效果比NaClO好。此外,先用70%酒精进行表面消毒,再用NaClO或HgCl2消毒的效果明显高于直接用NaClO和HgCl2消毒,说明在种子预处理中,使用酒精对种子表面进行消毒是必要的,这些结果与李劲峰等[15]的研究结果一致。种子预先用水冲洗能提高种子表面消毒的效果。本研究结果表明,绵果荠种子经自来水冲洗1~2min后再用消毒剂处理的外植体带菌率比直接用消毒剂处理的明显低,这可能是冲洗使种皮松软,消毒剂易渗入所致。但随着自来水预处理时间的延长,种子萌发率呈下降趋势。说明,因种子流水处理时间过长,种皮过松软或被破坏,消毒剂直接深入种胚,而消毒后的无菌水冲洗不彻底或消毒剂直接毒害种子。
温度是影响种子萌发的重要生态因子之一,严重影响种子的发芽率和萌发速率,适宜温度会促进种子的萌发和幼苗的生长。但生境和种类的不同,种子最适萌发温度也有差异[16-17]。早春短命植物常在3月底至4月初萌发出土,此时气温从0℃以下开始升高,日照时间也越来越长。因此,温度对早春短命植物的影响尤为重要[18]。本研究结果表明,绵果荠种子萌发对不同温度的响应有明显的差异,种子萌发率在15℃/5℃下明显高于(25±1)℃,说明高温对绵果荠种子的萌发具有一定的抑制作用,而绵果荠种子的萌发对低温有较强的依赖性。萌发后的幼苗生长势对不同温度的响应与种子萌发相反,即低温(15℃/5℃)下绵果荠幼苗生长较缓慢,到第14天还未出现真叶,植株和子叶都很小,而在高温(25℃±1℃)下幼苗真叶发生较早,植株和子叶都很健壮。说明低温对绵果荠幼苗的生长有明显的抑制作用。由此可见,绵果荠在准噶尔荒漠严酷环境的长期进化过程中产生如此的特殊生态适应机制而保持了其生存的持续性。此结论与其他短命植物生态适应对策研究结果相符合[19-20]。
在自然环境中,光照条件通过影响种子的萌发率和萌发速率进而影响到幼苗的形成和生长,最终影响到物种的适合度[21]。由于植物所处的生境以及本身的生物学特性差异,不同植物种子的萌发及其幼苗生长对光照具有不同的要求[22-24]。许多荒漠植物的种子无论在光照下还是在暗中都萌发很好[25],或者在暗中的萌发较在光下好[26],但也有部分植物种子的萌发对光照有严格依赖性[27-28]。本研究结果表明,光照对绵果荠种子萌发有显著的影响。在全黑暗下种子可以萌发,但种子萌发起始时间延迟、持续时间较长,而且最终萌发率也很低,光照条件下的种子萌发率明显高于黑暗条件下的,而且种子萌发起始时间较早、持续时间较短。说明光照对绵果荠种子萌发有明显的促进作用。但幼苗的不同部位对光照处理有不同响应,且不同处理之间存在极显著差异。说明光照不仅影响绵果荠种子萌发,而且更影响受体材料的质量。
适宜的植物生长调节剂可打破种子休眠、破坏妨碍种子萌发的活性物质,提高种子萌发率、改善幼苗形态建成。康冰等[29]的研究结果发现,用适宜浓度的GA3、6-BA及IAA浸种可有效提高香椿(Toona sinensis)种子发芽率、幼苗生长量及干物质积累。朱霞等[30]在几种植物生长调节剂对决明(Cassiaobtusifolia)种子萌发及幼苗生长的影响研究也得到同样的结果。一定量的生长调节剂配合对绵果荠种子萌发和无菌苗的子叶面积均有促进作用。GR3的种子萌发率和子叶面积显著高于不处理。但根和下胚轴长度随着生长调节剂浓度的提高呈下降趋势,处理显著低于不处理。由此可知,生长调节剂对不同器官的影响有所不同,根据该结论,可以按需求培育定向的器官材料。但是,附加培养基中的植物生长调节剂除了直接影响种子萌发和母株的生长状况外,还会在试管苗的器官中积累,使外植体的内源激素含量产生差异,从而影响后续的研究结果[12]。因此,该结论还需要进一步研究和详细的探讨。
4 结论
1)绵果荠种子消毒适宜的方法为:种子流水冲洗1~2min,70%酒精浸泡1min,0.1%HgCl2消毒1.5min。
2)光照对绵果荠种子萌发有促进作用。在25℃下,周期性光照的种子萌发率为73%,比全黑暗的高40%。而幼苗的不同部位对光照有不同的响应,且不同处理之间存在极显著差异。
3)绵果荠的种子萌发对低温有依赖性。光照条件下,15℃/5℃的种子萌发率达到了90%,比对照的高16%。而幼苗生长需要一定的高温。
4)适宜的植物生长调节剂对绵果荠种子萌发有促进作用。在周期性光照和25℃条件下,MS+1.0mg·L-1IBA+0.1mg·L-1BAP的种子萌发率为83%,比对照的高23%。但绵果荠幼苗不同的部位对生长调节剂的反应不同。
因此,绵果荠种子萌发和幼苗生长的适合培养体系是将种子消毒后接种于无激素的MS培养基先放在温度为15℃/5℃(白天/夜晚)、光照为16 h·d-1、湿度为70%~80%的培养箱内培养4~5 d,种子萌发后转移到温度为(25±1)℃、光照为16 h·d-1的培养室内培养,发芽率达到90%,比对照的高16%。诱导出来的无菌苗很健壮,可为愈伤组织诱导和植株再生或其他遗传学和分子生物学方面的研究提供良好材料。
[1]Risser P,Cottam G.Influence of temperature on the dormancy of some spring ephemerals[J].Ecology,1967,48(3):500-503.
[2]Mulroy T W,Rundel P W.Annual plants:adaptations to desert environments[J].Bioscience,1977,27:109-114.
[3]张立运.新疆莫索湾地区短命植物的初步研究[J].植物生态学与地植物学丛刊,1985,9:213-221.
[4]黄培祐.干旱区免灌植被及其恢复[M].北京:高等教育出版社,2002:38-81.
[5]潘伟斌,黄培佑.四种短命植物若干生态学特性的研究[J].新疆环境保护,1991,13(3):22-27.
[6]王雪芹,蒋进,雷加强,等.古尔班通古特沙漠短命植物分布及其沙面稳定意义[J].地理学报,2003,58(4):598-605.
[7]张立运.新疆的短命植物 Ⅲ.群落学意义和资源价值[J].植物杂志,2002(3):4-5.
[8]马素卿,潘秀敏.中国植物志:第13卷[M].北京:科学出版社,1987:110.
[9]Wang L,Huang Z Y,Baskin C C,etal.Germination of dimorphic seeds of the desert annual halophyteSuaeda aralocaspica(Chenopodiaceae),a C4plant without kranz anatomy[J].Annals of Botany,2008,102:757-769.
[10]Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue culture[J].Plant Physiology,1962,15:473-497.
[11]彭强,梁银丽,陈晨,等.土壤含水量对结果期温室辣椒生长及果实品质的影响[J].西北农林科技大学学报(自然科学版),2010,38(1):154-160.
[12]Trigiano R N,Cray D J.Plant tissue culture concepts and laboratory exercises[M].Second edition.USA:The Chemical Rubber Company Press,2000:45-86.
[13]Razdan M K.Introduction to plant tissue culture[M].Second edition.USA:Science Publishers,Inc,2003:87-367.
[14]Muralidharan E M,Mascarenhas A F.Invitroplantlet formation by organogenesis inEucalyptuscamaldulensisand by somatic embryogenesis inEucalyptuscitriodora[J].Plant Cell Reports,1987,6:256-259.
[15]李劲峰,郑树松,蒋海玉,等.油菜无菌苗最佳生长条件的探讨[J].贵州农业科学,2006,34(1):34-35.
[16]田宏,刘洋,张鹤山,等.扁穗雀麦种子萌发条件的研究[J].草业科学,2009,26(7):88-93.
[17]Qu X X,Huang Z Y,Baskin J M,etal.Effect of temperature,light and salinity on seed germination and radicle growth of the geographically widespread halophyte shrubHalocnemumstrobilaceum[J].Annals of Botany,2008,101:293-299.
[18]马生军,刘晓风,谭敦炎.8种十字花科短命植物的物候及其对荒漠环境的适应[J].新疆农业大学学报,2006,29(4):1-4.
[19]Lu J J,Tan D Y,Baskin J M,etal.Fruit and seed heteromorphism in the cold desert annual ephemeralDiptychocarpusstrictus(Brassicaceae)and possible adaptive significance[J].Annals of Botany,2010:1-16.
[20]袁素芬,唐海萍.短命植物生理生态特性对生境的适应性研究进展[J].草业学报,2010,19(1):240-247.
[21]路宁娜,崔现亮,王桔红,等.不同贮藏条件和光照对5种蒺藜科植物种子萌发的影响[J].中国沙漠,2008,8(6):1130-1135.
[22]Khan M A,Gulzar S.Light,salinity and temperature effects on the germination of perennial grasses[J].A-merican Journal of Botany,2003,90(1):131-134.
[23]李雪华,李晓兰,蒋德明,等.画眉草种子萌发对策及生态适应性[J].应用生态学报,2006,17(4):607-610.
[24]王云,唐书国,陈巧敏,等.土荆芥种子贮藏与萌发特性的研究[J].草业科学,2008,25(2):103-106.
[25]黄振英,Gutterman Y,胡正海.白沙蒿种子萌发特性的研究Ⅱ.环境因素的影响[J].植物生态学报,2001,25(2):240-246.
[26]Small J G C,Gutterman Y.Effect of sodium chloride on prevention of thermodormancy,ethylene and protein synthesis and respiration in Grand Rapids lettuce seeds[J].Physiologia Plantarum,1992,84:35-40.
[27]Sen Y,Chatterji F.Dormancy ofHordeumspontaneum caryopses from a population on the Negev Desert High lands[J].Journal of Arid Environments,1996,33:337-345.
[28]黄振英,张新时,Gutterman Y,等.光照、温度和盐分对梭梭种子萌发的影[J].植物生理学报,2001,27(3):275-280.
[29]康冰,陈彦生,张小红.GA3、6-BA及IAA对香椿种子发芽及幼苗生长的影响(简报)[J].植物生理学通讯,2001,37(5):399-400.
[30]朱霞,胡勇,王晓丽,等.几种植物生长调节剂对决明种子萌发及幼苗生长的影响[J].作物杂志,2010(1):46-48.

