脉冲噪声暴露后大鼠听皮层神经颗粒素的表达研究*
孙晓飞 廖华 杨琨 解为全
当外周听觉器官被噪声等外界因素损伤后,哺乳动物的内耳结构和功能发生变化的同时,听觉中枢以一种特殊的方式改变了其结构和功能,即发生了可塑性(plasticity)的改变或重组(reorganization)[1]。听觉中枢的可塑性一般始于耳蜗核(cochlear nucleus,CN),在下丘(inferior colliculus,IC)水平更为明显,在听皮层(auditory cortex,AC)最高。从脑的特异性蛋白来探讨脑相关部位的突触可塑性,是探讨可塑性的一个新方向。神经颗粒素(neurogranin,Ng)是突触后膜的一种特异性蛋白,是脑组织中蛋白激酶C 的作用底物,主要分布在大脑皮层、海马等区域的神经元胞体、树突和树突棘[2],目前国内外尚没有声损伤后其在听皮层表达的研究。本研究在脉冲噪声暴露动物模型的基础上[3],采用Western-blot方法观察脉冲噪声暴露后不同时段大鼠听皮层中Ng的表达,初步探讨脉冲噪声暴露对大鼠听皮层的影响及噪声暴露后听皮层可塑性相关蛋白质表达的变化。
1 材料与方法
1.1 实验动物及分组 SPF 级健康成年SD 雄性大鼠50只,体重180~200g,随机分成5 组,每组10只。其中4组大鼠行脉冲噪声暴露后分为暴露后3、7、14和28天组,10只未接受噪声暴露的大鼠设为正常对照组。
1.2 脉冲噪声模型的建立 脉冲噪声由电火花发生器(上海五角场仪表厂D286)产生。将SD 大鼠置于铁丝笼内,在大鼠清醒状态下在笼内用泡沫材料,将大鼠头部固定在距脉冲发声器管口水平40 cm 处。应用声级计(BK2209,丹麦)测量噪声强度,脉冲噪声平均压力峰值为156dB SPL,脉宽为0.25 ms,暴露次数为50 次,每次间隔6s,每次暴露1只,暴露操作在消声室自由场内进行。
1.3 主要试剂和仪器 Ng多克隆抗体、抗β-actin单克隆抗体、HRP 标记的羊抗兔IGg抗体均购于SantaCruz公司,BCA 蛋白定量试剂盒购于谷歌生物公司,ECL 发光液购于碧云天公司,PVDF 膜购于Pall公司。
1.4 ABR 反应阈检测 噪声暴露后各组动物均于噪声暴露前、暴露后即刻和暴露后3、7、14、28天行ABR 检测,正常对照组检测一次。用TDT(美国TDT 公司)记录各组动物双侧短音诱发的ABR。腹腔内注射水合氯醛麻醉动物(0.4 ml/100g),记录电极置于两耳廓前沿连线的中点,穿透颅骨至硬脑膜外,参考电极置于同侧耳垂,地线接鼻尖中央皮下。选用短音(tone pip,频率2~32kHz,上升、下降时间各1ms)作为刺激声,单耳给声刺激,强度范围为20~110dB SPL,衰减间隔5dB,叠加1 024次,分析时间为10ms。以ABR 波Ⅲ刚出现的刺激声强度定为反应阈。
1.5 大鼠听皮层Ng含量的表达检测 各组动物检测完ABR 后处死,开颅后在解剖显微镜下迅速分离听皮层。每两只大鼠两侧的听皮层作为一个样本,预冷三蒸水洗去血渍,液氮速冻后研磨成粉状。取50mg听皮层组织,加入750μl RIPA buffer,冰浴下匀浆,冰上放置30 min;并在4 ℃下,12 000 rpm 离心30 min,取上清进行BCA 法蛋白浓度测定,测定浓度后,剩余上清分装,-80 ℃冻存。
采用Western blot法检测大鼠听皮层Ng的含量,取样本加入上样缓冲液后进行电泳,转移至PVDF膜,以封闭液封闭2h后加入一抗(1:800),4 ℃下摇晃孵育过夜,TPBS 漂洗3 次,每次15 min;加入羊抗兔IgG 抗体(1:3 000),室温孵育2h;TPBS漂洗3次,每次15min。将PVDF 膜上加入ECL发光液,待反应1 min 后,放入胶片、显影、定影。Western blot胶片经Bio-Rad胶片扫描系统扫描后,用IMAGE J凝胶成像分析软件进行分析。蛋白表达水平以Ng光密度值与对应内参β-actin光密度值的比值表示。
2 结果
2.1 各组大鼠ABR 反应阈 因正常对照组与噪声暴露后各组暴露前ABR 反应阈无明显差异,故合并计算取均值作为正常对照组;各组噪声暴露后即刻ABR 反应阈也无明显差异,故也合并计算取均值。与噪声暴露前相比,暴露后大鼠各时间点各频率ABR 反应阈均明显提高,差异有统计学意义(P<0.05),其中高频阈移的幅度较低频阈移幅度大;噪声暴露后第7天,大鼠各频率ABR 反应阈有所恢复,第14天大鼠ABR 反应阈恢复明显,第28天大鼠ABR 反应阈与第14 天差异无统计学意义(P>0.05),但与暴露前相比,仍存在40~60dB的阈移(表1)。
表1 各组动物噪声暴露前后各频率ABR 反应阈(dB SPL,±s)
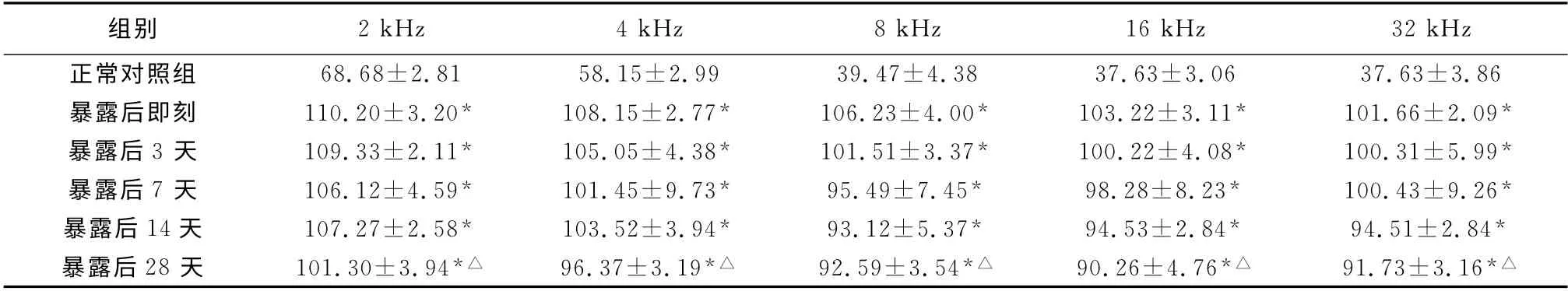
表1 各组动物噪声暴露前后各频率ABR 反应阈(dB SPL,±s)
注:*与正常对照组相比,P<0.05;△与暴露后即刻阈值相比,P<0.05
组别2kHz 4kHz 8kHz 16kHz 32kHz正常对照组68.68±2.81 58.15±2.99 39.47±4.38 37.63±3.06 37.63±3.86暴露后即刻110.20±3.20*108.15±2.77*106.23±4.00*103.22±3.11*101.66±2.09*暴露后3 天109.33±2.11*105.05±4.38*101.51±3.37*100.22±4.08*100.31±5.99*暴露后7 天106.12±4.59*101.45±9.73*95.49±7.45*98.28±8.23*100.43±9.26*暴露后14天107.27±2.58*103.52±3.94*93.12±5.37*94.53±2.84*94.51±2.84*暴露后28 天101.30±3.94*△96.37±3.19*△92.59±3.54*△90.26±4.76*△91.73±3.16*△
2.2 脉冲噪声暴露前后大鼠听皮层Ng表达的变化 正常对照组及噪声暴露后3、7、14、28天组大鼠听皮层Ng光密度值分别为0.68±0.08、0.96±0.05、1.11±0.05、0.78±0.04、0.36±0.03,通过Western blot检测结果显示:与正常对照组比较,噪声暴露后3、7、14、28天Ng表达的差异有统计学意义(P<0.05)。可见,脉冲噪声暴露后Ng在听皮层的表达呈先上升后降低的过程:与对照组相比,在噪声暴露后第3天Ng的表达明显上升,在第7天达到峰值,随后开始下降,第28天与第14天相比有明显的降低,与暴露前相比,第14天Ng表达仍高于对照组,而第28天Ng表达低于对照组(图1)。
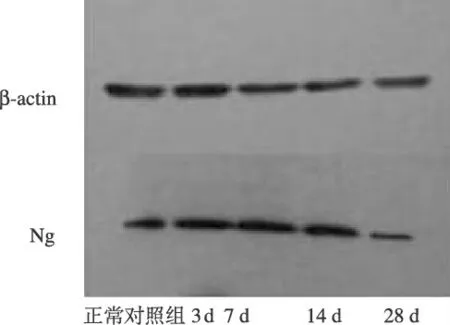
图1 各组大鼠听皮层Ng的表达
3 讨论
Ng分布在大脑皮层、海马、杏仁核和纹状体等脑区的神经元胞体、树突、树突棘,以及线粒体膜、内质网、高尔基体周围[2,4],是神经元特异性的突触后膜蛋白。正常状态下,Ng 与钙结合蛋白结合形成复合体,当神经冲动引起N-甲基-D-天冬氨酸受体(N-methyl- D-aspartate receptor,NMDAR)活化,导致NMDAR 偶联的Ca2+通道开放时,细胞内Ca2+浓度升高,Ng与钙结合蛋白复合体解离,细胞内的Ca2+与钙结合蛋白复合体浓度增加,进而激活Ca2+和钙结合蛋白依赖性酶,如钙结合蛋白依赖性蛋白激酶Ⅱ等的活性,这些酶大都参与长时程增强(long term potentiation,LTP)的诱导和维持[5,6],而LTP 和长时程抑制(longterm depression,LTD)是突触可塑性最经典的机制之一,因此认为Ng在突触可塑性中发挥着重要的作用。Ng在突触可塑性中的作用依赖于其在突触后结合钙调蛋白(calmodulin,CaM)的能力,通过调节局部CaM 的活性和控制突触后Ca2+/CaM 比值的变化,影响突触的传递[7]。Zhong[8]的研究表明Ng 在CA1区的过表达,会增强突触后的敏感性和促进递质的释放;而内源性Ng在原位表达的停滞会阻碍LTP的诱发。Zhabotinsky[9]发现由突触后显微注射Ca2+/CaM 可以诱发类似Ng引起的突触活动增强反应,由此可以认为Ng诱发的突触增强与CaM增多有关。而听觉中枢的突触可塑性在听觉处理过程中的重要性越来越受到关注[10]。因此,本研究通过观察噪声暴露后不同时期听皮层Ng 表达的变化,试图揭示噪声暴露后听皮层突触可塑性的改变。
本实验先采用脉冲噪声暴露建立去传入听觉损伤的动物模型,结果显示,噪声暴露后不同时期大鼠各频率ABR 反应阈均明显提高,但自第7天开始,各频率ABR 反应阈有所恢复;而噪声暴露后第3天Ng的表达即有一个明显的上升过程,在第7天达到峰值,随后开始下降,第28天与第14天相比有明显的降低,说明噪声暴露后Ng在大鼠听皮层的表达呈一个先上升后降低的过程,提示脉冲噪声刺激对大鼠听觉系统产生了有一定持续性的显著影响,其中听皮层在脉冲噪声暴露早期即出现突触可塑性变化,在噪声暴露后第7天Ng表达达到峰值,这可能是由于持续的噪声刺激使细胞内谷氨酸的释放增加,引起NMDAR 大量激活并与Ca2+通道相偶联,进而引起Ca2+内流[11,12],Ng 与CaM 的分离,使Ng的表达升高;此后听皮层Ng表达开始下降,到噪声暴露后28天甚至低于对照组,Ng表达显著降低的原因,一方面可能是脉冲噪声暴露通过各种机制导致了相关神经元的死亡,进而引起后期Ng表达的降低;另一方面,有研究显示Ng的变化是机体调控LTP与LTD 之间平衡,并在突触重塑期间维持神经元功能的方式[13]。因此,Ng表达下降可能是听皮层对于噪声刺激的一种抑制性自我保护机制。
综上所述,本实验通过噪声暴露后听皮层Ng表达的变化,提示噪声暴露后听皮层存在突触可塑性改变,在进一步研究中,将通过电生理实验,揭示脉冲噪声暴露后听觉中枢Ng及突触可塑性变化的具体机制及其病理生理意义。
1 钱敏飞,杨军,金西铭,等.药物性聋和噪声性聋后听觉中枢可塑性的研究进展[J].临床耳鼻咽喉科杂志,2004,18:63.
2 Watson JB,Battenberg EF,Wong KK,et al.Subtractive cDNA cloning of RC3,a rodent cortex-enriched mRNA encoding a novel 78residue protein[J].J Neurosci Res,1990,26:397.
3 廖华,郜元坤,华清泉,等.脉冲噪声暴露后大鼠频率特异性听性脑干反应变化特点及意义[J].听力学及言语疾病杂志,2011,19:56.
4 Represa A,Deloulme JC,Sensenbrenner M,et al.Neurogranin:immunocytochemical localization of a brain-specific protein kinase C substrate[J].J Neurosci,1990,10:3 782.
5 Ramakers G,Heinen K,Gispen W,et al.Long term depression in the CA1field is associated with a transient decrease in pre-and postsynaptic PKC substrate phosphorylation[J].J Biol Chem,2000,275:28 682.
6 van Dam EJ,Ruiter B,Kamal A,et al.N-methyl-D-aspartate-induced long-term depression is associated with a decrease in postsynaptic protein kinase C substrate phosphorylation in rat hippocampal slices[J].Neurosci Lett,2002,320:129.
7 Kubota Y,Putkey JA,Waxham MN.Neurogranin controls the spatiotemporal pattern of postsynaptic Ca2+/CaM singnaling[J].Biophys J,2007,93:3 848.
8 Zhong L,Cherry T,Bies CE,et al.Neurogranin enhances synaptic strength though its interaction with calmodulin[J].EMBO J,2009,28:3 027.
9 Zhabotinsky AM,Camp RN,Epstein IR,et al.Role of the neurogranin concentrated in the induction of long-term potentiation[J].J Neurosci,2006,26:7 337.
10 Bender KJ,Trussell LO.Synaptic plasticity in inhibitory neurons of the auditory brainstem[J].Neuropharmacology,2011,60:774.
11 Chertoff ME,Yi X,Lichtenhan JT.Influence of hearing sensitivity on mechano-electric transduction[J].J Acoust Soc Am,2003,114(6Pt 1):3 251.
12 Ehrenberger K,Felix D.Glutamate receptors in afferent cochlear neurotransmission in guinea pigs[J].Hear Res,1991,52:73.
13 Zhong L,Gerges NZ.Neurogranin and synaptic plasticity balance[J].Commun Integr Biol,2010,3:340.

