血浆1,3-β-D 葡聚糖检测对儿童侵袭性真菌感染诊断价值
张晓艳 董 方 赵顺英 徐樨巍
近年儿童侵袭性真菌感染(IFI)的发病率呈上升趋势。殷菊等[1]报道首都医科大学附属北京儿童医院(我院)1983 至1999 年1 000 例尸检病例中深部真菌感染18 例(1.8%),其中1983 至1996 年深部真菌感染占1.4%,而1997 至1999 年为14%。IFI 的临床表现不典型,影像学表现对诊断虽有一定的提示意义,但无特异性。传统的真菌感染的诊断方法包括真菌培养及病理活检,但真菌培养敏感度低,仅6.0% ~50.0%,且所需时间长[2,3]。组织病理学检查是诊断IFI 的金标准,由于其为有创性操作,在儿童中往往难以进行。因此探讨早期、可靠的非侵袭性诊断方法已成为临床的迫切需求。近年来国内外研究较多并已在临床应用的主要有血浆1,3-β-D 葡聚糖(BG)检测(G 试验)和血清半乳甘露聚糖检测(GM 试验)。BG 是真菌细胞壁的重要组成成分之一,广泛存在于除接合菌以外的真菌细胞壁中,在真菌进入血液或深部组织后,BG 可从胞壁释放入血液和其他体液,使其含量增高而被检测出来,而在真菌定植和浅表真菌感染时则极少释放入血[4],因此理论上血浆BG 检测可用于多种IFI 的诊断。本研究回顾性分析我院行G 试验患儿的临床资料,以评价G 试验对儿童IFI的诊断价值。
1 方法
1.1 IFI 诊断标准[5]①确诊:组织病理学检查发现真菌,无菌组织培养发现真菌;②临床诊断:有IFI 宿主/环境因素、临床及影像学表现,并有临床诊断意义的微生物学依据;③拟诊:具有IFI 宿主/环境因素、临床及影像学表现,无微生物学依据。
1.2 病例纳入和排除标准 ①我院呼吸科、感染科或重症监护病房住院患儿;②抗生素应用时间>10 d,伴发热;③行G 试验者;④排除拟诊IFI 者。
1.3 临床资料提取 ①一般情况:年龄、性别;②细菌学检查:痰和(或)支气管肺泡灌洗液培养及涂片,和(或)血培养、尿、便、胸腔积液、腹水、脑脊液和PICC 管端培养及涂片;③病理学检查;④G 试验结果;⑤诊断。
1.4 分组 根据IFI 诊断标准,将研究对象分为IFI 组(确诊和临床诊断IFI)和非IFI 组。
1.5 G 试验 无热源抗凝采血管静脉取血2 ~3mL。G 试验采用GKT-5M Set 动态真菌检测试剂盒(北京金山川科技发展有限公司),检测结果由MB-80 微生物动态检测系统自动计算出待测血清中BG 浓度。操作严格按照试剂盒说明书进行。参照试剂盒说明书的标准范围,G 试验阳性定义为血浆中BG 浓度≥10 pg·mL-1。
1.6 统计学分析 采用SPSS 11.5 软件进行统计分析。正态分布资料以±s 表示,非正态分布资料以中位数(全距)表示。采用四格表计算G 试验诊断IFI 的敏感度、特异度、阳性预测值和阴性预测值。诊断参数的计算公式参见文献[6]。对G 试验结果绘制受试者特征工作曲线(ROC曲线),并计算曲线下面积。
2 结果
2.1 一般情况 2008 年1 月至2011 年8 月共有525 例患儿行G 试验,排除拟诊IFI 者129 例,最终396 例患儿纳入分析。IFI 组43 例,其中确诊9 例,临床诊断34 例。男28例,女15 例,年龄18 d 至13 岁,平均4.8 岁。念珠菌感染21 例,其中白色念珠菌感染18 例(白色念珠菌脑膜炎4例,肺部感染12 例,白色念珠菌肠炎2 例),光滑念珠菌感染2 例(肺部感染1 例,光滑念珠菌血症1 例),肺热带念珠菌感染1 例;侵袭性肺曲霉病(IPA)14 例;隐球菌感染5例,其中全身播散性隐球菌病1 例,肺隐球菌病合并隐球菌脑膜炎2 例,纵隔淋巴结隐球菌病2 例;肺马尼菲青霉病2例;肺毛霉病1 例。
非IFI 组353 例,均未予抗真菌治疗,病情完全缓解。男199 例,女154 例,年龄1 个月至14 岁,平均5.3 岁。
2.2 G 试验结果 IFI 组在行G 试验前10 d 内均未使用IVIG 和白蛋白等血制品,均未行血液透析。IFI 组G 试验阳性31/43 例,阳性率为72.1%,平均血浆BG 浓度为56.7(12.1 ~3 498.0)pg·mL-1;G 试验阴性12/43 例,假阴性率为27.9%。不同真菌感染组G 试验结果见表1。
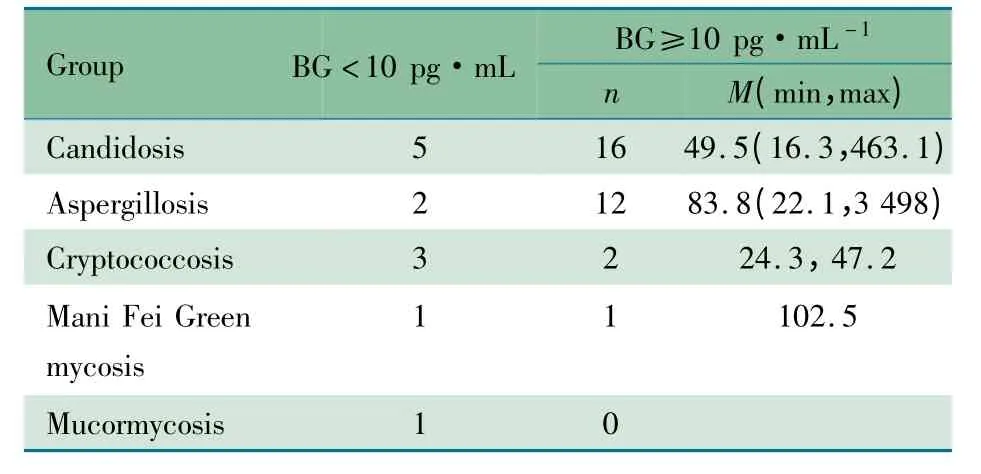
表1 不同真菌感染G 试验结果(n)Tab 1 G test results of different fungal groups(n)
非IFI 组G 试验阳性48/353 例,假阳性率为13.6%,平均血浆BG 浓度为26.1(10.3 ~2 529.0)pg·mL-1。48例G 试验阳性患儿中:①15 例在取血前12 h 至11 d 曾应用IVIG,其中3 例连续3 d 应用IVIG(400 mg·kg-1·d-1)后12 ~24 h 检测血浆BG 浓度分别为70.7、114.6 和419.5 pg·mL-1,7 d 后复查分别为<10、23.6 和56.9 pg·mL-1。2 例分别在G 试验前2、5 d 应用白蛋白,其血浆BG 浓度分别为124. 8 和24. 9 pg·mL-1,7 d 后复查均<10 pg·mL-1。2 例因病情需要先后予IVIG、白蛋白、血浆和红细胞悬液等支持治疗,血浆BG 浓度分别为195. 4 和48. 2 pg·mL-1,7 d 后复查分别为13.6 和<10 pg·mL-1;②卡氏肺孢子菌肺炎2 例,血浆BG 浓度分别为63.8 和40.2 pg·mL-1,1 例10 d 后复查<10 pg·mL-1,伴临床症状好转;1 例未复查;肺吸虫病1 例,血浆BG 浓度为254.7 ~2 529.0 pg·mL-1;③细菌感染14 例,其中肺炎链球菌肺炎4 例(1 例合并铜绿假单胞菌感染)、金黄色葡萄球菌肺炎2 例、化脓性链球菌肺炎1 例、铜绿假单胞菌脓毒症1例、PICC 管端培养示凝固酶阴性葡萄球菌1 例、痰培养示大肠埃希菌2 例、细菌性肺炎3 例(病原菌不明)。血浆BG浓度为26.2 ~89.8 pg·mL-1,8 例3 ~7 d 后复查<10 pg·mL-1;④支原体肺炎9 例,血浆BG 浓度为14.6 ~41.3 pg·mL-1,其中6 例2 ~7 d 后复查<10 pg·mL-1;⑤EB病毒感染2 例,1 例血浆BG 浓度为14.2 pg·mL-1;1 例为64.9 pg·mL-1,2 d 后复查为12.2 pg·mL-1;CMV 感染1例,血浆BG 浓度为24.3 pg·mL-1,7 d 后复查<10 pg·mL-1。
2.3 G 试验诊断IFI 的敏感度和特异度 根据四格表计算G 试验诊断儿童IFI 的敏感度为72. 1%,特异度为86.4%,阳性预测值为39.2%,阴性预测值为96.2%。不同阳性界值G 试验诊断IFI 的敏感度和特异度见表2。
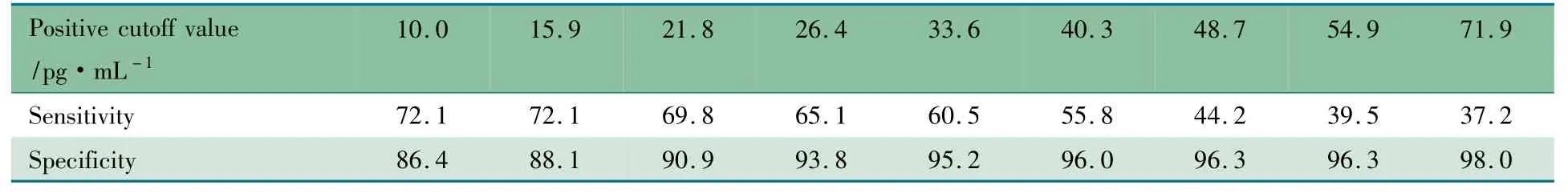
表2 不同阳性界值G 试验诊断儿童IFI 的敏感度和特异度(%)Tab 2 Sensitivity and specificity of the G test at different positive cutoff value(%)
2.4 G 试验诊断IFI 的ROC 曲线 根据G 试验结果绘制ROC 曲线(图1),曲线下面积为0.815(95%CI:0.732 ~0.898)。

图1 G 试验诊断儿童IFI 的ROC 曲线Fig 1ROC curve of G test to predict invasive fungal infection
3 讨论
G 试验对IFI 的诊断有着较好的敏感度和特异度。Obayashi 等[7]报道G 试验诊断IFI 的敏感度和特异度分别高达90%和100%,另有研究[8~10]显示G 试验诊断IFI 的敏感度和特异度分别为27% ~86.5%和75% ~93.8%。本研究以血浆BG 水平单次≥10 pg·mL-1判定G 试验阳性,结果显示G 试验诊断儿童IFI 的敏感度、特异度、阳性预测值和阴性预测值分别为72. 1%、86. 4%、39. 2% 和96.2%。对G 试验结果行ROC 曲线分析,曲线下面积为0.815,提示G 试验对儿童IFI 的诊断价值处于较好的水平。
本研究结果显示,念珠菌感染患儿中16/21 例G 试验阳性,曲霉菌感染中12/14 例阳性,而隐球菌感染中仅2/5例阳性,且血浆BG 浓度仅轻度升高(<60 pg·mL-1),1例毛霉菌感染患儿G 试验阴性,提示G 试验主要用于检测侵袭性念珠菌和曲霉菌感染,与文献报道一致,可能与接合菌属孢壁中不含BG,而隐球菌具有厚壁荚膜,不利于吞噬细胞的吞噬和BG 的释放有关[11]。此外假阴性结果考虑主要与宿主预防性或经验性抗真菌治疗有关。
虽然本研究结果及多项相关研究均显示了G 试验有较好的特异度,但在临床上许多因素可引起G 试验假阳性。文献报道[12~14]在重症监护病房住院时间超过14 d 的患者多伴有不同程度血浆BG 浓度升高,而这些患者并不一定为IFI;某些细菌感染,如金黄色葡萄球菌、肺炎链球菌感染以及凝固酶阴性的葡萄球菌脓毒症时可能出现G 试验假阳性结果。本研究4 例肺炎链球菌肺炎、2 例金黄色葡萄球菌肺炎及1 例PICC 管端培养示凝固酶阴性葡萄球菌患儿G 试验呈假阳性。同时本研究中部分支原体、EB病毒感染患儿G 试验亦呈阳性,但血浆BG 浓度多为轻度升高,且7 d 后复查多已转阴性,考虑可能与感染本身、使用某些抗生素治疗(如阿莫西林克拉维酸钾、头孢吡肟)或污染有关。若适当提高G 试验诊断界值可很大程度消除这些非特异因素引起的假阳性。
关于肺孢子菌的生物学分类,近年来研究发现肺孢子菌基因及编码的蛋白均与真菌非常接近,因此从分子水平支持肺孢菌归属于真菌的学说。Yasuoka 等[15]分析BG 可能从肺孢菌的囊壁释放进入肺泡腔内,并通过肺泡毛细血管进入到血液中。本研究2 例卡氏肺孢子菌肺炎患儿血浆BG 浓度亦轻度升高,1 例肺吸虫病患儿的不同时间3 份标本均显示血浆BG 浓度升高明显,目前尚未见关于肺吸虫引起假阳性报道。
值得注意的是,本研究中除上述非特异因素引起的假阳性外,静脉应用IVIG 和白蛋白等血制品是引起假阳性的一个主要原因,且其血浆BG 浓度较高(>70 pg·mL-1)。文献报道[16]IVIG 10 g 可使血浆BG 浓度升高达300 pg·mL-1以上,这足以误诊为IFI。血浆BG 的平均半衰期为20(3.1 ~181.3)h[17],推断在1 周后复查BG 浓度应明显下降或转阴,可作为与IFI 的鉴别。此外可引起G 试验假阳性结果的因素还有应用纤维素膜进行血液透析,抗肿瘤药物中的蘑菇葡聚糖、K 多聚糖等。
G 试验对儿童IFI 具有中等水平诊断价值。连续行G试验检测(≥2 次)并结合临床及影像学表现,可很大程度消除假阳性。
[1]Yin J(殷菊),Shen KL,He LJ,et al. Autopsy-confirmed deep fungal infection in chidren:analysis of 18 cases. Chin J Pediatr(中华儿科杂志),2001,39(5):300-303
[2]Jin XH(靳秀红),Tang Y,Jin ZP,et al. 呼吸科与ICU 病房肺炎患儿痰真菌培养结果分析. Journal of Chinese Practical Diagnosis and Therapy(中华实用诊断与治疗杂志),2011,25(5):517-518
[3]Singhi SC,Reddy TC,Chakrabarti A. Oral ittaconazole in treatment of candidemia in a pediatric intensive care unit.Indian J Pediatr,2004,71(11):973-977
[4]Yoshida M,Roth RJ,Grunfeld C,et al. Soluble (1->3)-beta-D-glucan purified from Candida albicans:biologic effects and distribution in blood and organs in rabbits. Lab Clin Med,1996,128(1):103-114
[5]Huang XJ(黄晓军),Shen ZX,Wang AX,et al. 血液病/恶性肿瘤患者侵袭性真菌感染的诊断标准与治疗原则(草案). Chin J Intern Med(中华内科杂志),2005,44(7):554-556
[6]王家良,主编.临床流行病学——临床科研设计,测量与评价.第3 版.上海:上海科学技术出版社,2009.312-314
[7]Obayashi T,Yoshida M,Mori T,et al. Plasma (1->3)-βglucan measurement in diagnosis of invasive deep mycosis and fungal febrile episodes. Lancet,1995,345(8941):17-20
[8]Kami K,Kanda Y,Ogawa S,et al. Frequent false-positive results of aspergillus latex agglutination test. Cancer,1999,86(2):274-281
[9]Kawayama T,Oizumi K. Clinical features of deep mycosis in critical care center:Comparison of serological tests and cultures for mycosis. Kansenshogaku Zasshi,1999,73(8):743-748
[10]Mori T,Matsumura M. Clinical evaluation of diagnostic methods using plasma and/or serum for three mycoses:Aspergillosis,candidosis,and pneumocytosis. Nippon Shinkin Gakkai Zasshi,1999,40(4):223-230
[11]Ostrosky-Zeichner L, Alexander BD, Kett DH, et al.Multicenter clinical evaluation of the (1->3)beta-D-glucan assay as an aid to diagnosis of fungal infections in humans. Clin Infect Dis,2005,41(5):654-659
[12]Digby J,Kalbfleisch J,Glenn A,et al. Serum glucan levels are not specific for presence of fungal infections in intensive care unit patients. Clin Diagn Lab Immunol,2003,10(5):882-885
[13]Pickering J,Sant H,Bowles C,et al. Evaluation of a(1->3)-beta-D-glucan assay for diagnosis of invasive fungal infections. J Clin Microbiol,2005,43(12):5957-5962
[14]Racil Z,Komcanova Z,Lengerova M,et al. Difficulties in using 1,3-β-d-glucan as the screening test for the early diagnosis of invasive fungal infections in patients with haematological malignancies-high frequency of false-positive results and their analysis. J Med Microbiol,2010,59(9):1016-1022
[15]Yasuoka A,Tachikawa N,Shimada K,et al. (1->3)beta-Dglucan as a quantitative serological marker for Pneumocystis carinii pneumonia. Clin Diagn Lab Immunol,1996,3(2):197-199
[16]Usami M,Ohata A,Horiuchi T,et al. Positive (1->3)-beta-D-glucan in blood components and release of (1->3)-beta-Dglucan from depth-type membrane filters for blood processing.Transfusion,2002,42(9):1189-1195
[17]Kanda H,Kubo K,Hamasaki K,et al. Influence of various hemodialysis membranes on the plasma (1->3)-beta-D-glucan level. Kindny Int,2001,60(1):319-323

