氯消毒新工艺对大肠杆菌灭活作用的研究
王云
(五洲富士化水工程有限公司,北京100052)
氯消毒新工艺对大肠杆菌灭活作用的研究
王云
(五洲富士化水工程有限公司,北京100052)
研究了短时游离氯后转氯胺的联合消毒方法对大肠杆菌的灭活作用,并对其协同作用以及pH值和温度对协同作用的影响进行了探讨。结果表明:pH值在6.5~8范围内,温度不超过30℃时,短时游离氯后转氯胺的消毒方法对大肠杆菌的灭活具有协同作用,且随pH值的降低而加强,在低温下该方法的协同效果更加明显。
饮用水;游离氯;氯胺;大肠杆菌;协同作用
由于饮用水传统的加氯消毒工艺容易产生三卤甲烷 (THMs) 、 卤乙酸 (HAAs) 等具有致癌风险的副产物,因此,近年来生成副产物量较少、衰减速率较慢的氯胺消毒工艺在国内外得到了广泛的应用。但是氯胺的杀菌作用较游离氯低,因此,为了确保微生物安全性和降低饮用水的致癌风险,寻求新的、安全高效的饮用水消毒方法意义重大。
短时游离氯后转氯胺是一种在消毒初期经过较短时间的游离氯消毒后加入铵盐或氨反应,将游离氯转化为化合氯的新的氯消毒工艺。该工艺的目的是为了综合利用游离氯短时高效杀菌作用和氯胺的持续稳定的杀菌作用,同时抑制消毒副产物的生成。笔者研究了该消毒方法对大肠杆菌的灭活作用,利用Berenbaum公式评价了联合消毒工艺的消毒效果。1 试验材料和方法
1.1 消毒剂配制和滴定
试验消毒剂采用2种材料配制,游离氯消毒剂主要成分为HOCl和OCl-,使用浓度大于5%的NaClO溶液配制。氯胺的生成采用游离氯与(NH4)2SO4在碱性条件下 (pH=9) , 低温 (1 ℃)搅拌反应0.2 h配制,氯氮比为4。游离氯和化合氯浓度的测试采用传统的DPD(N,N-二乙基对苯二胺-硫酸亚铁铵) 滴定法滴定。
1.2 微生物菌液配制
大肠杆菌是饮用水微生物学关键指标,用于表征水体受生活污水的污染情况。因此试验采用大肠杆菌作为指示微生物。含大肠杆菌水样的制备遵循传统微生物学试验方法。试验用大肠杆菌首先在琼脂培养基上复壮,复壮后使用接种环挑取培养基上菌落接种于营养肉汤培养液中。营养液经24 h37℃恒温培养后,形成悬浮菌液,然后使用高速离心机在4 000转/min的转速下离心分离10min。固液分离后,取固体沉淀物,稀释于无菌缓冲液中(PBS),稀释后溶液细菌浓度控制在 1×103~1×104个/μl, 大肠杆菌的计数方法采用滤膜菌落计数法。
1.3 试验方法
1.3.1 消毒剂独立消毒
按照上述方法配制好试验用菌液后,投加有效氯浓度不同的消毒剂,在设定不同反应时间后,分别取10 ml样品,立即加入100μl还原剂,终止消毒剂的反应,然后采用滤膜菌落计数法测定样品中的大肠杆菌数量。还原剂采用0.01 mol/L的硫代硫酸钠溶液。
1.3.2 游离氯转氯胺联合消毒
在人工污染水样中先加入一定量的游离氯,作用5min后加入略过量的硫酸铵溶液(Cl2∶N=4∶1),形成一氯胺,消毒剂由短时游离氯改为一氯胺,作用不同时间后终止。
1.4 灭活效果评价方法
1.4.1 细菌存活率
细菌存活率计算采用对数值:S=lg(Nt/N0)。
公式中N0表示配制菌液在投加消毒剂前的初始细菌数量;Nt表示投加消毒剂并作用某段时间后菌液中仍然存活的细菌数量;S表示存活率。
1.4.2 联合灭活效果
游离氯转氯胺消毒过程中涉及到两类消毒剂,因此在考察两类消毒剂单独灭活大肠杆菌效果的基础上,研究两类消毒剂先后使用是否存在联合消毒作用是本研究需要重点分析的内容。目前国内外评价消毒剂联合作用效果的方法常采用由Berenbaum[1~2]提出的评价模型,该模型可以用来判断游离氯后转氯胺工艺中游离氯和氯胺之间的作用关系。
Berenbaum模型认为,当混合消毒剂中各类消毒剂之间不存在拮抗或协同的作用效果时,无论消毒剂浓度作用时间设定为多少,都将满足下述公式:
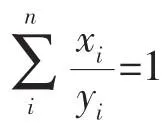
式中:x表示混合消毒剂在某种消毒效果时各类消毒剂的浓度;
Y表示各类消毒剂独立作用产生与上述混合消毒剂同样效果时的浓度;
i表示各类消毒剂组分;
n表示消毒剂的数量。
当该式计算结果小于1时,说明消毒剂之间产生了协同作用;如果计算结果大于1则产生了拮抗作用;计算结果等于1则表示产生了简单的相加作用。
除Berenbaum模型评价联合消毒效果的方法以外,国外也采用细菌灭活率来评价联合消毒方法中各类消毒剂能否产生协同效果[3]。该类方法的基本原理是:联合消毒如果存在协同消毒作用,就应该可以产生比各类消毒剂独自投加所能达到的细菌灭活率之和更高的效果。通常将协同效果定义为联合消毒作用下的细菌灭活率与独立消毒剂消毒细菌灭活率之和的差值。计算公示描述如下:
协同灭活效果=Ir-(Ir1+Ir2)
式中:Ir表示联合消毒的细菌灭活率;
Ir1、Ir2表示各类消毒剂单独的细菌灭活率;细菌灭活率的单位均为log。
2 结果与讨论
2.1 自由氯、氯胺单独灭活效果
从图中可看出,游离氯在较短时间内(20min左右) 即可达到很好的灭活效果,但之后便无明显下降,而氯胺需要在较长的时间才能达到相同的灭活效果,但可维持较长时间的灭活作用,因而能够有效地控制残余细菌的再繁殖。
2.2 短时游离氯和氯胺联合灭活效果
图3为游离氯、氯胺单独灭活和联合灭活大肠杆菌效果比较。从图中可以看出,联合消毒10min时,即2mg/L的游离氯作用 5min后转2mg/L氯胺作用5min时,存活率为-6.961 4(或 N/N0=1.092×10-7,100%灭活), 将 5min灭活率达-6.961 4作为推算Berenbaum公式中yi的参照标准。利用图1和图2中的数据,计算游离氯和氯胺作用5min时,消毒剂浓度与大肠杆菌存活率之间的回归方程,利用线性插值法推算出y1=4.703mg/L(游离氯),y2=12.066mg/L(氯胺),据Berenbaum公式计算出:
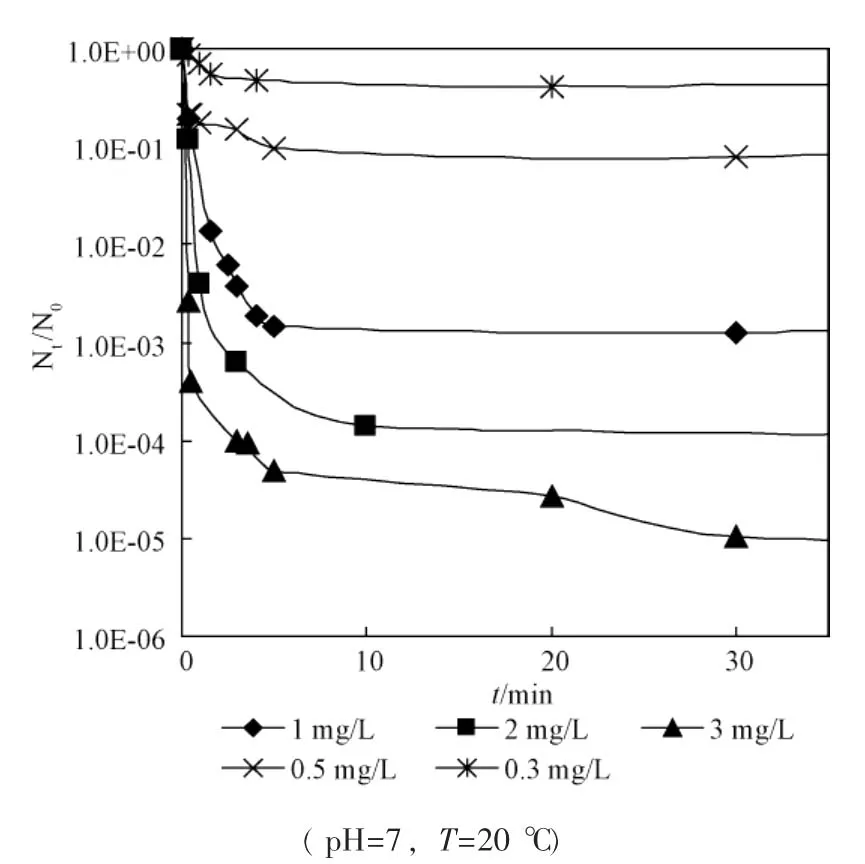
图1 不同浓度的游离氯对大肠杆菌的灭活曲线
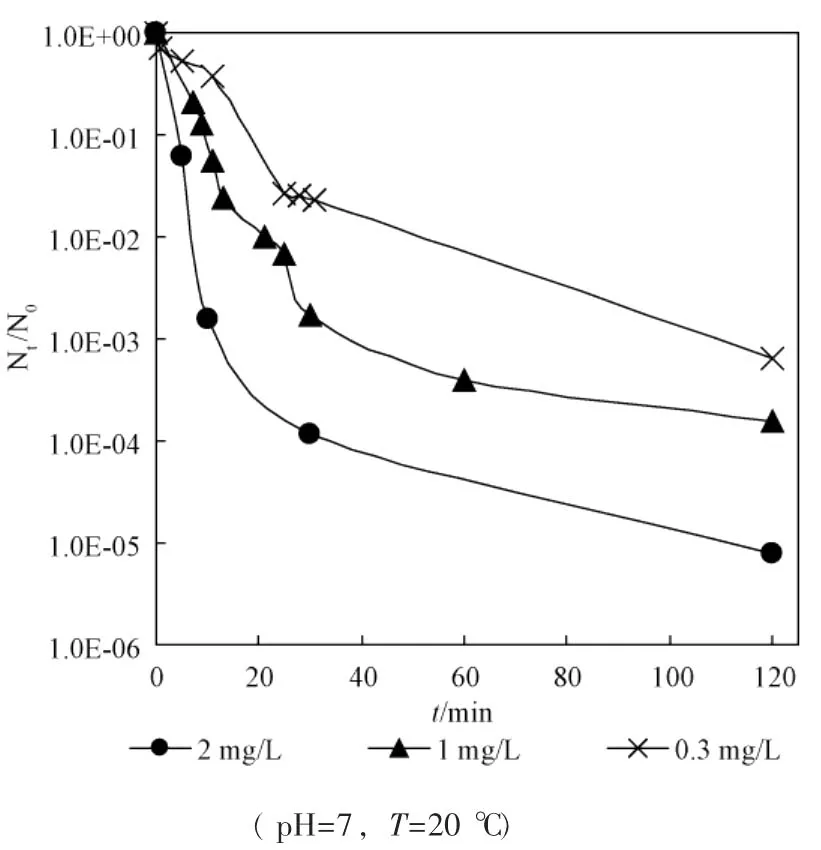
图2 不同浓度的一氯胺对大肠杆菌的灭活曲线
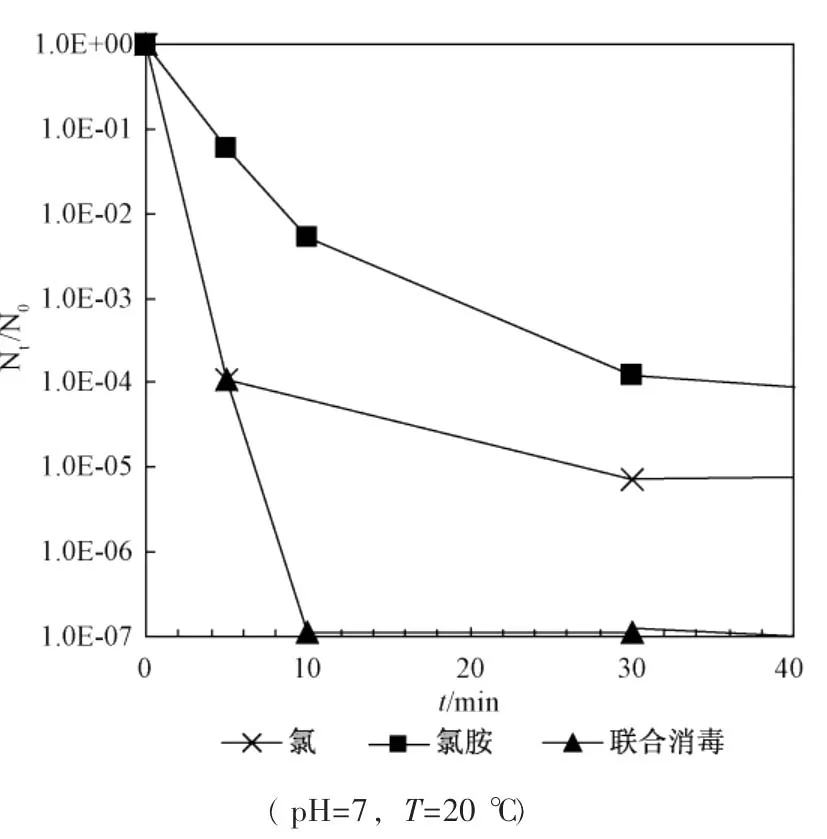
图3 游离氯、氯胺单独灭活大肠杆菌效果比较
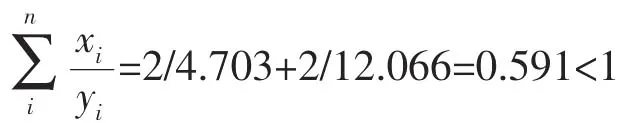
说明5min短时游离氯后转氯胺对大肠杆菌具有协同灭活作用。
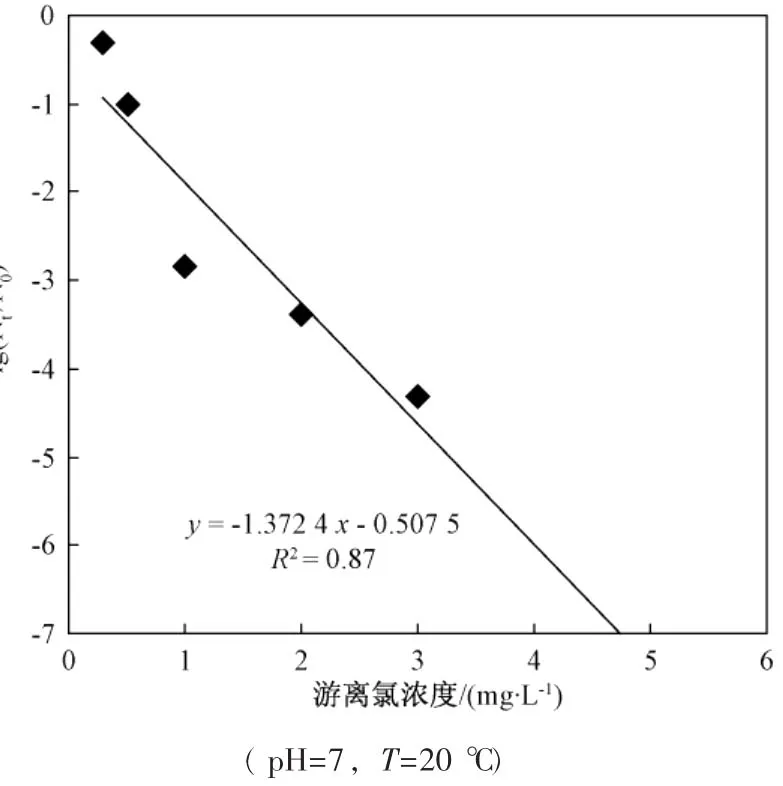
图4 游离氯浓度与大肠杆菌存活率关系
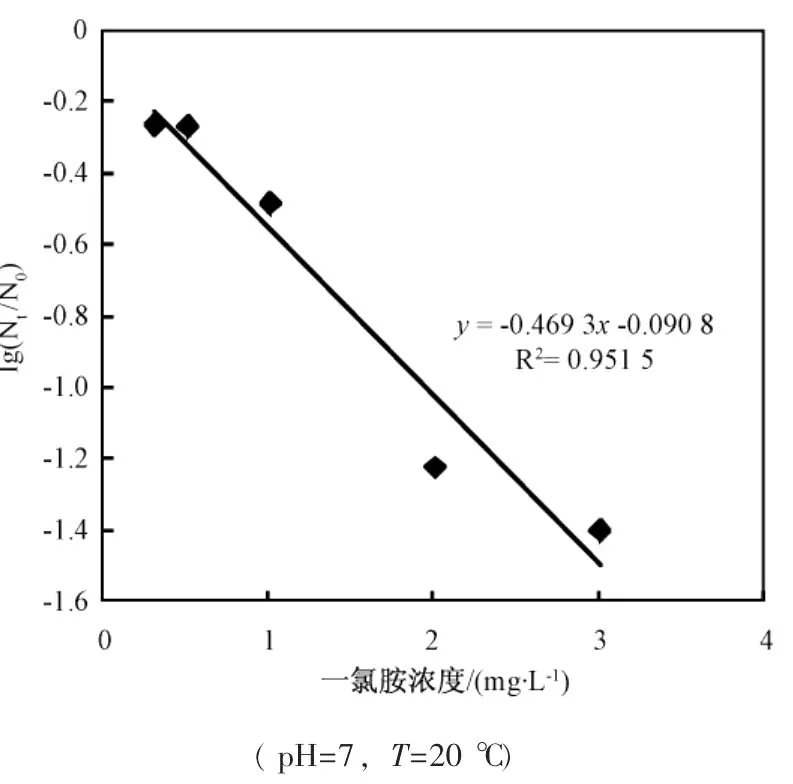
图5 一氯胺浓度与大肠杆菌存活率关系
利用另一种协同作用判定方法:协同灭活效果=Ir-(Ir1+Ir2) 进行判定,结论完全一致。其中在10min消毒作用时间的条件下,游离氯后转氯胺消毒的细菌存活率为-7.0(最低)、单独游离氯消毒的细菌存活率为-4.0(其次)、单独一氯胺消毒的细菌存活率为-1.1(最高,效果最差),因此得协同灭活效果为1.9,意味着存在协同灭活作用,使得细菌灭活率提高了1.9 log。
2.3 pH值和温度对协同效果的影响
在pH值不同的条件下,游离氯和氯胺均表现出不同的电离特性,因此pH值对游离氯后转氯胺灭活大肠杆菌的协同效果会产生一定的影响,主要数据详见表1。试验发现,菌液pH值在6~8范围内时,随着溶液pH值的降低,游离氯和氯胺独立消毒的效果增强,但是联合灭菌消毒的协同效果逐渐减弱,在pH=6时表现为拮抗作用。
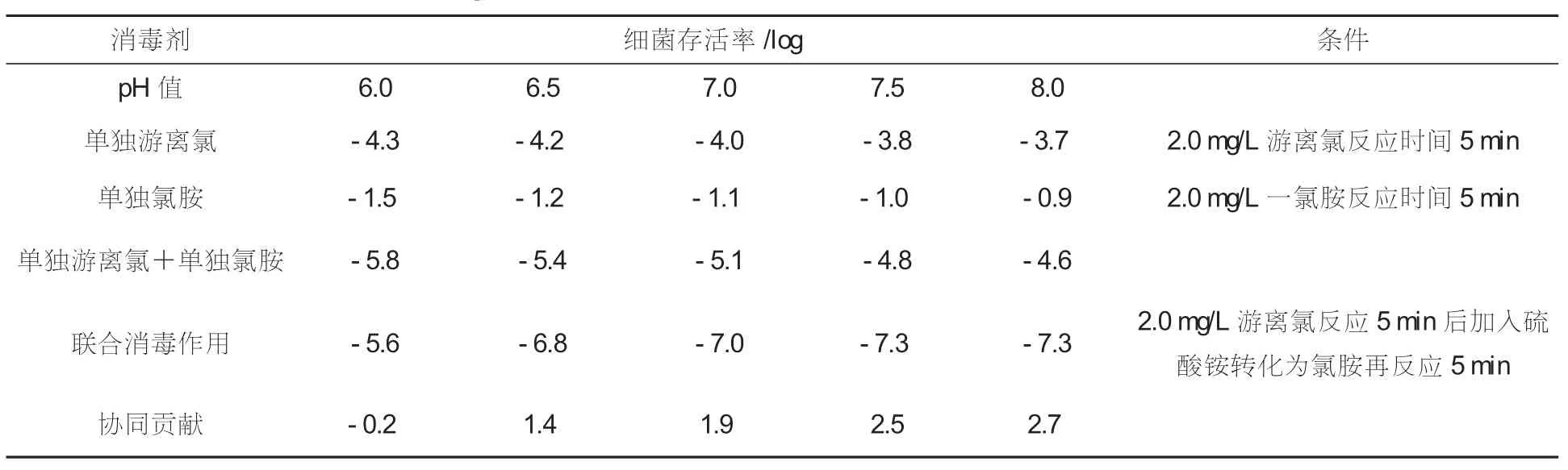
表1 pH值对短时游离氯后转氯胺灭活大肠杆菌协同效果的影响
因游离氯 (HOCl/OC-) 中的次氯酸分子(HOCl) 对埃希式大肠杆菌的消毒效果约为次氯酸根 (OCl-) 的80~100倍[4]。 故随着pH值升高,次氯酸离解为次氯酸根的程度增大,其消毒效果降低。氯胺消毒具有与次氯酸消毒相同的特性。
在5min短时游离氯作用之后,加入略过量的硫酸铵溶液 (Cl2∶N=4∶1) 形成一氯胺。 一氯胺生成的过程受pH值的影响[5],pH值为7.0~8.5是其生成的最佳范围,当pH=6时,由于形成的一氯胺不够多,所以在pH=6时的联合消毒外在表现为拮抗作用,在其他试验pH值(6.5~8) 范围内为协同作用,对于这种协同灭活作用的解释,一些学者提出了一种潜在协同机理,认为游离氯导致细胞对一氯胺的敏感性增强,从而产生协同效果[6];另一种解释是:第一种氧化剂在微生物的膜外围形成了良好的氛围,从而使得第二种氧化剂更易于穿透微生物膜。
不同温度对短时游离氯后转一氯胺灭活大肠杆菌协同效果的影响如表2所示。

表2 温度对短时游离氯后转一氯胺灭活大肠杆菌协同效果的影响
从表2中可以看出,在5~30℃范围内,随着温度的降低,单独氯和单独氯胺消毒效果降低,联合消毒的协同作用增强,除在30℃时表现为拮抗作用。
消毒剂消毒作为一种化学反应过程,其反应的速率常数可以采用Arrhenius公式进行描述,通常随反应温度的升高而逐步提高。因此,细菌灭活率随着温度的升高而逐步升高,无论采用哪类消毒剂或消毒方式,均表现出了这种趋势。但游离氯和氯胺的联合消毒效果,在反应温度较低时,其协同作用表现得更为突出,这与国外部分研究成果相符,例如Jason L.[7]等人在研究饮用水消毒,臭氧消毒后接一氯胺或者后接游离氯灭活隐孢子虫在低温时的现象极为相似。
3 结论
根据以上研究,可以得出:
(1) 短时游离氯后转氯胺的安全氯化消毒方法与传统的单独氯及单独氯胺消毒方法相比,消毒效果更佳,对大肠杆菌的灭活具有协同作用,该方法具有更高的微生物安全性。
(2) 短时游离氯后转氯胺对大肠杆菌在pH值6.5~8范围内具有协同灭活作用,并随pH值升高协同作用加强。该法适于在饮用水pH值指标范围(6.5~8.5) 内使用。
(3)短时游离氯后转氯胺灭活大肠杆菌的效果,随水温升高而降低,协同作用在低温时更为明显。
综上,短时游离氯后转氯胺的消毒方法更能满足饮水安全消毒的微生物安全性要求。
[1]C.M.BERENBAUM.Criteria for analyzing interactions between biologicallyactiveagents[J].Adv.CancerRes.,1981,35:269-335.
[2]C.M.BERENBAUM.The expected effect of a combination of agents:the general solution[J].J.the or.Biol.,1985,114:413.
[3]辛仁轩.等离子体发射光谱分析[M].北京:化学工业出版社,2004.
[4]L.L.GYüRéK,G.R.FINCH and M BELOSEVIC.Modeling chlorine inactivation requirements of Cryptosporidium parvum oocysts[J].J.Environ.Eng,1997,123( 9) :865-875.
[5]A.PALIN.A study of the chloro derivatives of ammonia[J].Water and Water Engineering,1950,54:248-258.
[6]Y.KOUAME and HAASC.N.Inactivation of E coli.by combined action of free chlorine and monochloramine[J].Water Res.,1991,25( 9) :1027.
[7]RENNECKER JASON L.,DRIEDGER AMYM.,RUBIN SARA A.etal.Synergy in sequential inactivation of Cryptosporidium parvum with ozone/free chlorineand ozone/monochloramine[J].Water Res.2000,34( 17):4121-4130.
[8]ZHANG X.J,CHEN C.,WANG Y..Synergetic inactivation of microorganisms by short-term free chlorination and subsequent monochloramination in drinking water disinfection[J].Biomed.Environ.Sci.,2007,20:373-380.
Inactivation of E.coli with Short-term Free Chlorine Followed by Monochlora mine
Wang Yun
(Wuzhou Fujikasui Engineering Co.Ltd,Beijing 100052,China)
The inactivation of Escherichia coli with short-term free chlorine followed by monochloramine was investigated with pH ranging from 6 to 8,temperature ranging from 5℃to 30℃.The occurrence of synergy in the sequential application of short-term free chlorine and monochloramine and the effects of pH and temperature on synergy were studied.Experimental results showed that the synergy for sequential short-term free chlorine and monochloramine occurred within the range of pH6.5 to 8,temperature less than 30℃.The synergistic effect was found to increase with decreasing pH.Stronger synergy was observed at the lower temperature.
drinking water; short-term chlorine; monochloramine; E.coli; synergy
X52
A
1008-813X(2012)02-0068-05
10.3969/j.issn.1008-813X.2012.02.019
2012-03-08
王云(1980-),女,江西宜春人,毕业于清华大学市政工程专业,硕士,工程师,主要从事给水和工业废水设计工作。

