毛脉酸模无菌苗的制备及下胚轴愈伤组织诱导的研究
谢彦梅,许岩,常丰华,沈剑,王振月
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
毛脉酸模(Rumex gmelini Turcz.)为蓼科酸模属植物,民间以根及根茎入药,以治疗淋病、癣病、疮毒、止血、肿瘤和调血脂等著称[1]。其根中富含白藜芦醇及白藜芦醇苷、酸模素、大黄酚、大黄素等化合物[2-5]。利用植物组织培养生产次生代谢产物具有保护植物资源、生产周期短、不受地区和季节限制、利于生物转化,寻找新的有效药物成分等优点[6]。但毛脉酸模组织培养时,盆栽的毛脉酸模幼苗发芽率低、生长周期长、幼苗较嫩,进行外植体消毒时易于脱水,失去活力不利于诱导愈伤组织、丛生芽等。从无菌苗得到的外植体不需消毒,外植体活力较高,所以笔者研究毛脉酸模无菌苗的制备,并比较了不同激素种类或组合对毛脉酸模下胚轴愈伤组织诱导的影响,旨在为今后的组织培养奠定基础。
1 材料与试剂
毛脉酸模种子采自黑龙江中医药大学药用植物园。表面消毒剂选用75%的酒精、0.1%的HgCl2溶液和NaClO溶液。NaClO溶液原液(有效氯≥10.0%)购自天津市进丰化工有限公司。
2 方法
2.1 摩擦种皮对种子发芽的影响
挑选粒大饱满的种子,用120目砂纸摩擦去掉种皮,蒸馏水浸泡24h,第1次消毒时种子在75%的酒精中浸2min,再将其用10%NaClO溶液处理10min,放置在带有两层湿润的无菌滤纸的培养皿中10h,再进行第2次消毒,用10%NaClO溶液处理8min,无菌水冲洗5次后,无菌滤纸吸干表面水分,接种于培养基(MS+3%蔗糖+0.9%琼脂)中,每皿接种种子20粒,置于光照恒温培养箱中培养,培养温度(25±2)℃,光照14h/d,光照强度1500~2000Lx。观察初始发芽时间,每2天调查1次材料污染情况,培养10天后统计污染率和发芽率。以不去种皮的种子为对照。
2.2 不同浸泡时间和消毒次数对种子消毒效果的影响
挑选粒大饱满的种子,120目砂纸摩擦去掉种皮,分别用蒸馏水浸泡0、12h、24h、36h后进行消毒。第一次消毒后每组分别取出一半的种子培养,另一半进行第2次消毒。具体消毒、培养和统计方法如2.1。
2.3 消毒剂种类与消毒时间对种子消毒效果的影响
挑选粒大饱满的种子摩擦去皮浸泡24h,将其用75%的酒精浸泡2min后分成四组,分别用10%NaClO溶液处理 10min、15min;0.1%的 HgCl2溶液处理5min、7min。消毒后分别放置在带有两层湿润的无菌滤纸的培养皿中10h,进行第2次消毒,每组较第1次的消毒时间减2min。具体消毒、培养和统计方法如2.1。
2.4 贮存时间对种子发芽的影响
将新种子和贮存一年、两年的种子按2.1的方法消毒、培养和统计。
2.5 下胚轴诱导愈伤组织
用接种刀将无菌苗的下胚轴切割,接种到不同激素浓度的MS培养基上,进行愈伤组织的诱导培养。实验重复3次。培养30天观察统计愈伤组织的生长状况。
3 结果与分析
3.1 摩擦种皮
种子经砂纸摩擦、浸泡、消毒、培养一段时间后的结果如表1所示,种子发芽时间、污染率和发芽率都与未处理的种子差异明显。摩擦处理的种子1天就开始发芽,无污染,发芽率达到了81.8%。种皮障碍是毛脉酸模种子发芽率低的主要原因之一。毛脉酸模种子种皮坚硬,硬实种子可采用多种方法损伤种皮,以达到促进萌发的目的,如温度处理、切除种皮、碾磨擦伤种皮、浓硫酸腐蚀种皮、有机溶剂浸渍去除种皮上的脂类物质等[7]。本实验采用摩擦种皮的方法使发芽率得到显著提高。
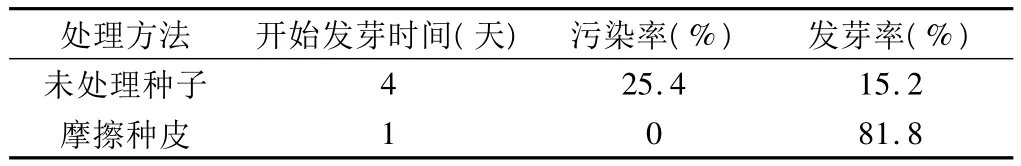
表1 摩擦种皮对种子发芽的影响
3.2 浸泡时间和消毒次数对消毒效果的影响
浸泡时间和消毒次数对消毒效果的影响如表2所示。通过不同浸泡时间和消毒次数对种子处理后,观察统计结果表明,经过两次消毒的种子与一次消毒的种子相比污染率明显降低,初始发芽时间和发芽率没有明显差异,控制污染是组培过程中的首要技术[8],所以选择两次消毒是比较合理的。浸泡24h的种子发芽率明显高于未浸泡和浸泡12h、36h的种子,说明种子浸泡24h是适合萌发的最佳条件。
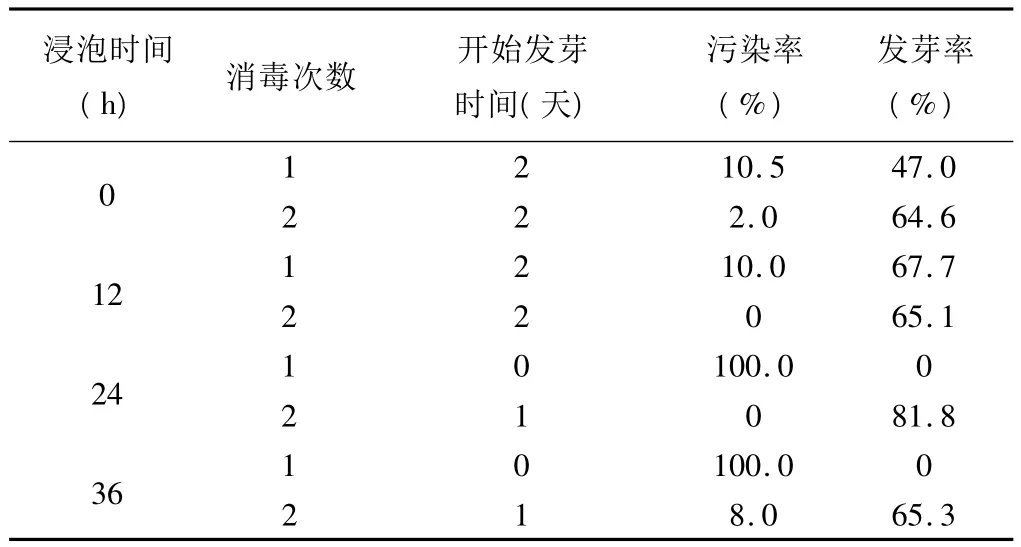
表2 浸泡时间和消毒次数对消毒效果的影响
3.3 最佳消毒剂和消毒时间的选择
表3所示,10%NaClO溶液作为毛脉酸模种子的消毒剂时消毒效果最好,其成苗率优于0.1%HgCl2溶液消毒法。10%NaClO溶液浸种10min与15min消毒效果相比较,消毒10min的种子开始发芽时间短,发芽率相对较高,效果明显。
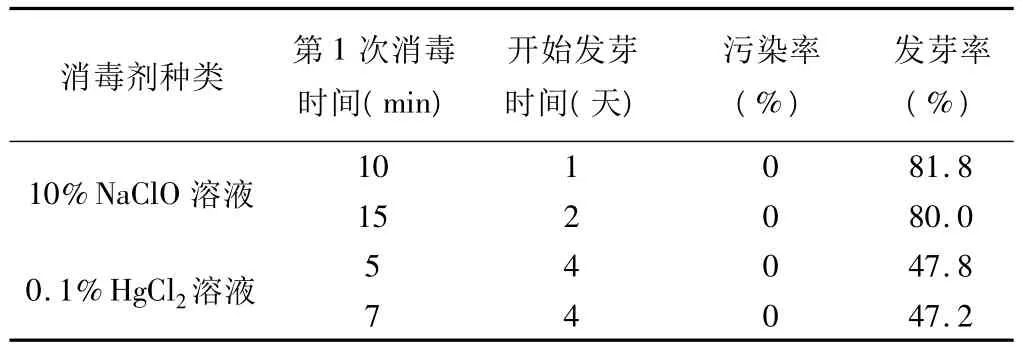
表3 不同消毒剂和消毒时间效果比较
3.4 种子贮存时间对发芽的影响
分别取不同贮存时间的种子研究对比,结果如表4,种子贮存时间越长,开始萌发时间越晚,发芽率越低。可能是因为种子随着贮存时间的增长,活力开始下降。说明组织培养最好用当年新采收的种子。

表4 贮存时间对发芽的影响
3.5 不同浓度激素组合对毛脉酸模愈伤组织发生的影响 见表5。
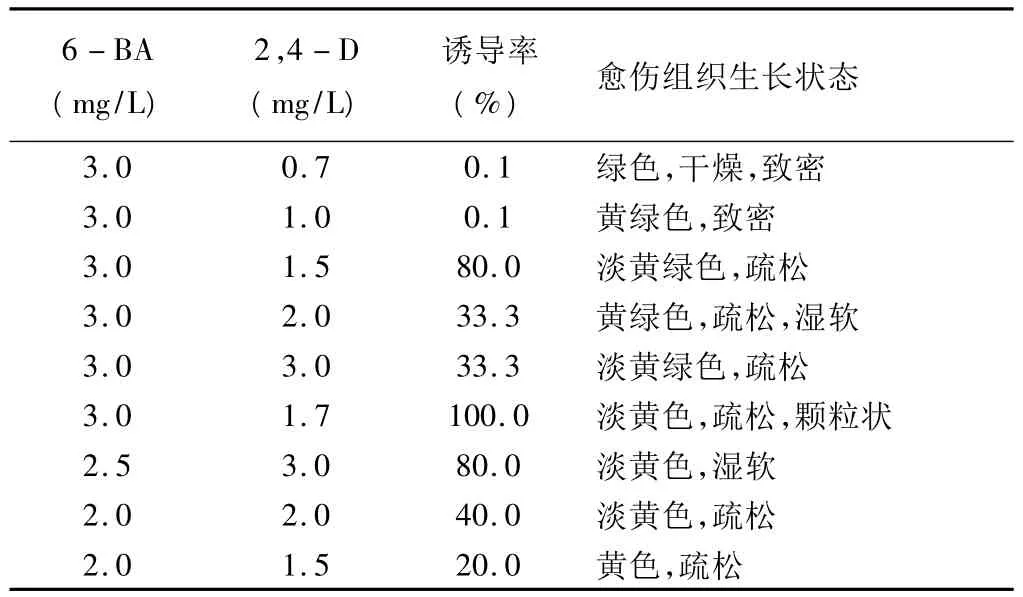
表56-BA和2,4-D配比对下胚轴愈伤组织诱导的影响
观察表明,下胚轴接种10天后,有的培养基上开始形成愈伤组织。由表5可见,当激素6-BA浓度不变时,激素2,4-D浓度在1.5~3 mg/L范围内,愈伤组织诱导率较高。观察统计表明,6-BA浓度为3.0mg/L、2,4-D 浓度为 1.7mg/L配合使用时,不仅愈伤组织的诱导率为100%,而且愈伤组织的生长速度快,长势好。初期诱导形成的愈伤组织为半透明淡黄色,随着培养时间的延长,伴随着愈伤组织的生长,逐渐形成颗粒状、质地疏松的愈伤组织。一般认为,这种愈伤组织为具有分化能力的愈伤组织[9-10]。综合考虑,MS+3.0mg/L 6-BA+1.7mg/L 2,4-D 的激素组合是下胚轴愈伤组织诱导的最佳培养基,该培养基诱导形成的愈伤组织可以为未来愈伤组织形成再生植株和悬浮细胞的培养提供大量的材料。
4 小结与讨论
笔者系统研究了建立毛脉酸模无菌苗培养体系的最佳方法、下胚轴愈伤组织诱导的最佳培养基。获得毛脉酸模无菌苗的方法是:挑选粒大饱满的新种子,120目砂纸摩擦种皮,蒸馏水浸泡24h,在75%酒精中浸2min,无菌水冲洗3次,再将其用10%NaClO溶液处理10min,无菌水冲洗5次,将其放置在有两层湿润的无菌滤纸的培养皿中10h,再进行第二次消毒,用10%NaClO溶液处理8min,无菌水冲洗5次,再将其在无激素的MS培养基中培养即可获得大量无菌苗;下胚轴愈伤组织诱导的最优培养基为MS+3.0mg/L 6-BA+1.7mg/L 2,4-D。消毒是植物组织培养中无菌苗培养的首要工作,而NaClO、HgCl2是常用的两种消毒剂,本实验0.1%HgCl2溶液处理后的无菌苗虽然无污染,但发芽时间长,发芽率低,可能0.1%HgCl2对毛脉酸模种子有较强的毒害作用,从而抑制其萌发[11]。汞胁迫对毛脉酸模种子生长发育有抑制作用,查阅文献[12]发现,其机理可能是重金属元素Hg对植物体内酶活性有影响,根据这一现象推测毛脉酸模可能作为汞胁迫的指示植物。从无菌苗上获得的组织器官作为外植体进行愈伤组织、丛生芽诱导时无需消毒,活力高。从笔者前期实验研究对比发现,诱导率明显提高,愈伤组织长势好,可以为悬浮细胞培养提供大量的材料,为今后内生真菌与细胞或者组培苗相互作用,可能产生有效药物成分奠定基础。
[1] 吉林省中医中药研究所.长白山植物药志[M].长春:吉林人民出版,1982:299.
[2] 王振月,李延冰,匡海学,等.毛脉酸模中大黄酚、大黄素的分离鉴定[J].中医药学报,1996,24(2):54.
[3] 王振月,蔡学勤,康毅华,等.毛脉酸模中两个化合物结构研究[J].中草药,1996,27(12):714.
[4] 王振月,左月明,康毅华,等.毛脉酸模的化学成分的研究(Ⅱ)[J].中草药,2005,36(11):1626-1627.
[5] 门敬菊,王振月,王宗权.植物生长调节剂对毛脉酸模根中白藜芦醇及白藜芦醇苷的影响[J].中医药学报,2011,39(5):60-62.
[6] 徐忠东.植物组织培养生产药物研究进展[J].生物学杂志,2001,18(6):13-14.
[7] 颜启传 .种子学[M].北京:中国农业出版社,2001:73-78.
[8] 潘娟,李先源,李名扬.植物组织培养过程中常见问题及解决方法[J].安徽农业科学,2009,37(6):2392-2394.
[9] 安利佳,姜长阳.植物组织培养导论[M].大连:辽宁师范大学出版社,1996:68-72.
[10] 胡尚连,王丹.植物生物技术[M].西安:西安交通大学出版社,2004:35-40.
[11] 吴志刚.番茄组织培养中无菌苗培养条件的优化[J].中国农学通报,2006,22(4):335-337.
[12] 徐小蓉,周敏,时艳龙,等.汞胁迫对辣椒种子萌发和幼苗生长的影响[J].安徽农业科学,2008,36(2):420-422.

