TRAIL联合顺铂对小鼠移植型肝癌抑制作用及机制研究
李京敏 宁巍巍 刘同慎 王 东 白咸勇
TRAIL联合顺铂对小鼠移植型肝癌抑制作用及机制研究
李京敏 宁巍巍 刘同慎 王 东 白咸勇*
(滨州医学院组织学与胚胎学教研室 山东烟台264003)
目的 探讨肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor-related apoptosis inducing ligand,TRAIL)联合顺铂(cisplatin,DDP)对小鼠移植型肝癌的抑制作用及机制。方法 将H22小鼠移植型肝癌模型随机分为生理盐水组、TRAIL组、TRAIL+DDP组和DDP组,称取瘤重并分析抑瘤率,Hoechst 33342荧光染色法检测细胞凋亡,免疫组织化学染色检测Caspase-3表达。结果 与生理盐水组比较,TRAIL、DDP对小鼠移植型肝癌生长具有明显的抑制作用(P<0.05);TRAIL与DDP联合用药具有增效作用(P<0.05),可明显提高肝癌细胞的凋亡率(P<0.05)、上调Caspase-3表达(P<0.01)。结论TRAIL与DDP联合用药对小鼠移植型肝癌生长具有协同抑制作用,其机制可能与其协同促进Caspase-3的表达有关。
肝癌;肿瘤坏死因子相关的凋亡诱导配体;顺铂;Caspase-3
TRAIL是近年来发现的肿瘤坏死因子家族的新成员,可选择性诱导转化细胞、肿瘤细胞和病毒感染细胞发生凋亡,而对正常组织及细胞无明显毒副作用[1,2]。TRAIL的这种特殊生物学效应,对于临床抗肿瘤治疗具有重要意义。研究报道,TRAIL可诱导多种肿瘤细胞凋亡。一些肿瘤细胞对TRAIL耐药,但通过与化疗药物联用可增加肿瘤细胞对TRAIL的敏感性[3-6]。鉴于体内肿瘤微环境与体外肿瘤细胞培养环境的差异,本实验通过建立小鼠原位移植型肝癌模型,采用TRAIL与DDP联合用药对肝癌的生物学效应及作用机制进行了研究,以期为肝癌的临床治疗提供新的途径。
1.材料
昆明小鼠购自烟台绿叶制药有限公司,小鼠H22肝癌细胞株购自山东大学医学院免疫学实验室,人重组可溶性TRAIL由成都地奥制药集团有限公司惠赠,注射用顺铂冻干型购自齐鲁制药有限公司,Hochest33342购自美国Sigma公司,兔抗Caspase-3多克隆抗体,购自北京博奥森生物工程有限公司。
2.动物分组和模型制作
选取体重25g左右昆明小鼠40只,随机分为4组:NS组、TRAIL组、TRAIL+ DDP组、DDP组。将H22荷腹水瘤小鼠的腹水在小鼠腹腔内连续传代3次后,取腹水稀释至细胞浓度2.5×107个/ml,用1 ml注射器注入模型小鼠肝左叶内(体积最大),每只0.03 ml。手术后第6d开始给药,采用腹腔注射0.01 ml/g动物体重,分别给予 NS、80μg TRAIL/kg、3 mg DDP/kg、80μg TRAIL/kg +3 mg DDP/kg。每3d给药1次,共6次。
3.标本采集
最后一次给药3d后脱颈处死小鼠,大体观察肝脏,切取瘤块,称瘤重。4%多聚甲醛固定肿瘤组织,常规石蜡包埋。进行4μm连续切片,HE染色,光学显微镜下观察肝组织病理学变化。
4.Hoechst33342荧光染色法检测细胞凋亡
将4μm组织切片常规脱蜡至水,用PBS洗5 min,滴加Hoechst33342染液,避光作用10 min,甘油封片,使用共聚焦激光扫描显微镜紫外光(360nm)激发,显示为明亮的蓝色荧光。凋亡细胞的判断标准:胞核中染色质出现浓缩、荧光增强,细胞核裂解为碎片或者出现3个或3个以上的荧光碎片判为凋亡细胞。每张切片观察100个细胞,计数凋亡细胞数。
5.Caspase-3免疫组织化学染色(SP法)
将4μm组织切片常规脱蜡至水,3%过氧化氢甲醇处理30 min,柠檬酸缓冲液微波修复10 min,正常羊血清封闭30 min,滴加兔抗Caspase-3多克隆抗体(1:200)4℃过夜,滴加生物素标记羊抗兔Ig G 37℃孵育30 min,DAB显色。阳性结果判断标准:光镜下观察,细胞质或胞核内有弥漫分布的棕黄色颗粒沉积。图片采用I MAGE-PROPLUS图像分析系统进行分析,结果以平均光密度值表示。
6.统计学处理
所有实验数据以(¯x±s)表示,采用SPSS 13.0软件包进行析因设计方差分析和Bonf err oni法两两比较,P<0.05为差异有统计学意义。
结 果
1.肝脏病理学变化
肉眼观,可见模型小鼠肝左叶有类圆形白色结节形成,呈膨胀性-浸润性生长,与周围组织边界清楚。光学显微镜下观察,可见肿瘤组织呈团块状生长,周围有大量炎性细胞浸润;在高倍镜下观察,肿瘤细胞异型性明显,核大,有多个核仁,可见瘤巨细胞和核分裂相,肿瘤中心可见大片坏死。(图1)。
2.瘤重及抑瘤率分析
实验结果显示:TRAIL与DDP单独用药组的瘤重均低于NS组瘤重,差异有统计学意义(P<0.05);TRAIL与DDP联合用药对肝癌生长抑制具有交互作用,与TRAIL组、DDP组瘤重比较差异有统计学意义(P<0.05),说明两者联用能够协同抑制小鼠移植型肝癌生长。

表1 各组瘤重及抑瘤率比较(n=5,¯x±s)Table 1 Comparison of tu mor weight and inhibitor y rate in different gr oups(n=5,¯x±s)
3.Hoechst 33342染色
实验结果显示,TRAIL组、DDP组凋亡细胞数均高于NS组,差异有统计学意义(P<0.05)。TRAIL和DDP联合用药具有交互作用,能够促进肝癌细胞凋亡,差异有统计学意义(P<0.05)。(图2)
4.Caspase-3的表达
光学显微镜下观察:各用药组癌组织中均可见大量Caspase-3阳性表达癌细胞,这些癌细胞体积较大,核大,胞质少。(图3)TRAIL与DDP单独用药组癌组织内Caspase-3的表达均高于NS组,差异有统计学意义(P<0.01);TRAIL和DDP联合用药对Caspase-3在癌组织的表达有交互作用(P<0.01),两种药物联用对Caspase-3的表达增高有协同作用(P<0.01)。

表2 各组细胞凋亡数比较(n=5,¯x±s)Table 2 Co mparison of apoptotic cells in different groups(n=5,¯x±s)
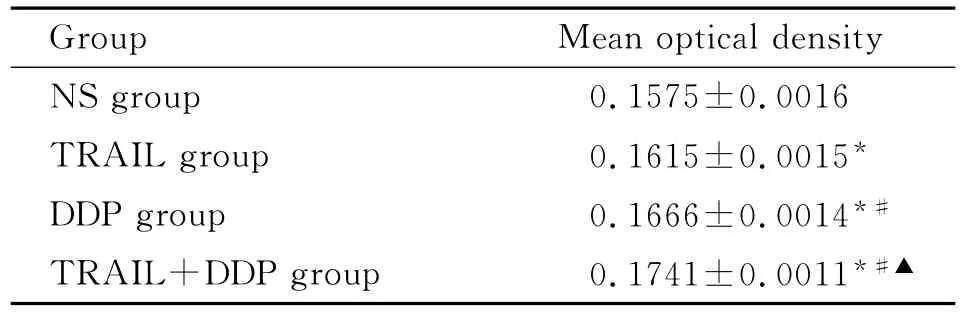
表3 Caspase-3在各组癌组织中的表达(¯x±s)Table 3 Expression of Caspase-3 in cancer tissues in different groups(¯x±s)

图1 小鼠肝脏病理学变化(HE染色)图2 Hoechst 33342染色结果。×1000图3 Caspase-3在癌组织中的表达。(SP法 ×400)Fig.1 The pathological changes of liver tissues in mice(HE stainning);1 A:Nor mal liver tissues(HE stainning ×100);1B:Nor mal liver tissues(HE stainning ×400);1C:Liver cancer tissues(HE stainning ×100);1D:Liver cancer tissues(HE stainning×400)Fig.2 Result of Hoechst 33342 staining.×1000;2A:NS group;2B:TRAIL group;2C:DDP group;2D:TRAIL+DDP groupFig.3 Expression of caspase-3 in cancer tissues.(SP method×400);3A:NS group;3B:TRAIL group;3C:DDP group;3D:TRAIL+DDP group
讨 论
研究表明,TRAIL对大部分肿瘤细胞有明显的凋亡诱导作用,但大多数肝癌细胞系对TRAIL具有耐药性。Shin[7]等单独用TRAIL处理肝细胞肝癌(HCC)细胞系,结果发现几乎所有的细胞系均对TRAIL表现耐药,但TRAIL与DDP联合用药,可增加HCC对TRAIL的敏感性;TRAIL与化疗药物联用对肝癌细胞具有更显著的增殖抑制和凋亡诱导作用[8,9]。在体内,肿瘤细胞增殖与宿主代谢以及体内药物的相互作用相当复杂,并受多种因素调控,而且肝内的免疫环境非常复杂。鉴于此,我们设计了本实验。实验结果表明,TRAIL组的瘤重及抑瘤率与NS对照组比较,差异有统计学意义(P<0.05),说明TRAIL对肝癌生长有一定的抑制作用,但与传统化疗药物DDP相比,其单一用药治疗效果不理想。这可能与体内肿瘤微环境较为复杂有关,其机制有待进一步研究。同时,实验结果显示:TRAIL与DDP联用组与其他三组比较,对小鼠移植型肝癌生长具有更明显抑制作用,TRAIL与DDP配伍有增效作用,可明显提高肝癌细胞的凋亡率、上调肝癌细胞 Caspase-3的表达。Siervo[10]等研究发现,TRAIL和顺铂联合用药能够协同上调卵巢癌细胞TRAIL受体DR4、DR5的表达、下调Dc R1的表达、协同下调抗细胞凋亡基因Bcl-2和Bcl-x L 的 表 达、促 进 Caspase-3、Caspase-8 和Caspase-10活化,从而增加了卵巢癌细胞对TRAIL诱导的细胞凋亡的敏感性。TRAIL主要是通过与细胞膜上的相应受体结合而发挥生物学效应。TRAIL与死亡受体DR4、DR5特异性结合后通过死亡结构域激发和传递凋亡信号,激活天冬氨酸特异性半胱氨酸蛋白酶级联反应,最后激活Caspase-3,活化的Caspase-3作用于其效应物并引发细胞凋亡发生[11]。结合本实验结果,我们认为TRAIL和顺铂联用可通过协同上调Caspase-3的表达,提高肝癌细胞对TRAIL诱导凋亡的敏感性。这为TRAIL与顺铂两者之间的配伍应用于临床提供了进一步的理论基础。我们将研究TRAIL与顺铂联合用药对小鼠移植型肝癌细胞TRAIL受体以及其它凋亡相关蛋白表达的影响,为TRAIL应用于临床治疗肝癌提供进一步的实验依据。
[1]Griffit h TS,Anderson RD,Davidson BL,et al.Adenoviral-mediated transfer of the TNF-related apoptosis-inducing ligand/Apo-2 ligand gene induces tumor cell apoptosis.J Immunol,2000,165(5):2886-2894
[2]Al masan A,Ashkenazi A.Apo2L/TRAIL:Apoptosis signaling,biology and potential for cancer t herapy.Cytokine Growth Factor Rew,2003,14(3-4)337-348
[3]Ding L,Yuan C,Wei F,et al.Cisplatin restores TRAIL apoptotic path way in glioblasto ma-derived stem cells through up-regulation of DR5 and down-regulation of c-FLIP.Cancer Invest,2011,
[4]Baritaki S,Huerta-Yepez S,Sakai T,et al.Chemotherapeutic dr ugs sensitize cancer cells to TRAIL-mediated apoptosis:up-regulation of DR5 and inhibition of Yin Yang 1.Mol Cancer Ther,2007,6(4):1387-1399
[5]Yin S,Xu L,Bandyopadhyay S,et al.Cisplatin and TRAIL enhance breast cancer stem cell death.Int J Oncol,2011,39(4):891-898
[6]Xu L,Yin S,Banerjee S,et al.Enhanced anticancer effect of the combination of cisplatin and TRAIL in triple-negative breast tumor cells.Mol Cancer Ther,2011,10(3):550-557
[7]Shin EC,Seong YR,Ki m CH,et al.Hu man hepatocellular carcino ma cells resist to TRAIL-induced apoptosis,and the reisitance is abolished by cisplatin.Exp Mol Med,2002,34(2):114-122
[8]周慧明,陈智,陈公英,等.TRAIL联合化疗药物诱导肝癌细胞凋亡的实验研究.中华肿瘤杂志,2003,25(2),152-153
[9]胥瑜,闫娟,李旭峰,等.TRAIL联合顺铂和IFN-α对人肝癌细胞凋亡的影响.华西药学杂志,2007,22(4),390-392
[10]Siervo-Sassi RR,Marrangoni,Feng X,et al.Physiological and molecular effects of Apo2L/TRAIL and cisplafin in ovarian carcinoma cell lines.Cancer Lett,2003,190(10):61-72
[11]Kischkel FC,Lawrence DA,Chuntharapai A,et al.Apo2L/TRAIL-dependent recr uit ment of endogenous FADD and caspase-8 to death receptor 4 and 5.Immmunity,2000,12(6):611-620
Inhibitory action and mechanism of trail combined with cisplatin on transplanted hepatocellular carcinoma in mice
Li Jing min,Ning Weiwei,Liu Tongshen,Wang Dong,Bai Xianyong*
(Depart ment of Histology and Embr yol ogy,Binzhou Medical University,Shandong Yantai 264003,China)
Objective To st udy t he mechanis m and t he inhibitor y action of TRAIL co mbined wit h DDP on transplanted hepatocellular carcino ma in mice.Methods Mice bearing H22 hepatocellular carcinoma were rando mly divided into nor mal saline(NS)gr oup,TRAIL gr oup,TRAIL+DDP gr oup,and DDP group.Tu mor tissues were weighted and the inhibitory rate was analysed.Hoechst 33342 stainning method was used to calculate t he apoptotic cells.The expression of Caspase-3 was measured by i mmunohistochemistry.Results Compared with NS,both TRAIL and DDP obviously inhibited the growth of transplanted hepatocell ular carcino ma in mice(P<0.05).They had a syner gistic effect(P<0.05)and obviously increased the apoptotic rate of cancer cells(P<0.05)and the expression of Caspase-3(P<0.01).Conclusion The co mbination of TRAIL wit h DDP has a syner gisticl y inhibitor y eff ect on t he gr owth of transplanted hepatocellular carcinoma in mice,and the mechanism may be associated with the synergistic upregulation of Caspase-3 expression.
Hepatocellular carcinoma;TRAIL;DDP;Caspase-3
R329
A
10.3870/zgzzhx.2012.02.006
2011-02-10
2011-04-01
山东省优秀中青年科学家科研奖励基金(01BS51);山东省自然科学基金(Y2008C95);滨州医学院科技计划(BY2008KJ27)
李京敏,女(1983年),汉族,硕士。
*通讯作者(To whom correspondence should be addressed)

