纳米材料在生物医学中的应用
周国强,谷广其,王文颖,王书香,张金超
(河北大学化学与环境科学学院,河北省化学生物学重点实验室,河北保定 071002)
学科综述
纳米材料在生物医学中的应用
周国强,谷广其,王文颖,王书香,张金超
(河北大学化学与环境科学学院,河北省化学生物学重点实验室,河北保定 071002)
纳米生物医学是纳米技术与现代生物医学技术结合的产物,近年来这一领域逐渐受到科学界和企业界的重视,得到了许多振奋人心的进展,具有广泛的应用前景.结合本课题组在纳米材料和生物医学方面取得的研究成果,介绍了量子点、纳米金、碳纳米管、纳米氧化铁和富勒烯几种典型纳米材料在生物医学领域的应用研究现状.
纳米材料;生物医学;量子点;碳纳米管
纳米材料是指在三维空间中至少有一维处于纳米尺度范围(1~100 nm)或由纳米粒子作为基本单元构成的材料.纳米粒子也叫超微颗粒,处于原子簇和宏观物体交界的过渡区域,这样的体系既非典型的微观系统亦非典型的宏观系统,是一种典型的介观系统,与常规尺度物质相比具有表面效应、小尺寸效应和宏观量子隧道效应等[1-2].纳米技术是通过对纳米尺度物质的操控来实现材料、器件和系统的创造和利用,例如在原子、分子和超分子水平上的操控.纳米技术应用于生物领域产生了纳米生物技术,纳米生物技术的发展已经对医学产生很大的影响,过去的几十年中,市场上已经出现基于纳米技术的一些药物,许多具有药物诊断和药物传输功能的纳米材料都可以应用到生物医学中.纳米技术打开了微米尺度以外的世界,而细胞水平上的生理和病理过程都发生在纳米尺度,因此纳米技术将对生物医学产生深远影响.纳米生物技术和生物医学以及其他技术的关系如图1所示[3].本文仅对量子点、纳米金、碳纳米管、氧化铁和富勒烯等纳米材料在生物医学中的应用研究现状及发展前景做一综述.
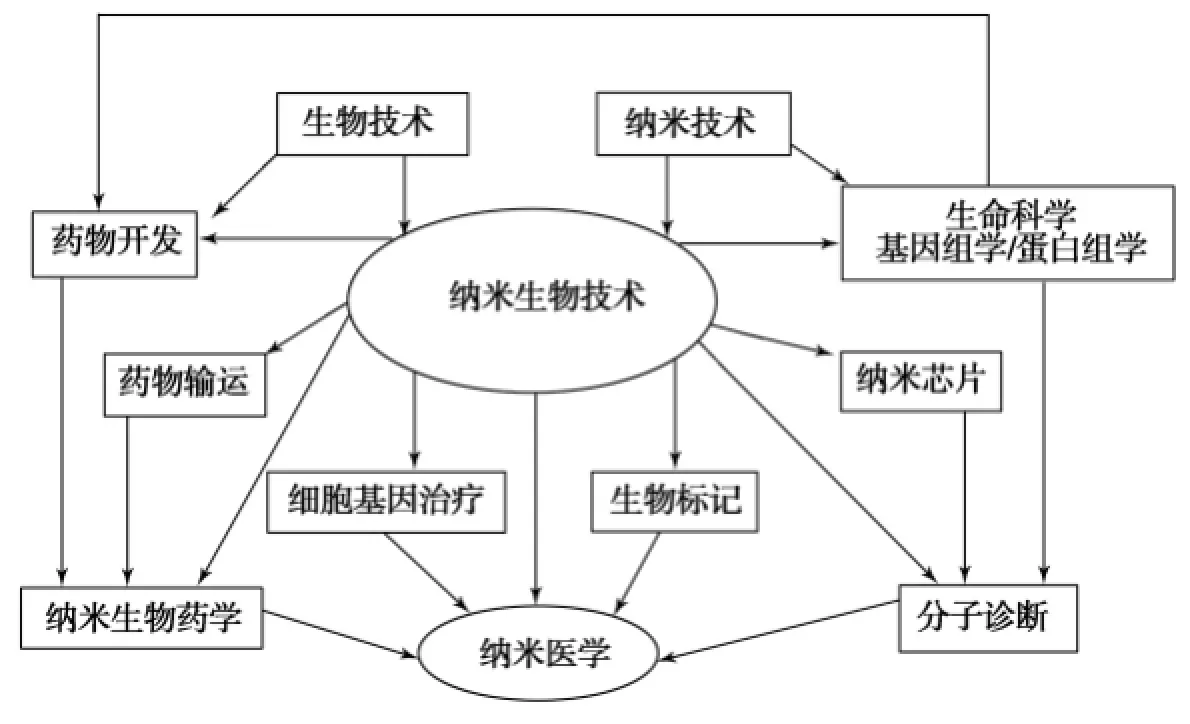
图1 纳米生物技术和纳米医学及其他生物技术的关系[3]Fig.1 Relationship of nanobiotechnology to nanomedicine and other biotechnologies[3]
2 纳米材料在生物医学中的应用
2.1 量子点
量子点(quantum dots,QDs)是一种粒径为2~10 nm的半导体纳米晶,主要包括硒化镉、碲化镉、硫化镉、硒化锌和硫化铅等.与传统的有机荧光染料相比,QDs具有激发波长可调、荧光强度更高、稳定性更强、不易发生光漂白和同时激发多种荧光等优点.通过对多种量子点同时进行激发,可以达到多元化检测的目的,有利于进行高通量筛选.QDs的发射光谱随尺寸大小和化学组成变化而有所改变,因此可以通过控制QDs的尺寸和化学组成使得其发射光谱覆盖整个可见光区[4].
随着QDs尺寸的减小,其电子能量的不连续性产生独特光学性质,因此,QDs可以作为荧光探针用于生物分子成像,进行生物分子的识别.Goldman等[5]利用亲和素修饰CdSe/ZnS QDs,通过亲和素-生物素化抗体的特异性结合形成荧光纳米粒子复合抗体,探讨了在蛋白毒素检测领域的应用前景.Genin等[6]以QDs为探针对半胱氨酸蛋白进行检测,检测时间可以持续到150 s,检测机理是将QDs与有机荧光染料分子Cr As H、半胱氨酸依次结合,利用形成的复合体进行检测.Liang等[7]研究链酶亲和素修饰的QDs对microRNA的定量检测效果,利用QDs发出的荧光信号对microRNA的含量进行测定,最低检测限达到0.4 fmol.Shepard等[8]利用量子点和Cy3,Cy5荧光染料共同作用,对炭疽杆菌进行多元检测,大大提高了检测效率,与传统的双光色检测相比体系通量提高了4倍.杜保安等[9]采用水相合成法合成了Mn2+掺杂Cd Te量子点,通过在Cd Te量子点中掺杂Mn2+,进一步改良Cd Te的发光性能及热稳定性,扩大了量子点的应用范围.聚乙二醇(polyethylene glycol,PEG)因其容易和氨基、羧基、生物素等多种功能化基团反应而常用于QDs的表面改性,而且PEG还能够增加QDs的化学稳定性.研究发现,用低聚PEG-磷酸酯胶束包覆QDs后分散于水中,其荧光强度几周内都不会发生改变,若分散于磷酸盐溶液中,80 h后荧光强度只降低10%[10].QDs特殊的光学性质使得它已逐步应用于光发射二极管、生物化学传感器、太阳能电池、生物分子成像和纳米医学等领域.
2.2 金纳米粒子
金纳米粒子(Au NPs)具有独特的光学性质、良好的生物相容性、易修饰生物分子以及制备简单等特点,因此在生物传感、分子成像、肿瘤治疗和药物传输等生物医学领域得到广泛研究.Wang等[11]利用N-羟基琥珀酰亚胺修饰的Au NPs实时检测人体血液中链霉素和生物素的相互作用,发现经修饰后的Au NPs具有3μg/m L的低检出限和3~50μg/m L的宽动态检测范围,为构建全血中蛋白检测和细胞分析的新型光学生物传感器提供了思路.Huang等[12]将金纳米棒连接上表皮生长因子抗体后作用于癌细胞,发现金纳米棒附近的分子表现出更强、更敏锐和极化的拉曼光谱,这对于肿瘤的早期准确检测成像具有很大意义.Wei等[13]研究了Au NPs和紫杉醇对HepG2肝癌细胞凋亡的影响,发现Au NPs单独或与紫杉醇协同作用可以引起Hep G2细胞凋亡,AuNPs可以增强紫杉醇对Hep G2细胞的抑制和凋亡作用.Tong等[14]研究发现叶酸结合的金纳米棒在近红外光照射下可以破坏质膜,这是由于细胞内钙离子的快速增多进而导致肌动蛋白动态异常造成的.但是,关于Au NPs的研究还处于初级阶段,许多问题尚需进一步的深入研究.例如:如何制备各种形态和结构以及可控成分的Au NPs,如何在治疗过程中实现定向输送和释放的靶向性以及使Au NPs作为探针的信号放大以便用于生物检测等都需要进一步的探索.
本课题组Liu等[15]研究了Au NPs对成骨细胞系MC3T3-E1的增殖、分化和矿化功能的影响,结果表明,20,40 nm的Au NPs均促进MC3T3-E1细胞的增殖、分化和矿化功能,且呈现出剂量和时间依赖性.RT-PCR结果表明,20,40 nm的Au NPs均促进runt相关转录因子2(Runx2)、骨形态发生蛋白2(BMP-2)、碱性磷酸酶(ALP)和骨钙素(OCN)基因的表达.结果显示,AuNPs能够促进MC3T3-E1细胞成骨分化及矿化功能,而且影响随纳米颗粒的尺寸变化有所不同.Runx2,BMP-2,ALP和OCN4种基因可能相互影响,从而刺激MC3T3-E1细胞的成骨分化.实验结果提示,与骨中羟基磷灰石晶体尺寸相似的Au NPs可能扮演了一个晶核的角色,从而刺激其周围细胞的增殖、分化和矿化,形成钙的沉积.随后Liu等[16]又研究了Au NPs对骨髓基质细胞(MSCs)增殖、成骨和成脂分化的影响,结果表明,AuNPs可以促进MSCs向成骨方向分化,抑制向成脂方向及成脂横向分化.结果揭示了Au NPs是如何进行细胞内活动进而影响骨髓基质细胞的功能,对合理设计用于组织工程和其他生物医学方面的新材料具有重要意义.
2.3 碳纳米管
碳纳米管(carbon nanotubes,CNTs)的结构,形象地讲是由1个或多个只含sp2杂化碳原子的石墨薄片卷曲成的纳米级圆筒.根据石墨片层数不同,CNTs可分为单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs).CNTs的长度从几百纳米到几毫米不等,但它们的直径均在纳米量级,SWCNTs和MWCNTs的直径分别在0.4~3.0 nm和2~500 nm.MWCNTs也是由几个石墨片层的圆筒构成,层间距在0.3~0.4 nm.CNTs可以在药物供给系统与细胞之间形成圆筒形的渠道,输送肽、蛋白质、质粒DNA或寡核苷酸等物质.CNTs还能促进骨组织的修复生长,促进神经再生,减少神经组织瘢痕产生.Kam等[17]将CNTs胺基修饰后,通过生物素连接具有荧光的抗生素蛋白链菌素,孵育白血病细胞HL60一定时间后,发现细胞内产生较强的荧光,且随CNTs浓度和孵育时间的延长,荧光强度不断增强,证明CNTs能将大分子蛋白载入HL60细胞内.Feazell等[18]研究胺基化的SWCNTs运输铂(Ⅳ)复合物的效果,结果发现铂(Ⅳ)复合物以胺基化SWCNTs为载体进入睾丸癌细胞,并且其细胞毒性比连接前高出100多倍,为提高肿瘤化疗药物的敏感性提供了新思路.
Zhang等[19]采用原代培养小鼠成骨细胞(OBs)为模型,研究了SWCNTs(直径<2 nm)、DWCNTs(直径<5 nm)和MWCNTs(直径<10 nm)对OBs增值、分化和矿化功能的影响,结果表明,它们均抑制OBs的增殖、横向分化和矿化功能,且呈现时间和剂量依赖性,并且明显抑制了OBs中Runx-2和Col-Ⅰ蛋白的表达水平.Liu等[20]进一步研究了SWCNTs(直径<2 nm)和MWCNTs(直径<10 nm)对骨髓基质细胞(MSCs)增殖、成骨分化、成脂分化和矿化的影响,结果表明,SWCNTs和MWCNTs明显抑制了MSCs的增殖,且呈现出了剂量依赖关系.SWCNTs和MWCNTs抑制MSCs增殖和成骨分化的机制可能是通过调节依赖于Smad的骨形态发生蛋白(BMP)信号通路而起作用.结果提示,CNTs对OBs和MSCs的生长起着重要的调控作用,其生物安全性评价还需进行充分研究以便将来进行合理设计用于生物医学.由于碳纳米管独特的结构,其外表面既可以非共价吸附各种分子,还可以共价键合多种化学基团,内部则可以包埋小分子,从而提高了其表面负载率及实现增溶和靶向等.在生物医学上,鉴于碳纳米管具有的生物膜穿透性和相对低的细胞毒性,在药物传递方面具有较好的应用前景.碳纳米管的应用给肿瘤的诊断与治疗带来了新的机遇,随着对其用作药物载体的深入研究,低毒高效的修饰性碳纳米管有望在将来广泛应用于临床[21].
2.4 氧化铁纳米粒子
氧化铁纳米粒子由于具有超顺磁性,是一类具有可控尺寸、能够外部操控并可用于核磁共振成像(MRI)造影的材料.这使得氧化铁纳米粒子广泛应用于蛋白质提纯、医学影像、药物传输和肿瘤治疗等生物医学领域.Wang等[22]采用一种新方法将色酮偶联到Fe3O4纳米颗粒上,合成的结合物使色酮在培养基中的溶解度急剧增加,从而使He La细胞吸收色酮能力增强,结合物能更有效抑制He La细胞增殖,这种色酮耦合的Fe3O4纳米粒子可以作为多功能输送系统用于诊断和治疗.Wei等[23]研究发现Fe3O4纳米颗粒可以特异性检测H2O2和葡萄糖,并且具有很高的灵敏度.结果显示,对H2O2的检测精度可达到3×10-6mol/L,对葡萄糖的检测精度达到5×10-5~1×10-3mol/L.Xie等[24]发展了一种新方法用于制备超微磁性纳米颗粒,其中小配体4-甲基苯膦二酚用作表面活性剂来稳定颗粒的表面,其与氧化铁表面具有很强的螯合作用,进而与环状多肽链接,可用于靶向诊断肿瘤细胞.刘磊等[25]通过化学共沉淀法制备了铁磁性纳米粒子(FeNPs),并以W/O反相微乳法制备了包埋荧光染料三联吡啶钌配合物Ru(bpy)2+3的二氧化硅纳米粒子(Si NPs)和二氧化硅磁性纳米粒子(Si/FeNPs),并研究了不同浓度的FeNPs,Si NPs和Si/FeNPs对肝癌细胞HepG2的增殖、细胞周期、表面形态和超微结构的影响,结果表明FeNPs对Hep G2细胞增殖和周期没有显著影响,SiNPs和Si/Fe NPs能够促进细胞生长分裂,具有促增殖作用;Si NPs和Si/FeNPs通过细胞膜的包吞作用随机进入细胞内,进入细胞后,不影响细胞的形态和超微结构.实验结果对进一步研究修饰特异性抗体、蛋白或负载抗癌药物之后的二氧化硅纳米粒子在一定交变磁场作用下的抗肿瘤效果具有重要意义.氧化铁纳米粒子是目前国内外大力研究的一种新型靶向给药系统,应用前景十分广泛.但是成功应用于活体肿瘤靶向纳米探针和纳米载药体目前仍然存在很多障碍:1)表面进行化学修饰后,氧化铁纳米纳米粒子的磁化量降低;2)纳米氧化铁上嵌入配基结合位点可能会降低它的靶向特异性,并且所载药物常常在内涵体或溶酶体中释放,而不是靶细胞的胞质;3)在到达肿瘤组织之前,结合或封装的化疗药物在血液中很快释放.氧化铁纳米粒子和其他可生物降解的、生物相容性好的聚合物微团的结合可能会解决上述问题.可以预期,随着人们对磁性纳米粒子聚合物研究的不断深入,磁性纳米氧化铁粒子将在肿瘤的诊断及治疗中发挥越来越重要的作用.
2.5 富勒烯
富勒烯(C60)是一个由12个五元环和20个六元环组成的球形三十二面体,外形酷似足球,直径为0.71 nm.六元环的每个碳原子均以双键与其他碳原子结合,形成类似苯环的结构.富勒烯、金属内嵌富勒烯及其衍生物由于独特的结构和物理化学性质,在生物医学领域有广泛的应用.如抗氧化活性和细胞保护作用、抗菌活性、抗病毒作用、药物载体和肿瘤治疗等[26].Hu等[27]发现丙氨酸修饰的水溶性富勒烯衍生物能够抑制过氧化氢诱导的细胞凋亡,其机制是通过清除细胞内外活性氧而抑制细胞凋亡.Yin等[28]研究发现C60(C(COOH)2)2,C60(OH)22和Gd@C82(OH)223种富勒烯衍生物可以降低细胞内活性氧水平来保护过氧化氢诱导的细胞损伤,其清除的活性氧自由基包括超氧阴离子、单线态氧和羟基自由基等.Mashino等[29]研究发现甲基吡咯碘修饰的富勒烯衍生物可以通过抑制大肠杆菌的能量代谢对其活性起到抑制作用.Chen等[30]发现Gd@C82(OH)22能有效抑制肿瘤生长并对机体不产生任何毒性,其对H22肝癌动物模型抗肿瘤效率比环磷酰胺和顺铂都高,其抑瘤效果并不像传统药物对肿瘤的直接杀伤作用,而是通过其他机制来完成.实验结果表明Gd@C82(OH)22能提高免疫应答能力,促进巨噬细胞和T细胞分泌IL-2,TNF-α和IFN-γ等一系列免疫因子,同时促进血液中T细胞亚型Th1型因子IL-2,IFN-γ和TNF-α的分泌,说明它的抑制肿瘤生长效果有可能是通过激活机体免疫功能实现的[31].Zhou等[32]采用差速离心和ICP-MS测定方法研究了Gd@C82(OH)22在荷瘤小鼠组织中的亚细胞分布情况,结果表明此纳米颗粒可以进入细胞,其亚细胞分布模式与GdCl3显著不同,Gd@C82(OH)22在动物体内是以整个完整碳笼形式存在,且在代谢过程中碳笼不会打开释放出内部的Gd3+.随后研究了Gd@C82(OH)22和C60(OH)22对荷Lewis肺转移瘤小鼠氧化应激水平的影响,发现2种富勒烯衍生物可以通过清除自由基抑制脂质过氧化下调氧化应激相关指标,降低由于肿瘤转移到肺造成的肺损伤[33].这些结果都为解释Gd@C82(OH)22纳米颗粒的抗肿瘤生长机制提供了证据,对开展金属富勒烯在抗肿瘤药物领域的研究具有很大意义.
3 展望
纳米材料的生物学性质与自身的纳米尺寸效应和纳米结构效应这2个方面有关.在纳米生物医学研究中,人们已普遍承认“尺寸-效应”关系的重要作用,尺寸影响其生物效应的根源可以归因于纳米尺度下的巨大比表面积引起的超高反应活性.同等质量、同一物质的比表面积随尺寸减少而增大.纳米尺度物质的表面分子数目与颗粒尺寸呈负相关,其表面分子数目随尺度减小而急剧增加.因此,不同尺度的QDs,Au NPs和CNTs表现出来的细胞生物效应呈现出显著不同的结果.除尺寸效应外,纳米结构效应也是影响材料生物医学应用的另一重要因素.纳米材料的生物学性质与其本身的结构密切相关,物质结构不可避免地影响其在生物机体的活性、强度、结合位点以及动力学性质等.以碳纳米材料为例,SWCNTs,MWCNTs和C60都是由碳原子组成的结构不同的碳的同素异形体,尽管3种纳米材料的化学组成相同,但在相同剂量下,其生物学活性却有很大区别,而这种不同的生物活性可能跟它们的纳米结构密切相关.因此,纳米生物医学除了要考虑传统的“剂量-效应”关系之外,还要考虑新的“纳米尺寸-效应”和“纳米结构-效应”等[34].
纳米生物技术的发展将对传统医学产生很大影响,纳米技术应用到生物医学领域,为生物医学技术研究提供了重大创新机遇和市场前景.纳米生物医学研究为合理设计功能纳米器件提供了机会,进一步促进了临床纳米药物的发展.例如:1)能够设计更有效的靶向药物运输系统从而解决传统化疗药物的毒性和靶向等问题;2)可以提供在细胞内的计算机控制的分子工具,在细胞和分子水平上更精确地操作药物分子,从而起到清除循环系统中的障碍、杀死癌细胞或取代亚细胞器等功能;3)提供超微生物传感器,能够在内部观察细胞的功能,在分子水平上对组织进行更快更细的检测分析,从而对细胞、亚细胞和分子行为进行详细准确的分析.纳米材料所展现的优异性能决定其在生物医学领域具有良好的应用前景,但纳米材料在生物医学中的应用研究尚处于初期阶段.目前缺乏对纳米材料生产、使用和转化等整个周期的了解,对进入人体内的纳米材料安全性研究途径还不够全面,缺乏标准化的纳米材料安全性评价程序.如何建立健全评价纳米材料和纳米药物安全性的标准评价体系和检测方法,以及如何健全纳米生产企业的监督管理方法以保证生物和环境安全刻不容缓[35].
[1]周国强,陈春英,李玉峰,等.纳米材料生物效应研究进展[J].生物化学与生物物理进展,2008,35(9):998-1006.
ZHOU Guoqiang,CHEN Chunying,LI Yufeng,et al.Recent progress on the pro and cons of biological effects of nanomaterials[J].Progress in Biochemistry and Biophysics,2008,35(9):998-1006.
[2]申世刚,刘慧玲,王文颖,等.CeO2纳米颗粒对A549细胞的保护作用[J].河北大学学报:自然科学版,2011,31(2):160-166.
SHEN Shigang,LIU Huiling,WANG Wenying,et al.Protection effects of CeO2nanoparticles on A549 cells[J].Journal of Hebei University:Natural Science Edition,2011,31(2):160-166.
[3]JAIN K K.Nanomedicine:application of nanobiotechnology in medical practice[J].Med Princ Pract,2008,17(2):89-101.
[4]KLOSTRANEC J M,Ch AN W C W.Quantum dots in biological and biomedical research:recent progress and present challenges[J].Adv Mater,2006,18:1953-1964.
[5]GOLDMAN E R,BALIGHIAN E D,MATTOUSSI H,et al.Avidin:a natural bridge for quantum dot-antibody conjugates[J].J Am Chem Soc,2002,124(22):6378-6382.
[6]NICHKOVA M,DOSEV D,DAVIES A E,et al.Quantum dots as reporters in multiplexed immunoassays for biomarkers of exposure to agrochemicals[J].Anal Lett,2007,40:1423-1433.
[7]LIANG Ruqiang,LI Wei,LI Yang,et al.An oligonucleotide microarray for microRNA expression analysis based on labeling RNA with quantum dot and nanogold probe[J].Nucleic Acids Res,2005,33(2):e17.
[8]SHEPARD J R E.Polychromatic microarrays:simultaneous multicolor array hybridization of eight samples[J].Anal Chem,2006,78:2478-2486.
[9]杜保安,高璐,连雪茹,等.Mn:Cd Te量子点的水相合成及荧光性质[J].河北大学学报:自然科学版,2011,31(5):491-496.
DU Baoan,GAO Lu,LIAN Xueru,et al.Synthesis of Mn-doped Cd Te quantum dots in water and the fluorescence propertiess[J].Journal of Hebei University:Natural Science Edition,2011,31(5):491-496.
[10]HO Y P,KUNG M C,YANG S,et al.Multiplexed hybridization detection with multicolor colocalization of quantum dot nanoprobes[J].Nano Lett,2005,5:1693-1697.
[11]WANG Yi,QIAN Weiping,TAN Yong,et al.A label-free biosensor based on gold nanoshell monolayers for monitoring biomolecular interactions in diluted whole blood[J].Biosens Bioelectron,2008,23(7):1166-1170.
[12]HUANG Xiaohua,El-SAYED I H,QIAN Wei,et al.Cancer cells assemble and align gold nanorods conjugated to antibodies to produce highly enhanced,sharp,and polarized surface Raman spectra:a potential cancer diagnostic marker[J].Nano Lett,2007,7(6):1591-1597.
[13]WEI Xiaolan,MO Zhihong,LI Biao,et al.Disruption of HepG2 cell adhesion by gold nanoparticle and paclitaxel disclosed by in situ QCM measurement[J].Colloids Surf B Biointerfaces,2007,59(1):100-104.
[14]TONG Ling,ZHAO Yan,HUFF T B,et al.Gold nanorods mediate tumor cell death by compromising membrane integrity[J].Adv Mater,2007,19(20):3136-3141.
[15]LIU Danan,ZHANG Jinchao,YI Changqin,et al.The effects of gold nanoparticles on the proliferation,differentiation and mineralization function of MC3T3-E1 cells in vitro[J].Chinese Sci Bull,2010,55(11):1013-1019.
[16]YI Changqin,LIU Danan,FONG C C,et al.Gold nanoparticles promote osteogenic differentiation of mesenchymal stem cells through p38 MAPK pathway[J].ACS Nano,2010,4(11):6439-6448.
[17]KAM N W,JESSOP T C,WENDER P A,et al.Nanotube molecular transporters:internalization of carbon nanotube-protein conjugates into Mammalian cells[J].J Am Chem Soc,2004,126(22):6850-6851.
[18]FEAZELL R P,NAKAYAMA-RATCHFORD N,DAI Hongjie,et al.Soluble single-wall carbon nanotube as longboat delivery system for Pt(IV)anticancer[J].J Am Chem Soc,2007,129(27):8438-8439.
[19]ZHANG Dawei,YI Changqin,ZHANG Jinchao,et al.The effects of carbon nanotubes on the proliferation and differentiation of primary osteoblasts[J].Nanotechnology,2007,18(47):475102-475110.
[20]LIU Danan,YI Changqin,ZHANG Dawei,et al.Inhibition of proliferation and differentiation of mesenchymal stem cells by carboxylated carbon nanotubes[J].ACS Nano,2010,4(3):2185-2195.
[21]王宗花,周成凤,张菲菲,等.碳纳米管药物载体的研究进展[J].材料导报,2011,25(4):76-79.
WANG Zonghua,ZHOU Chengfeng,ZHANG Feifei,et al.Developments of carbon nanotubes as drug carriers[J].Materials Review,2011,25(4):76-79.
[22]WANG Baodui,XU Chenjie,XIE Jin,et al.p H controlled release of chromone from chromone-Fe3O4nanoparticles[J].J Am Chem Soc,2008,130(44):14436-14437.
[23]WEI Hui,WANG Erkang.Fe3O4magnetic nanoparticles as peroxidase mimetics and their applications in H2O2and glucose detection[J].Anal Chem,2008,80(6):2250-2254.
[24]XIE Jin,CHEN Kai,LEE H Y,et al.Ultrasmall c(RGDy K)-coated Fe3O4nanoparticles and their specific targeting to integrin alpha(v)beta3-rich tumor cells[J].J Am Chem Soc,2008,130:7542-7543.
[25]刘磊.荧光二氧化硅纳米粒子的合成、修饰及其在细胞生物学中的应用[D].保定:河北大学,2010.
LIU Lei.Synthesis,functionalization and biological effects of fluorescent silica-based nanoparticles[D].Baoding:Master Thesis of Hebei University,2010.
[26]焦芳,周国强,陈春英.富勒烯化学修饰与生物医学应用研究进展[J].生态毒理学报,2010,5(4):469-480.
JIAO Fang,ZHOU Guoqiang,CHEN Chunying.Trends in studies on chemical modification and biomedical applications of fullerenes[J].Asian Journal of Ecotoxicology,2010,5(4):469-480.
[27]HU Zhen,GUAN Wenchao,WANG Wei,et al.Synthesis ofβ-alanine C60derivative and its protective effect on hydrogen peroxide-induced apoptosis in rat pheochromocytoma cells[J].Cell Biology International,2007,31(8):798-804.
[28]YIN Junjie,LAO Fang,FU P P,et al.The scavenging of reactive oxygen species and the potential for cell protection by functionalized fullerene materials[J].Biomaterials,2009,30(4):611-621.
[29]MASHINO T,USUI N,OKUDA K,et al.Respiratory chain inhibition by fullerene derivatives:hydrogen peroxide production caused by fullerene derivatives and a respiratory chain system[J].Bioorganic &Medicinal Chemistry,2003,11(7):1433-1438.
[30]CHEN Chenying,XING Gengmei,WANG Jiangxue,et al.Multihydroxylated[Gd@C82(OH)22]nnanoparticles:antineoplastic activity of high efficiency and low toxicity[J].Nano Letter,2005,5(10):2050-2057.
[31]LIU Ying,JIAO Fang,QIU Yang,et al.The effect of Gd@C82(OH)22nanoparticles on the release of Th1/Th2 cytokines and induction of TNF-alpha mediated cellular immunity[J].Biomaterials,2009,30(23-24):3934-3945.
[32]ZHOU Guoqiang,LI Yufeng,LIU Ying,et al.Subcellular distribution of polyhydroxylated metallofullerene of Gd@C82(OH)22in different tissues of tumor-bearing mice[J].J Nanosci Nanotechnol,2010,10:8597-8602.
[33]JIAO Fang,QU Ying,ZHOU Guoqiang,et al.Modulation of oxidative stress by functionalized fullerene materials in the lung tissues of female C57/BL mice with a metastatic lewis lung carcinoma[J].J Nanosci Nanotechnol,2010,10:8632-8637.
[34]常雪灵,祖艳,赵宇亮.纳米毒理学与安全性中的纳米尺寸与纳米结构效应[J].科学通报,2011,56(2):108-118.
CHANG Xueling,ZU Yan,ZHAO Yuliang.Size and structure effects in the nanotoxic response of nanomaterials[J].Chin Sci Bull,2011,56(2):108-118.
[35]王英泽,黄奔,吕娟,等.纳米技术在生物医学领域的研究现状[J].生物物理学报,2009,25(3):168-174.
WANG Yingze,HUANG Ben,LÜJuan,et al.Current status of nanotechnology applied in biomedicine[J].Acta Biophysica Sinica,2009,25(3):168-174.
Application of nanomaterials in biomedicine
ZHOU Guo-qiang,GU Guang-qi,WANG Wen-ying,WANG Shu-xiang,ZHANG Jin-chao
(Key Laboratory of Chemical Biology of Hebei Province,College of Chemistry and Environment Science,Hebei University,Baoding 071002,China)
Nanobiomedicine is the offspring of nanotechnology and biomedicine which is now pursuited by both the scientific community and the industrial community.With some outstanding progress,it is believed that nanobiomedicine has great application potentials in various fields.In this review,it is discussed the application of quantum dots,gold nanoparticles,carbon nanotubes,nano-iron oxide and fullerenes in biomedicine.
nanomaterials;biomedicine;quantum dots; carbon nanotubes
O6-1
A
1000-1565(2012)02-0218-07
2011-10-15
国家自然科学基金资助项目(21001038);保定市科技局科技研究与发展计划项目(11ZF124)
周国强(1982-),男,河北威县人,河北大学讲师,主要从事纳米材料生物效应和安全性评价的研究.E-mail:zhougq@hbu.edu.cn
梁俊红)

