3-丁烯腈在盐酸催化剂溶液中的水解动力学研究
王国伟 司林旭 陈庭雨 龙湘犁 卢 红
(1.常熟三爱富中昊化工新材料有限公司,江苏 常熟 215522;2.华东理工大学,上海 200237)
研究与开发
3-丁烯腈在盐酸催化剂溶液中的水解动力学研究
王国伟1司林旭1陈庭雨1龙湘犁2卢 红2
(1.常熟三爱富中昊化工新材料有限公司,江苏 常熟 215522;2.华东理工大学,上海 200237)
以盐酸为催化剂,通过水解3-丁烯腈合成3-丁烯酸,考察了3-丁烯腈初始浓度、反应温度、盐酸浓度对水解反应过程的影响;在此基础上,研究了3-丁烯腈水解动力学,拟合出了反应速率常数和反应活化能。结果表明,该反应为1级串连反应,同时盐酸浓度对水解反应速率常数有很大的影响:当盐酸的浓度低于5.0 mol/L时速率常数的关系为k1<k2;当盐酸浓度大于6.0 mol/L时速率常数的关系为k1>k2;且随着盐酸浓度的增大,腈水解反应活化能逐渐减小。
3-丁烯腈;酸催化水解;3-丁烯酸;3-丁烯酰胺;动力学
3-丁烯酸,又名乙烯基乙酸,分子式C4H6O2,同时具有双键和羧基,可以作为很好的化工原料和有机中间体,被广泛用于药物、树脂、杀菌剂、表面涂料和增塑剂等方面。随着市场对3-丁烯酸的需求越来越大,3-丁烯酸的合成方法也越来越多,主要包括钯催化合成法、电合成法以及腈水解法等,但这些方法存在反应条件苛刻、产品收率低等一定的局限性[1]。
酸或碱催化腈水解是最常用的制备有机羧酸的方法,早在1944年Edward Rietz就提出了酸催化条件下3-丁烯腈水解制备3-丁烯酸的方法,此方法反应时间较短且反应条件简单,产品收率和选择性相比其他方法也相当不错[2]。
本研究通过对盐酸催化条件3-丁烯腈水解工艺条件的分析,研究3-丁烯腈在盐酸催化条件下水解反应动力学,为3-丁烯酸的工业化生产提供参考依据。国内外并未出现相关报道。
1 实验部分
1.1 试验原料
浓盐酸,分析纯;3-丁烯腈(C4H5N)、3-丁烯酰胺(C4H7ON)以及3-丁烯酸,自制(质量分数≥99%);乙醚,乙醇,去离子水等。
1.2 实验装置及操作
反应装置主体为500 mL玻璃烧瓶(包括取样口和搅拌装置等),配以玻璃球形冷凝管以及油浴等仪器。装置的使用温度在200℃以内,常压下进行。
实验过程如下:首先对反应仪器进行洗涤(用水和乙醇各洗涤3次)和干燥,然后按规定比例加入所需反应物质,其中V(乙醇):V(水)=1:1;冷凝管中通入冷却水,把油浴升到相应的温度并开始搅拌 (转速150 r/min),随着反应的进行,每隔一段时间对反应液进行取样,处理后进行分析。反应一段时间后可能会有白色晶体析出(盐酸含量较大时),且冷凝管中出现液体回流[3-7]。
3-丁烯腈水解反应式[8]:
取样采用1.0 mL的移液管。取样时先打开取样口,然后迅速移取1.0 mL的液体,放入小试管中待分析。
1.3 分析方法
水解产物分析采用7890F气相色谱仪(GC),定性分析和标准样品对照定性,定量分析用外标法(即标准曲线法)。色谱柱为毛细管柱,FID检测器,分流进样器,柱温100℃,进样温度150℃、检测温度180 ℃、总体积流量 3.4 mL/min、进样量 0.5 μL[9]。
2 结果与讨论
2.1 3-丁烯腈初始含量对水解反应的影响
在温度为353.15 K、盐酸浓度为5.0 mol/L的条件下,试验了3-丁烯腈初始浓度(0.2~0.6 mol/L)对水解反应的影响,结果如图1所示。
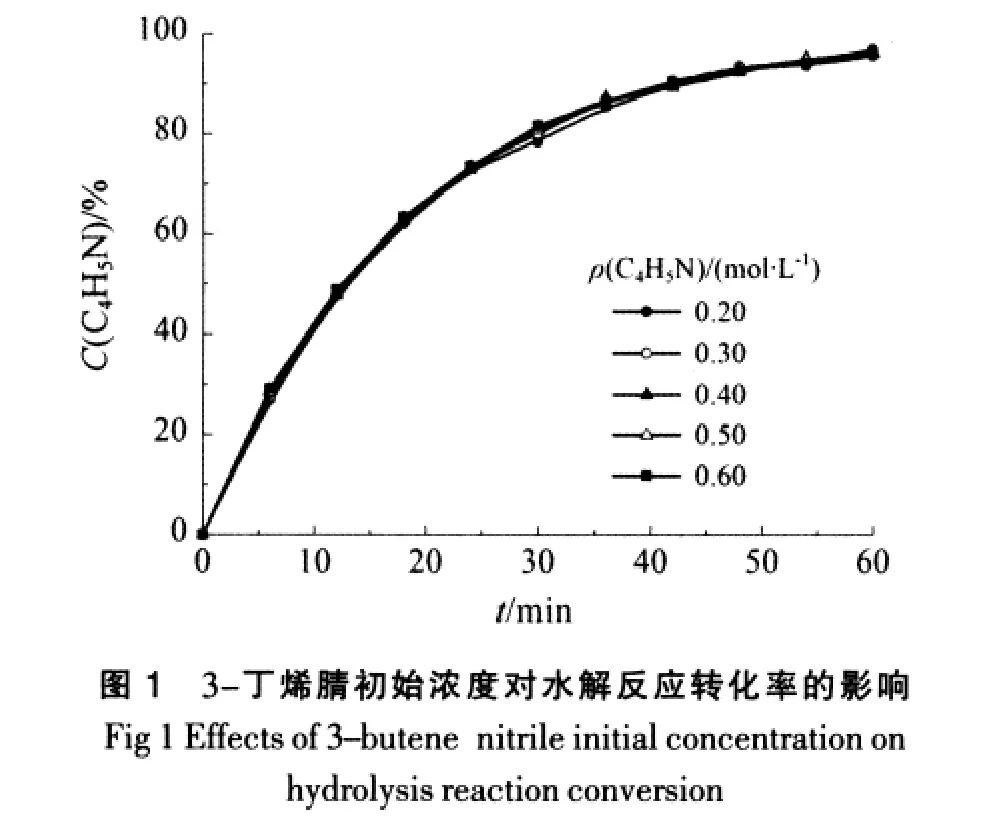
从图1可见,3-丁烯腈的初始浓度对其水解反应的转化率影响较小。因此,以后的试验中,3-丁烯腈的初始浓度选定为0.5 mol/L。
2.2 催化剂含量对3-丁烯酰胺水解反应的影响
在常压、温度为353.15 K条件下,试验了催化剂浓度即盐酸浓度对3-丁烯酰胺水解反应的影响。结果如图2和图3。
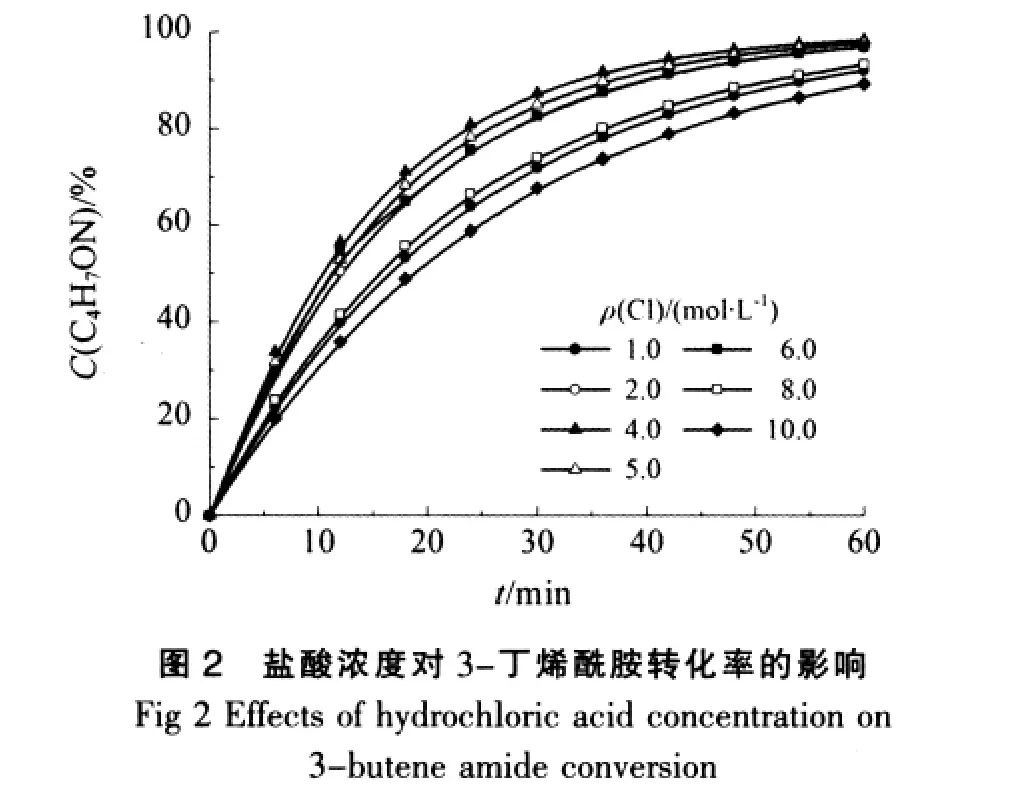
从图2可见,盐酸浓度对3-丁烯酰胺的水解反应有较大的影响:当盐酸浓度小于5.0 mol/L时,随着盐酸浓度的增大,3-丁烯酰胺水解速率随之增加;但盐酸浓度大于5.0 mol/L时,随着盐酸浓度的增大,3-丁烯酰胺水解速率开始降低。
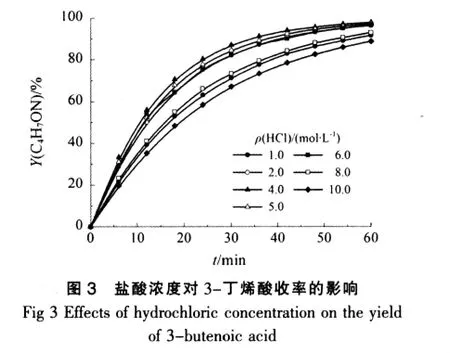
比较图2和图3可知,2者相应的曲线较为吻合,说明3-丁烯酰胺水解生成3-丁烯酸具有很高的选择性,3-丁烯酰胺的水解反应中几乎没有其他副产物的产生。
2.3 催化剂含量对3-丁烯腈水解反应的影响
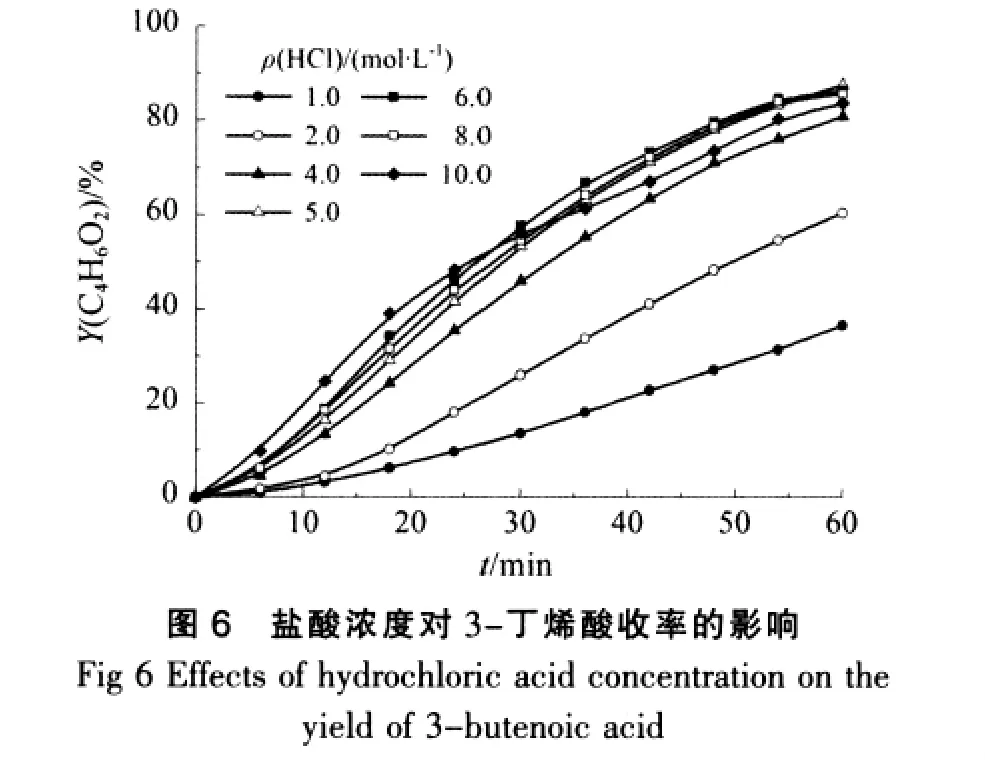
催化剂含量即盐酸浓度对水解反应有重要的影响,研究表明,酸浓度和腈类水解反应的活化能Ea和指前因子A有着密切的关系,所以以3-丁烯腈为反应物,在温度为353.15 K时,试验不同盐酸浓度下对3-丁烯腈水解反应的影响,结果如图4~图6所示。
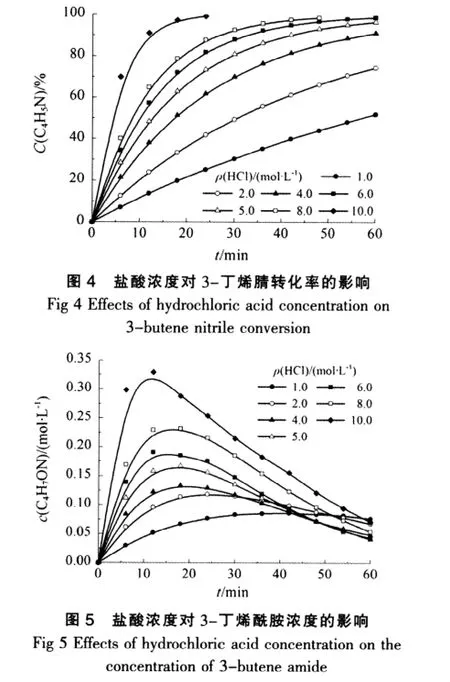
从图4可见,在其他条件不变的情况下,随着盐酸浓度的增加,3-丁烯腈的水解速率也不断增加,且盐酸浓度越大,3-丁烯腈的转化率增加的越快。由图5以及结合图2可以看出,盐酸浓度同样影响3-丁烯酰胺的生成及其水解反应,每个盐酸浓度下3-丁烯酰胺在反应时间内的浓度都存在1个极大值,随着盐酸浓度的增大,3-丁烯酰胺浓度的极大值也随着变化,且达到极大值的时间逐渐缩短,其极大值后浓度降低的速度逐渐缓慢。这种变化关系和图2中的3-丁烯酰胺在不同盐酸浓度下水解速率的变化关系相对应。
由图6并结合图2可以看出,在反应时间内,3-丁烯酸的收率随着反应时间的延长而增大,当盐酸浓度较低时,3-丁烯酸收率曲线平缓上升;当盐酸浓度较高时,3-丁烯酸收率曲线刚开始较为陡峭,然后增加较为缓慢,达到最大收率的时间延长。
近年来,江西省重视茶产业发展,在政策方面,出台了《关于推进全省茶叶品牌整合的实施意见》等一系列政策文件;在经济方面,政府每年整合一亿元资金集中扶持江西的特色茶叶发展,即“四绿一红”,分别是浮梁茶、婺源绿茶、狗牯脑茶、庐山云雾茶和宁红茶五个省级重点茶叶品牌;在文化方面,积极开展江西茶叶博览会,邀请世界各国各地区的人们来参加,更加深入了解江西茶叶的各个方面,推动茶叶文化的交流从而促进茶叶出口。
2.4 温度对3-丁烯腈水解反应的影响
在常压、3-丁烯腈初始浓度为0.50 mol/L、盐酸浓度为5.0 mol/L的条件下,试验了不同反应温度下对3-丁烯腈水解反应的影响,结果如图7~图9所示。
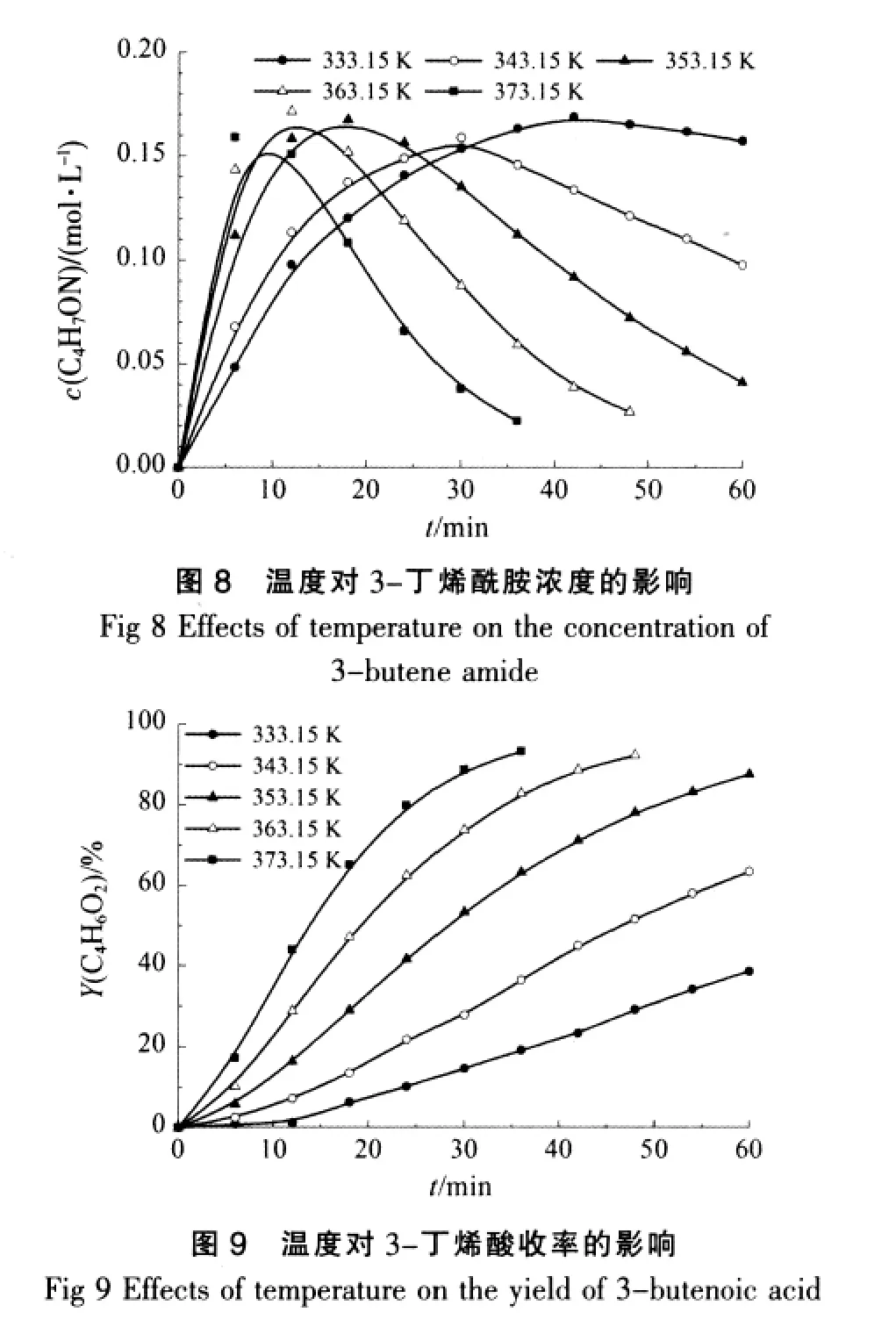
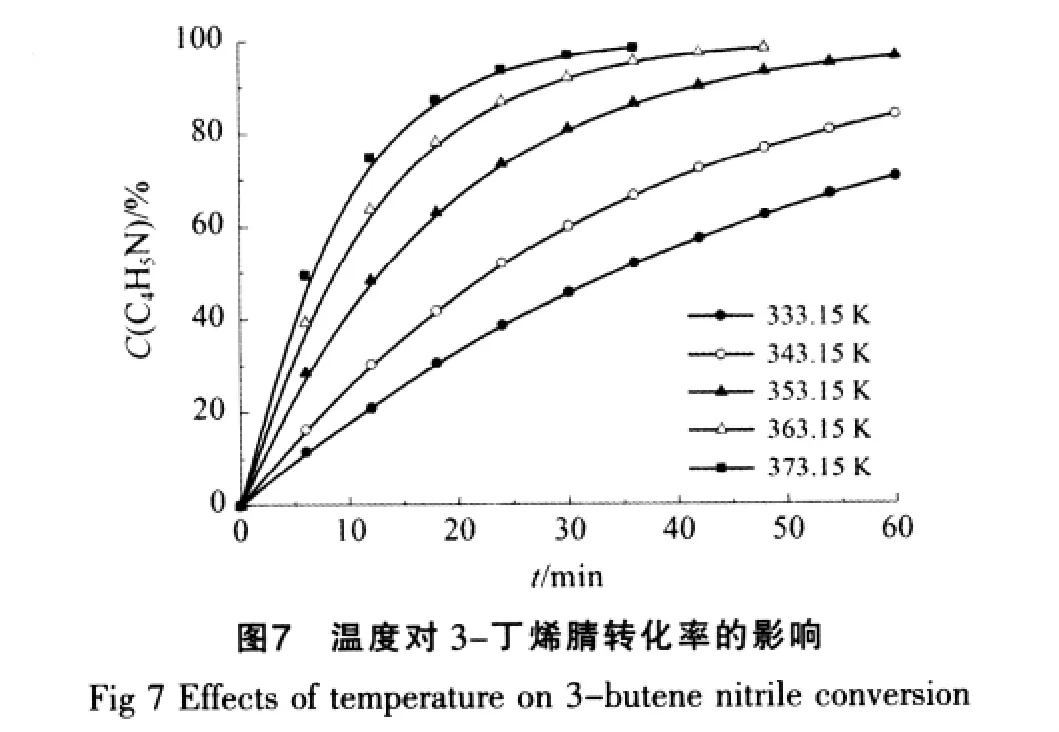
从图7可见,在其他条件不变的情况下,温度对3-丁烯腈的水解反应具有很大的影响,3-丁烯腈的转化率随着温度的升高而逐渐增大。在温度为333.15 K时,在反应60 min时其转化率还未达到80%;当反应温度为373.15 K时,3-丁烯腈转化率达到约98%,所需的反应时间才为36 min。由图8可以看出,3-丁烯酰胺在水解反应中存在一最大值,只是到达最大值的反应时间存在着快慢。在本实验条件下3-丁烯酰胺的最大浓度可达到约0.172 mol/L。
从图9可见,3-丁烯酸的收率曲线变化趋势也出现波动,结合图8分析,反应开始阶段,体系中主要存在3-丁烯腈和3-丁烯酰胺,即3-丁烯腈水解产生的3-丁烯酰胺并不能很快的完全水解产生3-丁烯酸,但随着反应时间的延长,积累的3-丁烯酰胺开始转化为3-丁烯酸,这时3-丁烯酸的收率就增加的较快。
2.5 温度对3-丁烯酰胺水解反应的影响
在常压、3-丁烯酰胺初始浓度为0.50 mol/L、盐酸浓度5.0 mol/L条件下,试验了不同反应温度下对3-丁烯酰胺水解反应的影响,结果如图10~图11所示。
从图10可见,3-丁烯酰胺的转化率同样随着温度的升高而增大,温度为333.15 K时,反应60 min时,3-丁烯酰胺的转化率76%;而温度为373.15 K时,反应在30 min时3-丁烯酰胺的转化率已达到了近98%。
2.6 水解反应动力学
3-丁烯腈的水解反应为典型的单分子、不可逆的连串反应,其水解反应的动力学方程可表达为[10-14]:
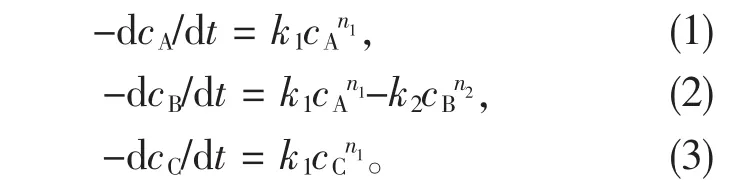
其中:cA、cB、cC分别为 3-丁烯腈、3-丁烯酰胺以及3-丁烯酸的浓度,k1和k2分别为2步反应的速率常数,n1、n2为反应级数。
当n1≠1时,对式(1)进行积分,即:

cA,0为3-丁烯腈的初始浓度。对式(4)简化处理后得:
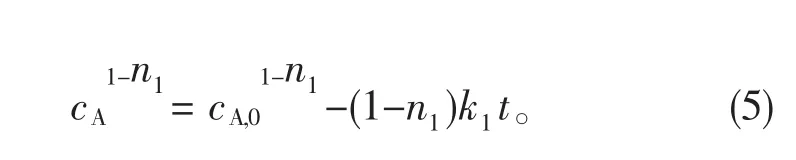
用Origin软件对式(5)进行非线性拟合,但结果显示此方程并不收敛;当n1=n2=1时,对(1)式积分得:
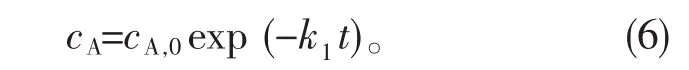
用Origin软件对式(6)进行非线性拟合,结果显示方程收敛且得到很好的线性关系。同理,当n2≠1,对式(3)进行积分,用Origin软件进行非线性拟合,同样也不收敛;而n2=1时方程收敛且有较好的线性关系。所以3-丁烯腈水解反应为单分子、不可逆的一级连串反应。
将式(6)代入式(2)和式(3),整理并积分可得到3-丁烯酰胺与3-丁烯酸浓度的变化关系:
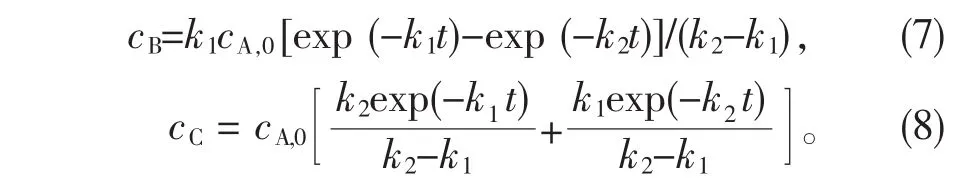
又 cA=cA,0(1-x1),其中 x1为 3-丁烯腈的转化率,故式(6)可变形为ln(1-x1)=-k1t。于是以时间t为横坐标,-ln(1-x)为纵坐标作图,拟合盐酸浓度为5.0 mol/L的条件下的3-丁烯腈及酰胺水解数据,即可求得反应速率常数 k1、k2,见表 1。
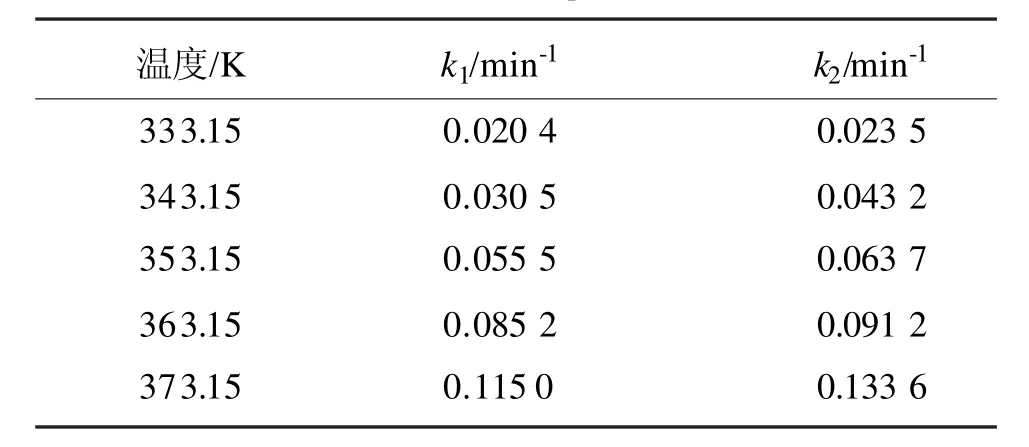
表1 不同温度下3-丁烯腈水解速率常数Tab 1 Hydrolysis rate constants of 3-butene nitrile at different temperature
用 Arrhenius方程(k=Aexp(Ea/RT))关联表 1中的数据,以y=-ln(k/min-1)为纵坐标,以x=1/T为横坐标,用Origin多方程进行拟合,其结果见图12所示。
从图12可知,在盐酸浓度为5.0 mol/L时3-丁烯腈水解反应的活化能Ea1、Ea2分别为46.42 kJ/mol和 43.83 kJ/mol,指前因子分别为 3.83×10-5min-1和1.88×10-5min-1。然后可得到3-丁烯腈在盐酸浓度为5.0 mol/L时,水解反应速率常数:
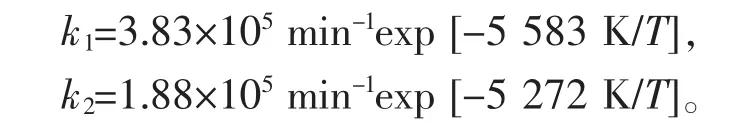
将 k1和 k2代入式(4)、(5)和式(6),即可拟合出理论上3-丁烯腈连续水解中3-丁烯腈转化率、3-丁烯酰胺浓度变化以及3-丁烯酸收率的曲线。拟合结果和理论值较为接近,更充分证明3-丁烯腈水解反应是1级连串反应。
通过前面的分析可知,盐酸浓度对3-丁烯腈水解反应有很大的影响,所以根据前面动力学分析的方法,拟和了不同盐酸浓度下3-丁烯腈水解的相关动力学数据,见表2所示。


表2 不同盐酸浓度下3-丁烯腈水解反应的Arrhenius常数Tab 2 The Arrhenius constants of the hydrolysis reaction of 3-butene nitrile at various concentrations of hydrochloric acid
从表2可看出,和其他酸催化腈水解相同,随着盐酸浓度的增大,3-丁烯腈水解活化能逐渐减小:盐酸浓度为1.0 mol/L时,3-丁烯腈水解反应活化能Ea1为76.24 kJ/mol,3-丁烯酰胺水解反应活化能Ea2为52.8 kJ/mol;而当盐酸浓度增大到10.0 mol/L时,3-丁烯腈水解反应活化能下降到42.36 kJ/mol,3-丁烯酰胺水解反应活化能却上升到了54.17 kJ/mol。
3 结论
1)建立了1种3-丁烯腈在盐酸条件下水解制备3-丁烯酸的方法,在对反应物初始浓度对水解反应影响的基础上,分析了不同温度、不同盐酸浓度下3-丁烯腈和3-丁烯酰胺的水解反应动力学数据。
2)通过对反应数据的拟合,说明3-丁烯腈水解反应的实验数据符合1级连串反应动力学模型;根据不同盐酸浓度下的水解实验数据,采用Arrhenius方程拟合不同反应温度下的反应速率常数;结果发现盐酸浓度对水解反应速率常数有很大的影响:当盐酸的浓度低于5.0 mol/L时速率常数的关系为k1<k2;当盐酸浓度大于6.0 mol/L时速率常数的关系为k1>k2;且随着盐酸浓度的增大,腈水解反应活化能逐渐减小,盐酸浓度为5.0 mol/L时,3-丁烯腈和3-丁烯酰胺水解反应的活化能为46.42 kJ/mol-1和43.83 kJ/mol-1,3-丁烯腈水解反应的速率常数为:k1=3.83×105min-1exp[-5 583 K/T],k2=1.88×105min-1exp[-5 272 K/T]。
3)研究工作为3-丁烯酸的制备、动力学的研究及其反应器的模拟和设计提供了重要的参考数据。
[1]Williamp Baugh,Jaead H Murib.Process for Preparing Carboxylic Acids:US,4801743[P].1989-01-31.
[2]Edward Rietz.Vinylacetic Acid[J].Organic Syntheses:Coll,1955,3:851-855.
[3]Rabinovitch B S,Winkler C A.The hydrolysis of amides in concentrated Hydrochloric acid solutions[J].Canadian Journal ofresearch,1942,20:73-81.
[4]Rabinovitch B S,Winkler C A.The hydrolysis of propionitrile in Concentrated hydrochloric acid solutions[J].Canadian Journal of research,1942,20:121-132.
[5]Krieble Vk,Noll C I.The hydrolysis of nitriles with acids[J].Journal of American Chemical Society,1939,61:560-563.
[6]Rabinovitch B S,Winkler C A.Kintics of alkaline hydrolysis of propionitrile[J].Canadian Journal of research,1942,20:185-188.
[7]Rabinovitch B S,Winkler C A.The hydrolysis of aliphatic nitriles in concentrated hydrochloric solutions[J].Canadian Journal of research,1942,20:221-230.
[8]Bill Izzo,Michael T Klein.Hydrothermal Reaction of Saturated and Unsaturated Nitriles:Reactivity and reaction pathway Analysis[J].Ind Eng Chem Res,1999,38:1183-1191.
[9]王立,汪正范.色谱分析样品处理[M].北京:化学工业出版社,2006.
[10]郑和辉,叶常明.乙草胺和丁草胺的水解及其动力学[J].环境化学,2001,20(2):168-171.
[11]Peigao Duan,Shuang Li,Zhizhong Wang.Hydrolysis kinetics and mechanism of adipamide in high-temperature water[J].Chemical Enginerring Research and Design,2010(88):1067-1072.
[12]石超君,吕秀阳.近邻界水中苯乙腈无催化水解反应动力学[J].高校化学工程学报,2009,23(2):252-257.
[13]Jarugu Narasimha Moorthy,Nidhi Singhal.Facile and Highly Selective Conversion of Nitriles to Amides via Indirect Acid-Catalyzed Hydration Using TFA or AcOHH2SO4[J].J Org Chem,2005,70:1926-1929.
[14]B Klein,M T.LaMarca,Scrivner NC.Hydrothermal reaction of saturated and unsaturated nitriles:reactivity and reaction pathway analysis[J].Ind Eng Chem Res,1999,38(4):1183-1191.
Research on the Hydrolysis Kinetics of 3-Bentene Nitrile in Hydrochloric Acid Solution
Wang Guowei1,Si Linxu1,Chen Tingyu1,Long Xiangli2,Lu Hong2
(1.Changshu 3F Fluorochemical Industry Co.,Ltd.Changshu,Jiangshu 215522;2.East China University of Science and Technology,Shanghai 200237)
3-Butenoic acid was synthesized by hydrolyzing 3-bentene nitrile using the catalyst of hydrochloric acid.The initial concentration of 3-bentene nitrile,reaction temperature and hydrochloric acid concentration on hydrolysis process were researched;Then hydrolysis kinetics of 3-bentene nitrile were researched,and the reaction rate constants and active energy were simulated;Through kinetic researching,the results showed that the reaction was a level 1 serial reaction,while the hydrochloric acid concentration has a great influence on the hydrolysis reaction rate constant:when the concentration of hydrochloric acid was lower than 5.0 mol/L,the relationship between the constant velocity was k1<k2;the concentration of hydrochloric acid was higher than 6.0 mol/L,the constant velocity was k1>k2;And with the increasing of concentration of hydrochloric acid,the reaction activation energy decreased.
3-butene nitrile;acid-catalyzed hydrolysis;3-Butenoic acid;kinetics
TQ225.13+4
ADOI10.3969/j.issn.1006-6829.2012.02.007
2012-02-11

