阿昔洛韦的合成工艺改进
李坚军鞠金军 蒲 通 郭晶晶 俞传明
(1.浙江工业大学,绿色制药技术与装备教育部重点实验室,杭州 310014;2.浙江车头制药股份有限公司,浙江 仙居 317321)
研究与开发
阿昔洛韦的合成工艺改进
李坚军1*鞠金军1蒲 通2郭晶晶1俞传明1
(1.浙江工业大学,绿色制药技术与装备教育部重点实验室,杭州 310014;2.浙江车头制药股份有限公司,浙江 仙居 317321)
设计了1条以NaHSO4为催化剂合成阿昔洛韦的新工艺,以醋酐和1,3-二氧戊环为起始原料,合成2-氧杂-1,4-丁二醇二乙酯,然后再与乙酰化后的鸟嘌呤发生缩合制得双乙酰阿昔洛韦,双乙酰阿昔洛韦在Na2CO3水溶液中水解得到目标产物阿昔洛韦。考察了该工艺中反应温度、催化剂用量、溶剂等对反应收率和产品质量的影响。结果表明,在合成关键中间体2-氧杂-1,4-丁二醇二乙酯中,反应温度宜选用60℃;合成双乙酰鸟嘌呤时n(鸟嘌呤):n(cat)=1.0:0.1为较佳;合成双乙酰阿昔洛韦时选用甲苯作为反应的较佳溶剂。总收率达到79%,并且产物纯度较高,适合工业化生产。
鸟嘌呤;2-氧杂-1,4-丁二醇二乙酯;阿昔洛韦;合成;硫酸氢钠
阿昔洛韦(ACV),又名无环鸟苷,英文名acyclovir,化学名为9-[(2-羟基乙氧基)甲基]-鸟嘌呤,为一种高效广谱的抗病毒药,已被列入国家基本治疗药物,市场需求量大。该药对I型及II型单纯疱疹及带状水痘病毒高度有效,随着人们研究的深入,该类药物还可以应用于抗HIV病毒[1]。
阿昔洛韦自1981年英国上市以来,它的合成方法和生产工艺研究一直受到人们的重视,至今已有多种合成方法:
1)以2-氯-6-碘嘌呤为原料,先与三甲基硅氧乙基碘甲醚缩合生成2-氯-9-[(2-羟乙氧基)甲基]-6-碘嘌呤,再在K2CO3作用下使6位碘被氧杂化,加压使2位氯氨化得产品,总收率60%[2]。该工艺在第1步中要求-78℃的低温和严格无水条件。
2)以2,6,9位硅烷化的鸟嘌呤为原料,与2-氧杂-1,4-丁二醇二乙酯(OBDDA),在碘和磷酸盐的催化下缩合成为9-位取代的产物,然后再水解得产物,收率 35%[3]。
3)以鸟嘌呤为原料,先经过乙酰化生成N2,N9-双乙酰鸟嘌呤(DAG),然后与2-氧杂-1,4-丁二醇二乙酯缩合生成双乙酰阿昔洛韦(DACV),再水解得目标产物,但在缩合过程中会生成7位双乙酰阿昔洛韦(7-DACV),影响产品的质量[4];
4)以2-氨基-6-氯嘌呤为原料,经硅烷化后,与乙酰溴代甲氧乙酯缩合,水解得目标产物,收率64%。要用到剧毒的Hg(CN)2[5-6]。
在前人的不断研究中,阿昔洛韦的生产工艺日渐成熟,但普遍还存在以下问题:原料价格昂贵,用到有毒试剂,产品品质低、收率低,产品分离困难。这些问题给阿昔洛韦的工业化生产带来了诸多困难。
本研究在参考以上路线及文献的基础上,选用以鸟嘌呤为原料,先经乙酰化生成DAG,然后再与OBDDA缩合生成DACV这条路线[7-9]。为了减少该路线传统工艺中产率较低、后处理困难、各步催化剂不同造成交叉污染等不足,选用NaHSO4作为合成阿昔洛韦的催化剂,该催化剂是一种无机盐催化剂,不仅价格低,还能够应用到阿昔洛韦的整个合成过程中,避免了交叉污染。
1 实验部分
1.1 仪器与试剂
Shimadzu-GC2010 气相色谱仪(GC),Varian-400 MHz核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标),WRS-1B熔点测定仪测定(温度未较正),Agilent-1200series液相色谱仪,ZF-Ⅰ型三用紫外分析仪。
鸟嘌呤为化学纯,醋酐和1,3-二氧五环为工业级,TLC板自制(硅胶GF 254),使用前活化,其余所用试剂为化学级或工业级。
1.2 合成实验
1.2.1 OBDDA
在100 mL三口烧瓶中,加入15.3 g(0.15 mol)醋酐(AC2O)、0.42 g(3.6 mmol)NaHSO4,室温 25 ℃下搅拌,然后向烧瓶中缓慢滴加1,3-二氧五环7.4 g(0.1 mol),滴加完毕后,升温至60℃反应4 h。反应式为:
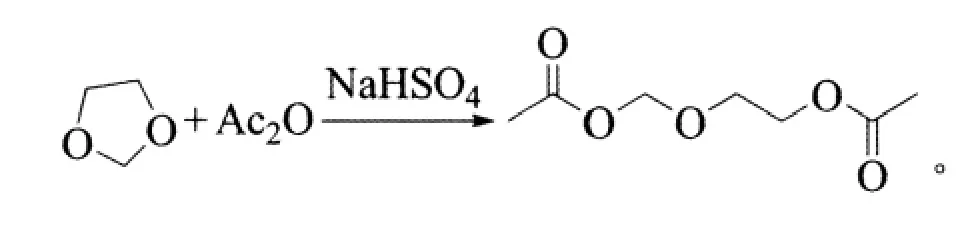
反应过程用GC检测直至粗品含量不再增加时,停止反应。将混合物减压蒸馏(133.3 kPa),收集110℃的馏分即得产物,收率81%,纯度99.1%。1HNMR(400 MHz,CDCl3):δ=5.16(s,2H,OCH2O),4.14~4.09 (m,2H,CH2),3.73~3.71 (m,2H,CH2),1.97(s,3H,COCH3),1.95 (s,3H,COCH3);13C-NMR (CDCl3,100 MHz):δ=170.6,170.2,88.8,67.9,63.0,20.8,20.6。1.2.2 DAG
在500 mL单口烧瓶中加入鸟嘌呤30.2 g(0.2 mol)、0.72 g(6 mmol)NaHSO4、200 mL 醋酐和 100 mL冰乙酸(AcOH),然后回流反应12 h。反应式为:

反应结束后,减压蒸馏除去部分溶剂,剩余物过滤,滤饼依次用乙醇和水洗涤,后放入烘箱中80℃烘干,得 DAG 43.2 g,收率 92%。1H NMR(400 MHz,DMSO):δ=8.45(s,1H,Ar-H),2.81(s,3H,CH3),2.21(s,3H,CH3);13C NMR (DMSO,100 MHz):δ=173.4,168.0,154.4,148.3,147.6,137.4,24.6,24.0。
1.2.3 DACV
在500 mL四口烧瓶中加入30 g(0.128 mol)DAG、1.53 g(12.8 mmol)NaHSO4、200 mL 甲苯,机械搅拌。升温加热回流分水,待分水完毕后,开始滴加45 g(0.246 mol)OBDDA,滴加完毕后,回流反应 10 h。反应式为:

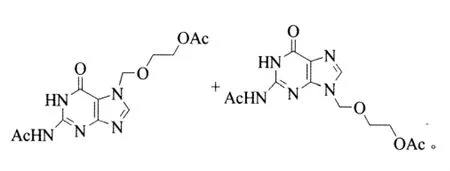
停止加热、冷却、过滤、滤饼水洗、然后放入烘箱烘干,得35.8 g DACV,收率90.5%,高效液相色谱分析(HPLC)纯度 98.9%,熔点 185.4~191.1 ℃(文献为 189~190 ℃[7]);1H NMR(400 MHz,DMSO):δ=12.04 (s,1H,NH),11.75 (s,1H,NH),8.12 (s,1H,CH),5.47 (s,2H,NCH2),4.06 (t,J=4.8 Hz,2H,OCH2),3.68(t,J=4.8 Hz,2H,CH2O),2.18 (s,3H,CH3CO),1.95(s,3H,COCH3);13C NMR (DMSO,100 MHz):δ=173.2,169.9,154.6,148.6,147.9,139.8,120.0,72.3,66.6,62.6,23.8,20.6;MS(ESI):m/z=308.0[M-H]-。
1.2.4 ACV
在500 mL三口烧瓶中加入 15.4 g(0.05 mol)DACV、15g(0.14 mol)Na2CO3、150 mL H2O、2.0 g 活性炭,加热回流2 h,趁热过滤,滤液用18 mol/L的盐酸调pH至7,有大量白色固体析出,加热溶解,冷却,过滤,烘干。反应式为:

最终得白色粉状固体ACV 10.7 g,收率95.4%,熔点 255.5~257 ℃(文献为 256~257 ℃[7])。1H NMR(400 MHz,DMSO):δ=10.56(s,1H,NH),7.76(s,1H,NCHN),6.46 (s,2H,NH2),5.31 (s,2H,NCH2O),4.65(s,1H,OH),3.45~3.41(m,4H,OCH2CH2O);13C NMR(DMSO,100 MHz):δ= 156.6,153.6,151.2,137.6,116.3,72.0,70.4,59.9;MS(APCI):m/z=224.1[M-H]-。
2 结果与讨论
2.1 影响OBDDA收率与纯度的因素
1,3-二氧戊环的开环反应是一个放热反应,温度对该反应的影响较大,温度过高会导致副产物含量上升[10]。因此重点对合成OBDDA的反应温度做了考察,结果如表1所示。
表1表明,60℃是合成OBDDA的适宜温度条件。同时,对反应时间进行了考察,实验发现,该反应在保温4 h后延长反应时间,产率基本不变,因此选用4 h作为反应的适宜反应时间。
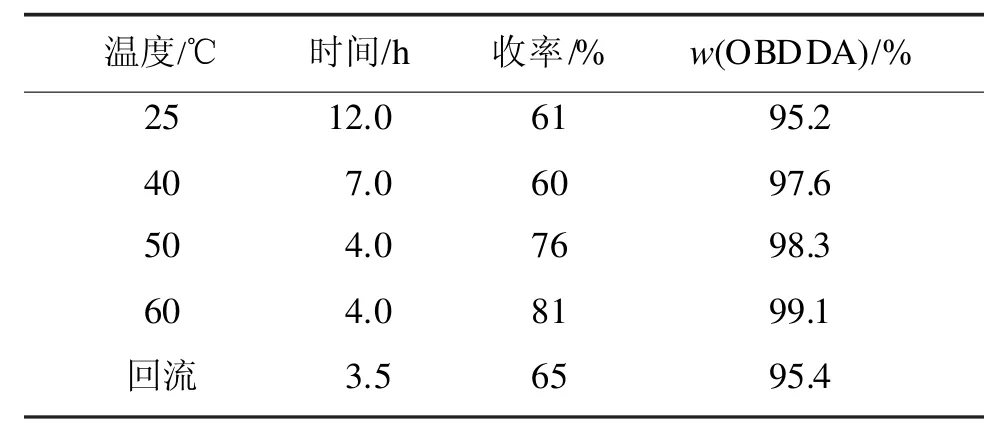
表1 反应温度对合成OBDDA收率的影响Tab 1 The effect of the temperature on yields of OBDDA
2.2 影响DAG收率的因素
催化剂用量是影响DAG合成收率的一个重要因素,因此对催化剂(cat)的用量进行了考察,结果如表2所示。
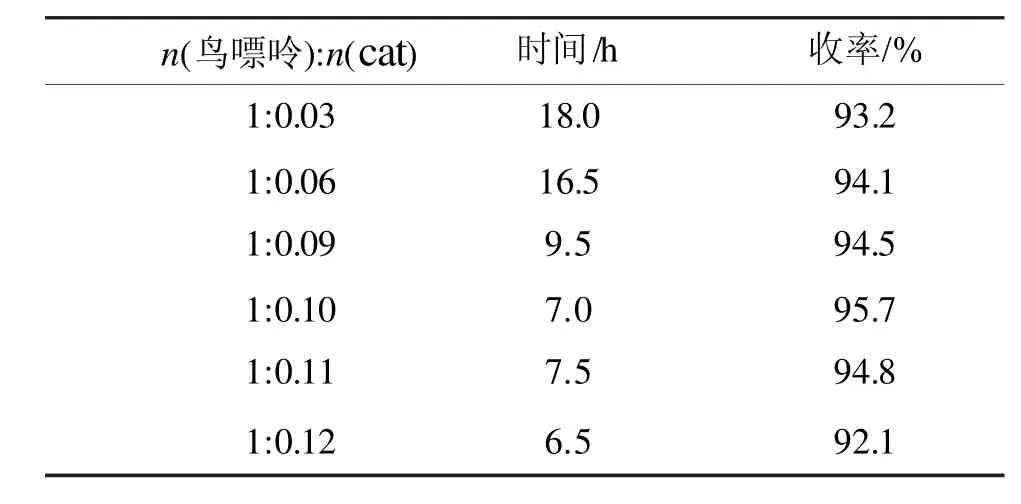
表2 催化剂用量对合成DAG收率的影响Tab 2 The effect of the catalyst dosage on yields of OBDDA
由表2可知,增大催化剂用量能减少反应时间,提高收率,但是随着催化剂用量的持续增加,副产物较多导致收率下降。因此选用n(鸟嘌呤):n(cat)=1:0.10作为反应的适宜条件。
2.3 影响DACV产率和纯度的因素
在DACV的合成过程中会生成7-DACV,该物质掺杂其中较难分离。据报道,7-DACV为动力学产物,DACV为热力学产物,温度越高,越容易形成DACV[7]。鉴于温度对该反应有较大影响,对不同沸点的溶剂甲苯、N,N′-二甲基甲酰胺、DMF二甲基亚砜(DMSO)、二甲苯、乙醇(EtOH)、二氯甲烷(DCM),进行了筛选,结果如表3所示。
表3表明,甲苯为较优溶剂,产品产率和含量都比较高。虽然温度越高越有利于DACV的生成,但比甲苯沸点高的溶剂效果都不如甲苯,使用这些溶剂不仅产品产率低、纯度差,同时还增加了能耗,不利于工业化。相反,沸点较甲苯低的溶剂虽然会降低能耗,但产品产率低。另外选用甲苯作溶剂还有一个优点,即后处理更加简便,仅仅通过过滤、水洗即能得到较高纯度的产品,适用于工业化生产。

表3 溶剂对合成DACV收率的影响Tab 3 The effect of the solvents on yields of DACV
在合成ACV的过程中,水解原料由传统的甲胺水溶液换成固体的Na2CO3,易于投料,后处理简单,降低了三废处理的成本,同时还运用水作为重结晶溶剂,既降低了成本又提高了产品品质。
3 结论
开发了1条以NaHSO4为催化剂合成ACV的新工艺,首先以醋酐和1,3-二氧五环为起始原料,合成OBDDA,反应温度选用60℃;然后再与乙酰化后的鸟嘌呤发生缩合制得DACV,n(鸟嘌呤):n(cat)=1:0.10为最宜,选用甲苯作为反应的溶剂,可大大降低副产物收率;DACV水解时选用Na2CO3替代传统工艺的甲胺水溶液,易于操作,总收率达到79%。
该工艺主要以NaHSO4为催化剂,在提高产品质量和收率的同时,避免了多种催化剂带来的交叉污染。经改进后的工艺具有操作简便、原料价廉易得、反应总收率较高、生产安全等特点,更有利于工业化生产。
[1]Derudas M,Carta D,Brancale A,et al.The Application of Phosphoramidate Protide Technology to Acyclovir Confers Anti-HIV Inhibition[J].Journal of Medicinal Chemistry,2009,52:5520-5530.
[2]Barrio J R,Bryant J D,Keyser G E.A direct method for the preparation of 2-hydroxymethyl derivatives of guanine,adenine and cytosine[J].Journal of Medicinal Chemistry,1980,23:572-574.
[3]Lazrek H B,Baddi L,Smietana M,et al.One-pot synthesis of antiviral acyclovir and other nucleosides derivatives using doped natural phosphate as lewis acid catalyst[J].Nucleosides,Nucleotides&Nucleic Acids,2008,27(10/11):1107-1112.
[4]Matsumoto H,Kaneko C,Yamada K,et al.A convenient synthesis of 9-(2-hydroxyethoxymethyl)guanine(acyclovir)and related compounds[J].Chem.Pharma.Bull,1988,36(3):1153-1157.
[5]Robins M J,Hatfield P W.Nucleic acid related compounds:convenient and highyield synthesis of N-[(2-hydroxyethoxy)-methyl]-heterocycles as"acyclic nucleoside"analyogues[J].Canidian Journal of Chemistry,1982,60:547-553.
[6]谢瑜,金珠,韩璐.阿昔洛韦的制备方法:中国,101195621[P].2008-06-11.
[7]Singh D,Wani M J,Kumar A.A Simple Solution to the Age Old Problem of Regioselective Functionalization of Guanine:First Practical Synthesis of Acyclic N9-and/or N7-Guanine Nucleosides Starting from N2,N9-Diacetylguanine[J].Journal of Organic Chemistry,1999,64:4665-4668.
[8]Gao H W,Mitra A K.Regioselective synthesis of acyclovir and its various prodrugs[J].Synthetic Communicaions,2001,31(9):1399-1419.
[9]Chu C K,Du J F.Synthesis of acyclic guanine nucleosides:US,5583225[P].1996-12-10.
[10]张明.环氧丙烷开环酯化反应的合成与量子化学理论研究[D].武汉:武汉理工大学,2007.
Improvement on the Synthesis Process of Acyclovir
Li Jianjun1,Ju Jinjun1,Pu Tong2,Guo Jingjing1,Yu Chuanming1
(1.Key Laboratory for Green Pharmaceutical Technologies and Related Equipment of Ministry of Education,Zhejiang University of Technology,Hangzhou 310014;2.Zhejiang Charioteer Pharmaceutial CO.,LTD,Xianju,Zhejiang 317321)
A new process for the preparation of acyclovir which takes NaHSO4as catalyst was designed.First 2-oxa-1,4-butanediol diacetate was synthesized from acetic anhydride and 1,3-dioxycyclopentane,followed by condensation with acetyl guanine to get diacetylacylovir.Acyclovir was obtained from diacetylacylovir by hydrolyzed in the presence of Na2CO3.The effects of catalyst dosage,reaction temperature and solvent on the yields and product quality were discussed.The better temperature of synthesis 2-oxa-1,4-butanediol diacetate was 60℃and the better mass ratio of n(guanine):n(cat)=1.0:0.1 in the preparation of acetyl guanine.In the preparation of diacetylacylovir the better solvent was toluene.The overall yield of this process was up to 79%and the products had high purity which fit for large production.
guanine;2-oxa-1,4-butanediol diacetate;acyclovir;synthesis;NaHSO4
TQ463+.5
ADOI10.3969/j.issn.1006-6829.2012.02.004
*通信联系人。E-mail:lijianjun@zjut.edu.cn
2012-01-30

