子痫前期患者胎盘组织和人脐静脉内皮细胞中即刻早期反应基因X-1蛋白的表达
耿莉娜,韩丽萍,张晓雪,李萌萌,赵先兰
郑州大学第一附属医院妇产科郑州 450052
#通讯作者,女,1969年8月生,博士,教授,主任医师,研究方向:妇科内分泌与肿瘤,E-mail:hanlp0825@yahoo.com.cn
子痫前期患者胎盘组织和人脐静脉内皮细胞中即刻早期反应基因X-1蛋白的表达
耿莉娜,韩丽萍#,张晓雪,李萌萌,赵先兰
郑州大学第一附属医院妇产科郑州 450052
#通讯作者,女,1969年8月生,博士,教授,主任医师,研究方向:妇科内分泌与肿瘤,E-mail:hanlp0825@yahoo.com.cn
即刻早期反应基因X-1;子痫前期;胎盘;人脐静脉内皮细胞
目的:探讨子痫前期(PE)患者胎盘组织和人脐静脉内皮细胞(HUVEC)中即刻早期反应基因X-1(IEX-1)蛋白的表达。方法:应用免疫组化SP法检测10例轻度PE、20例重度PE患者和20例正常足月孕妇(正常妊娠组)胎盘组织中IEX-1蛋白的表达。将HUVEC分别用胎牛血清(阴性对照组)、正常晚孕妇静脉血清(正常妊娠组)和重度PE患者血清(重度PE组)孵育24 h,然后应用细胞免疫化学法检测细胞中IEX-1蛋白的表达,采用MTT法检测细胞增殖抑制率。结果:IEX-1蛋白主要表达于胎盘绒毛滋养细胞及蜕膜细胞的胞质,3组胎盘绒毛滋养细胞及底蜕膜细胞中的表达差异有统计学意义(H=26.620、16.932,P<0.001),重度PE组的表达强于轻度PE组(P<0.05),轻度PE组强于正常妊娠组(P<0.05)。正常妊娠组及重度PE组HUVEC胞质中有IEX-1蛋白的表达,且较阴性对照组明显增强(H=11.495,P=0.003)。阴性对照组、正常妊娠组和重度PE组HUVEC细胞增殖抑制率差异有统计学意义(F=113.438,P<0.001),重度PE组高于其他2组(P<0.05)。结论:IEX-1可能通过调节滋养细胞及蜕膜细胞凋亡,参与内皮细胞损伤过程,在PE发病中起着重要作用。
子痫前期(preeclampsia,PE)是人类妊娠期所特有的疾病,以蛋白尿和高血压为主要特征,是导致围产期孕产妇和婴儿病率及死亡率增高的重要原因之一,其病理机制可能与血管内皮损伤、母-胎免疫平衡失调、滋养细胞缺血等有关。即刻早期反应基因X-1(immediate early response gene X-1,IEX-1)作为“即刻早期基因”成员,能在生长因子、炎症因子及缺血缺氧等因素诱导下快速表达,进而调控细胞的生长、增殖、分化和凋亡等各过程[1-5]。作者对PE患者胎盘组织和人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中IEX-1的表达进行检测,探讨其与PE发病的关系。
1 材料与方法
1.1 胎盘标本的来源及处理
1.1.1 临床资料 选取2010年9月至12月在郑州大学第一附属医院住院分娩的50例产妇作为研究对象,其中PE患者30例(包括轻度PE 10例,重度PE 20例),正常晚孕妇20例(正常妊娠组)。轻度PE、重度PE和正常妊娠组的年龄分别为21~40 (31.5±5.6)岁、22~41(32.1±5.6)岁、22~38 (29±4.4)岁;孕周分别为35+1~40+2(37.6±1.1)周、34+3~39+3(36.7±0.9)周、36~41+5(38.3± 1.2)周。PE的诊断标准参照《妇产科学》第 7版[5],均排除有糖尿病、心脏病、免疫系统疾病、肝肾疾病等慢性疾病史的孕妇。
1.1.2 胎盘标本 胎盘自然娩出后,迅速选取母面中央约1.0 cm×1.0 cm×1.0 cm两块,避开出血、钙化、机化的部位,用生理盐水反复漂洗后,置入甲醛溶液固定。将胎盘组织常规石蜡包埋,4 μm厚连续切片,用于免疫组化测定。收集10例重度PE患者和正常晚孕妇静脉血各5 mL,制备血清备用。
1.2 HUVEC的来源及处理 HUVECY购自美国ATTCC细胞库,常规培养于含体积分数12%胎牛血清的RPMI 1640培养液中,常规加青霉素400万U/ L、链霉素100万U/L。培养条件为37℃、体积分数5%CO2饱和湿度,2~3 d更换一次培养液。待细胞长满瓶底时,用2.5 g/L胰蛋白酶消化传代。
1.3 检测指标
1.3.1 胎盘组织中IEX-1蛋白检测 切片常规脱蜡至水并微波修复抗原。采用免疫组化SP法检测,按免疫组化SP试剂盒(北京中杉金桥生物技术有限公司)说明书进行操作。一抗为兔抗IEX-1多克隆抗体[2](按300倍稀释),DAB显色,苏木精轻度复染。以PBS代替一抗作为空白对照,采用已知IEX-1蛋白表达阳性的卵巢组织石蜡切片作为阳性对照。阳性细胞主要表现为胞质棕色、褐色着色。根据阳性细胞分布和细胞染色强度确定IEX-1的表达水平。首先,高倍镜下选取5个视野,每个视野计数100个细胞,计算阳性细胞百分比,0%计为0分,<25%为1分,25%~为2分,>50%为3分。再根据细胞染色强度计分:无染色或染色不清为0分,浅黄色为1分,棕黄色为2分,深黄色或褐色为3分。取以上2项的乘积:积分0~1为阴性(-);2~3分为弱阳性(+);4~5分为阳性();>5分为强阳性()。
1.3.2HUVEC中IEX-1蛋白检测 将HUVEC经胰酶消化收集后,分别以5×105个/孔接种于含载玻片的6孔板中,常规培养。至对数生长期时分为阴性对照组、正常妊娠组和重度PE组3组,分别用含体积分数12%胎牛血清、含体积分数12%正常晚孕妇静脉血清和含体积分数12%重度PE患者血清的RPMI 1640培养液孵育细胞。培养24 h,当细胞至80%~90%融合后,弃去培养基,PBS清洗细胞3次,多聚甲醛固定,用Triton液进行细胞通透,用体积分数5%~10%正常山羊血清(PBS稀释)封闭。在细胞爬片上滴加一抗工作液IEX-1(按300倍稀释),37℃孵育1~2 h。PBS冲洗5 min×3次。滴加生物素标记二抗工作液,37℃孵育10~30 min; DAB显色,苏木精复染后常规脱水、透明、封片。镜下观察并摄片。以PBS代替一抗作为空白对照,用已知阳性切片作阳性对照。结果判定方法同1.3.1。
1.3.3HUVEC细胞增殖能力测定 将HUVEC以5×105个/孔接种在96孔板内,细胞分组及培养同1.3.2,每组设3个复孔。培养24 h后,采用MTT法测定细胞增殖能力,按试剂盒说明操作,检测波长490 nm,细胞增殖抑制率=(1-实验组吸光度值/对照组吸光度值)×100%。
1.4 统计学处理 采用SPSS 17.0进行分析,采用秩和检验分析3种胎盘组织及3组HUVEC中IEX-1蛋白的表达水平,用单因素方差分析及LSD-t检验比较3组细胞增殖抑制率,检验水准α=0.05。
2 结果
2.1 轻、重度PE患者及正常妊娠组胎盘组织中IEX-1蛋白的表达 3组胎盘组织中均可检测到IEX-1蛋白,主要表达于合体滋养细胞和蜕膜细胞,少量表达于绒毛间质和血管内皮细胞。PE组胎盘滋养细胞和底蜕膜细胞中IEX-1的表达均较正常妊娠组增强,重度PE组表达较轻度PE组增强。见图 1、表1。 *H=26.020,P<0.001;△H=16.932,P<0.001。

图1 3组胎盘组织中IEX-1蛋白的表达(SP,×400)
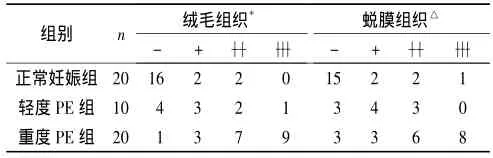
表1 3组胎盘组织中IEX-1蛋白表达情况比较
2.23组HUVEC中IEX-1蛋白的表达 见图2、表2。由图2、表2可以看出,阴性对照组HUVEC胞质有极少量IEX-1蛋白的表达,正常妊娠组及重度PE组IEX-1蛋白的表达较阳性对照组明显增强。
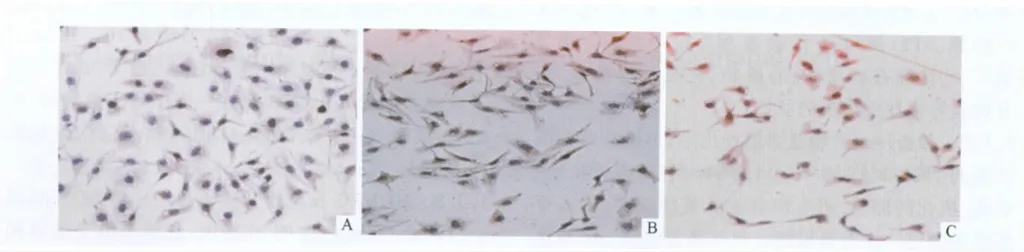
图23 组HUVEC中IEX-1蛋白的表达(SP,×400)
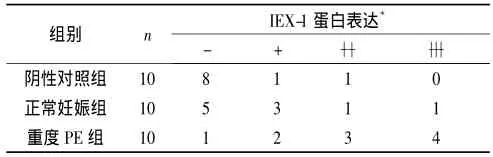
表23 组HUVEC中IEX-1蛋白表达的比较 阳性例数
2.3 3组HUVEC增殖抑制率的比较 阴性对照组、正常妊娠组和重度PE组细胞增殖抑制率分别为(0.160±0.021)%、(0.197±0.012)%和(0.480± 0.015)%,3组比较,差异有统计学意义(F= 113.438,P<0.001),重度PE组HUVEC增殖抑制率高于其他2组(P<0.05)。
3 讨论
人类胎盘形成的关键是滋养细胞向母体子宫内膜和肌层的成功浸润,该过程需滋养细胞增殖、分化和侵蚀及蜕膜细胞的增殖与退化同时并存,并在动态平衡中协调蜕膜细胞的数量和滋养细胞的侵蚀,若该平衡紊乱,可能导致一系列的病理性妊娠[6-7]。研究[8]发现PE患者存在胎盘浅着床和子宫螺旋动脉重建失败,这些变化可能与滋养细胞及蜕膜细胞的生物学效应改变有关。正常妊娠过程中存在滋养细胞正常凋亡现象,而PE患者胎盘组织中存在细胞过度凋亡现象,提示胎盘滋养细胞异常凋亡与PE的发病密切相关。
IEX-1属即刻早期基因家族成员,能在外界信号刺激下快速、短暂地表达,介导细胞内信号转导,调控下游长期反应基因的表达,在细胞生长、增殖、分化和凋亡等方面发挥着重要作用[1-4],与病毒感染、心血管疾病、炎症的免疫调控及肿瘤发生发展等密切相关[9-12]。已有研究[12]发现IEX-1可通过调节活化T细胞中ERK信号通路发挥抗凋亡作用。推测IEX-1可能参与了细胞内不同的信号传导通路(如 NF-κB、ERK、ROS、PI3K/Akt等)[12-14],从而使细胞适应外界环境的变化。
该研究结果表明,正常妊娠产妇和PE患者的胎盘组织内均有IEX-1的表达,主要表达于合体滋养细胞和蜕膜细胞,PE患者胎盘组织中IEX-1蛋白的表达明显强于正常妊娠组,且随病情严重程度的增加而增强。推测PE患者全身小血管痉挛,各脏器血液灌注减少,胎盘存在缺血缺氧,从而诱导了细胞中应激蛋白IEX-1的表达。作者进一步用PE患者静脉血清干预HUVEC,观察内皮细胞增殖能力以及IEX-1合成能力。结果显示,正常情况下HUVEC中有极少量IEX-1蛋白表达,用正常妊娠孕妇及重度PE患者的血清孵育后,IEX-1蛋白在HUVEC中的表达明显增强,同时重度PE组HUVEC增殖能力明显下降,说明PE患者血清诱导了HUVEC中IEX-1蛋白的表达,同时还可使HUVEC受损,推测IEX-1蛋白在PE内皮细胞损伤过程中可能起重要的桥梁作用。
目前IEX-1在PE胎盘组织以及内皮细胞损伤过程中的具体作用及调控机制尚不完全清楚,不能确定IEX-1的异常表达究竟是PE的原因抑或是疾病的结果。进一步深入研究IEX-1在胎盘细胞凋亡及内皮细胞损伤过程的调节机制,可增加对PE发病机制的认识,可能从蛋白和(或)基因水平找到新的干预靶点,为PE的诊治及预后判断提供新途径。
[1]Arlt A,Grobe O,Sieke A,et al.Expression of the NF-kappa B target gene IEX-1(p22/PRG1)does not prevent cell death but instead triggers apoptosis in Hela cells[J].Oncogene,2001,20(1):69
[2]Shen L,Guo J,Santos-Berrios C,et al.Distinct domains for anti-and pro-apoptotic activities of IEX-1[J].J Biol Chem,2006,281(22):15304
[3]Han LP,Geng LN,Liu XR,et al.Clinical significance of IEX-1 expression in ovarian carcinoma[J].Ultrastruct Pathol,2011,35(6):260
[4]Wu MX.Roles of the stress-induced gene IEX-1 in regulation of cell death and oncogenesis[J].Apoptosis,2003,8 (1):11
[5]乐杰,谢杰,丰有吉.妇产科学[M].7版.北京:人民卫生出版社,2007:456
[6]Sharp AN,Heazell AEP,Crockerl IP,et al.Placental apoptosis in health and disease[J].Am J Reprod Immunol,2010,64(3):159
[7]Alexander D,Allai RE,Kelly A,et al.Placental apoptosis in pre-clampsia[J].Obstet Gynecol,2000,96(2):271
[8]Kadyrov M,Kingdom JC,Huppertz B.Divergent trophoblast invasion and apoptosis in placental bed spiral arteries from pregnancies complicated by maternal anemia and early onset preeclampsia/intrauterine growth restriction[J].Am J Obstet Gynecol,2006,194(2):557
[9]Taddeo B,Esclatine A,Zhang W,et al.The stress-inducible immediate-early responsive gene IEX-1 is activated in cells infected with herpes simplex virus 1,but several viral mechanisms,including 3’degradation of its RNA,preclude expression of the gene[J].Virology,2003,77(11):6178
[10]Sommer SL,Berndt TJ,Frank E,et al.Elevated blood pressure and cardiac hypertrophy after ablation of the gly96/ IEX-1 gene[J].J Appl Physiol,2006,100(2):707
[11]Sasada T,Azuma K,Hirai T,Hashida H,et al.Prognostic significance of the immediate early response gene X-1(IEX-1)expression in pancreatic cancer[J].Ann Surg Oncol,2008,15(2):609
[12]Zhang Y,Finegold MJ,Porteu F,et al.Development of t-cell lymphomas in Emu-IEX-1 mice[J].Oncogene,2003,22 (44):6845
[13]Shen L,Zhi L,Hu W,et al.IEX-1 targets mitochondrial F1Fo-ATPase inhibitor for degradation[J].Cell Death Differ,2009,16(4):603
[14]Osawa Y,Nagaki M,Banno Y,et al.Expression of the NF-kappa B target gene X-ray-inducible immediate early response factor-1 short enhances TNF-alpha-induced hepatocyte apoptosis by inhibiting Akt activation[J].J Immunol,2003,170(8):4053
Expression of immediate early response gene X-1 protein in placenta of preeclampsia patients and human umbilical vein endothelial cells
GENG Lina,HAN Liping,ZHANG Xiaoxue,LI Mengmeng,ZHAO XianlanDepartment of Obstetrics and Gynecology,the First Affiliated Hospital,Zhengzhou University,Zhengzhou 450052
immediate early response gene X-1;preeclampsia;placenta;human umbilical vein endothelial cell
Aim:To explore immediate early response gene X-1(IEX-1)protein expression in preeclampsia(PE)placenta and human umbilical vein endothelial cells(HUVECs).Methods:Thirty patients with PE(10 cases were mild,and 20 cases were severe)and 20 normal pregnant women(control group)were subjected to detect IEX-1 protein in placenta using immunohistochemistry.HUVECs were cultured with fetal calf serum(negative control group),the serum of normal pregnant women(normal control group),and the serum of severe PE patients(severe PE group)for 24 h,respectively,then the IEX-1 expression in the cells was detected by immunocytochemical method,and the proliferation inhibition rate was detected by MTT.Results:The expression of IEX-1 protein mainly lay in cytoplasm of placental trophoblast cells and decidual cells.There were significant differences in the expression of IEX-1 protein in placental trophoblast cells and decidual cells among the 3 groups(H=26.620,16.932,P<0.001),which as the highest in the severe PE group(P<0.05),and lowest in the control group(P<0.05).IEX-1 expression in HUVECs of the normal control group and severe PE group were stronger than that of negative control group(H=11.495,P=0.003).The difference in proliferation inhibition rate of HUVECs among the 3 groups was significant(F=113.438,P<0.001),and that of severe PE group was higher than the other 2 groups(P<0.05).Conclusion:IEX-1 may play an important role in the pathogenesis of PE through regulating placental villous trophoblast cells and decidual cells apoptosis,as well as participation in endothelial cell injury process.
R714.24
10.3969/j.issn.1671-6825.2012.06.016
(2012-01-03收稿 责任编辑王 曼)

