脂肪间质干细胞对肝星状细胞活化、增殖、凋亡相关作用的研究
俞富祥 季世强 苏龙丰 张启瑜
近年来,肝星状细胞(hepatic stellate cells,HSCs)的活化与增殖是肝纤维化发生发展的中心环节,已逐渐获得共识。有较多研究显示,骨髓间质干细胞可抑制HSCs活化和肝纤维化进展[1,2]。但骨髓源性间充质干细胞来源困难、取材不易,使其应用前景受限。而脂肪间质干细胞(adipose tissue-derived mesenchymal stem cells,ADSCs)与骨髓间质干细胞相比较而言,不仅来源丰富,取材容易,而且具有自我更新、多向分化和高增殖特性等重要干细胞特征,与骨髓间质干细胞相类似[3,4]。本研究主要探讨 ADSCs在细胞水平对大鼠肝纤维化的影响。
材料与方法
1.材料及试剂:健康6周龄 SD大鼠10只,体重150~200g,供分离ADSCs及HSCs,由温州医学院实验动物中心提供;L-DMEM培养基,购自Hyclone公司;小牛血清购自Gibco公司;Ⅳ型胶原酶、DNaseⅠ购自Sigma公司;Optiprep分离液购自AXISSHIELD 公司;孔径 0.4μm Transwell insert半透膜及6孔塑料培养板购自Millipore公司;鼠抗平滑肌肌动蛋白(α-SMA)单克隆抗体、标记FITC的山羊抗鼠抗体购自Southern-Biotech公司;Hoechst33342购自 Sigma公司,AEC试剂盒购自博士德生物公司。
2.细胞分离及培养:(1)脂肪间质干细胞(adipose tissuederived mesenchymal stem cells,ADSCs)的分离、培养:在无菌条件下,从健康SD大鼠腹腔内获取脂肪组织1~2mg,充分剪碎后加入分离液2ml(含1mg/ml胶原酶)消化,37℃振荡摇晃1h,然后以200×g离心5min,沉积的细胞用含10%FBS的DMEM培养液制成均匀的细胞悬液,均匀接种于培养皿中,37℃、5%CO2孵箱中培养,培养至皿底80%时传代,每2~3天换液1次。采用第3~5代ADSCs,用免疫荧光染色方法检测ADSCs相对特异细胞表面标志CD73、CD90及CD45。(2)大鼠正常肝细胞系(buffalo rat liver cells,BRLs)的培养:BRLs由温州医学院龙湾实验中心赠与,复苏后接种于培养瓶中,37℃、5%CO2、饱和湿度的培养箱中常规培养。培养液为含10%小牛血清的L-DMEM,每2~3天换液1次。(3)HSCs分离与培养:按实验室前期建立的方法进行分离HSCs。用含10%小牛血清的L-DMEM培养基接种于塑料培养瓶。常规培养48h后换液,5~7天后HSCs活化,增殖迅速。根据细胞生长情况每2~3天换液1次。
3.细胞共培养方法的建立:根据孔径0.4μm的transwell insert半透膜仅可以通过培养液而不能透过细胞的特点,在6孔塑料培养板上架起transwell insert半透膜,建立双层细胞共用培养液而不直接接触的培养体系。每孔培养体系上层接种ADSCs 2×104cells/well,培养体系下层接种原代及第3代的HSCs 2×104cells/well。另设 BRLs代替 ADSCs作为阴性对照,单纯培养的 HSCs为空白对照。各组均采用37℃、5%CO2、饱和湿度的培养箱常规培养,培养液为含10%小牛血清L-DMEM。培养72h后,倒置相差显微镜下动态观察活体细胞形态学改变。
4.ADSCs对HSCs活化的影响:本实验通过Western blotting法检测HSCsα-肌动蛋白(α-SMA)的表达,确定HSCs的活化状态。按前述方法在共培养72h后,在各培养体系HSCs中分别加入现配的细胞裂解液,冰上裂解30min,于4℃12000r/min离心15min,取上清进行蛋白定量。取一定量蛋白样品上样。SDS-PAGE胶电泳分离,转移至PVDF膜,封闭缓冲液室温摇床振荡1h,加入一抗体 α -SMA(1∶100),4℃过夜,TBST 漂洗 3 次,10 分钟/次,孵育二抗(1∶30000),37℃ 恒温振摇1h;TBST漂洗3次,10分钟/次,化学发光,显影、定影,对胶片图像扫描,用凝胶图像处理系统Gel-Pro analyzer分析目标带的灰值。
5.CCK-8比色法检测ADSCs对HSCs增殖的影响:按前述方法在共培养72h后,每孔加入CCK-8溶液80μl,继续培养2h,用自动酶标仪于450nm处检测每孔的吸光度(A)值,间接计算细胞增殖程度。
6.流式细胞仪检测ADSCs对HSCs凋亡的影响:按前述方法在共培养72h后,用不含EDTA的胰酶消化细胞,每个样本收集约2×105个细胞,1500r/min离心5min后,弃去培养液,用PBS洗涤细胞2次,1500r/min离心5min,加入200μl Binding Buffer重悬细胞;加入5μl Annexin V-FITC混匀后,再加入5μl Propidium Iodide,混匀;室温、避光反应20min后上机检测,流式细胞仪激发波长488nm,发射波长530nm。
7.细胞培养液细胞因子的测定:为探究ADSCs如何能促使HSCs发生细胞凋亡,并抑制HSCs活化,从而发挥抗肝纤维化的作用,我们推测ADSCs可能通过分泌细胞因子,从而间接影响HSCs。我们将ADSCs及BRLs分别单独培养于6孔塑料培养板,每孔培养细胞2×105个,培养72h后,分别取培养液,使用各种细胞因子(如肝细胞生长因子HGF、转化生长因子TGF、及神经生长因子NGF等)ELISA试剂盒,按照试剂盒指示说明,检测其中的细胞因子含量。
结 果
1.HSCs的分离、培养和形态学特点:每只大鼠HSCs的获得率约为(1~2)×107,台盼蓝染色细胞存活力>95%。相差显微镜下,刚分离出来的HSCs呈圆球形,胞质内含较多脂肪小滴,荧光显微镜在328nm波长的激发光下,可观察到蓝绿色荧光。培养2~3天后,细胞贴壁;5~7天后,细胞伸展呈星形。见图1。
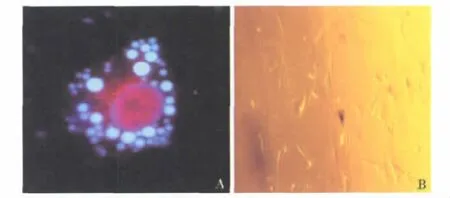
图1 鼠原代HSCs
2.ADSCs的分离、培养和形态学特点:取大鼠腹股沟处脂肪组织1~2mg,可以分离消化出(1~2)×106个ADSCs。经台盼蓝染色可确定细胞的存活率95%以上。培养4~6h后即可见部分细胞贴壁,呈短棒形。48h后可见细胞呈梭形生长。5~6天后细胞生长迅速,当细胞生长至80%汇合时,即可传代培养(图2)。
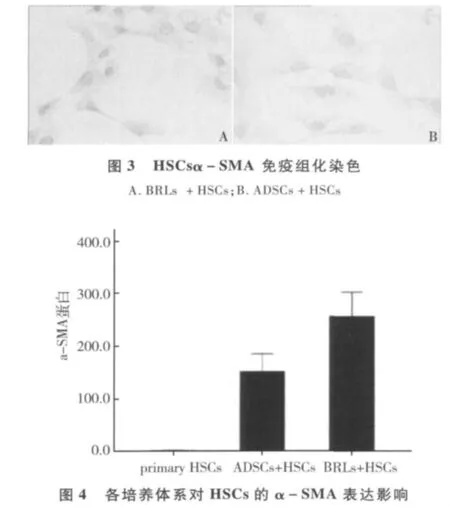
3.ADSCs抑制 HSCsα -SMA的表达:共培养72h,免疫细胞化学染色测定α-SMA在HSCs中表达情况,可见阳性染色的α-SMA位于胞质内,呈高张力纤维状分布,ADSCs+HSCs组HSCs胞质内α-SMA表达较BRLs+HSCs组明显降低,结果见图3。通过Western blotting法检测α-的表达,与BRLs+HSCs组比较,发现 ADSCs+HSCs组 HSCsα-SMA表达水平明显下降,结果见图4。
4.ADSCs抑制 HSCs的增殖:本实验以单独HSCs培养的细胞数作为参照值,利用吸光度值间接推算细胞增殖程度。与BRLs对照组相比,HSCs与ADSCs共培养72h,HSCs增殖活性受抑制明显(p<0.05),见图5。光学显微镜下,HSCs的细胞形态无显著变化,培养体系中相应的ADSCs及BRLs的生长状态良好。
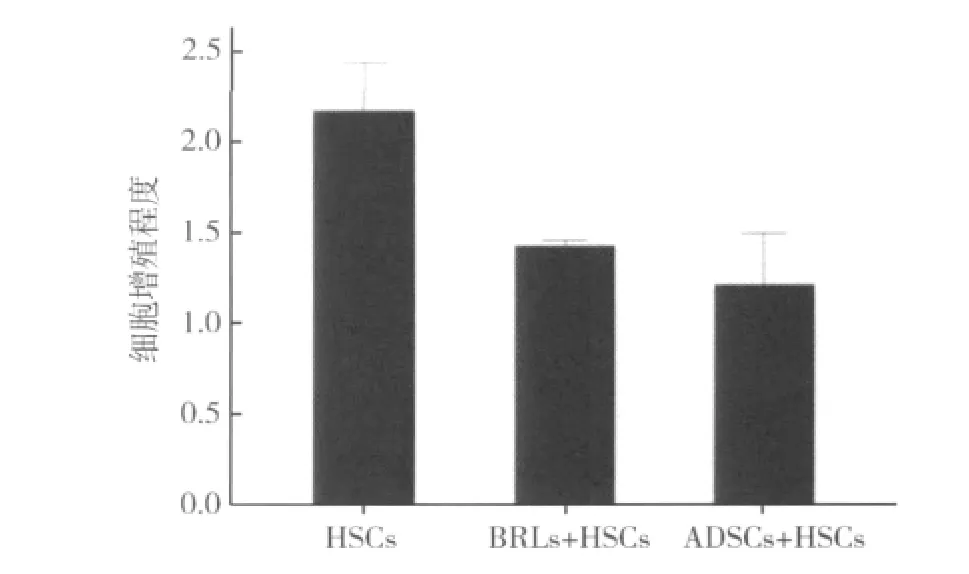
图5 各培养体系中HSCs的细胞增殖程度比较
5.HSCs的凋亡情况:HSCs凋亡率流式细胞仪检测结果显示,ADSCs+HSCs组的HSCs凋亡率最高,与BRLs+HSCs组、单独HSCs组相比差异有显著性意义(P <0.05),见图6、图7。
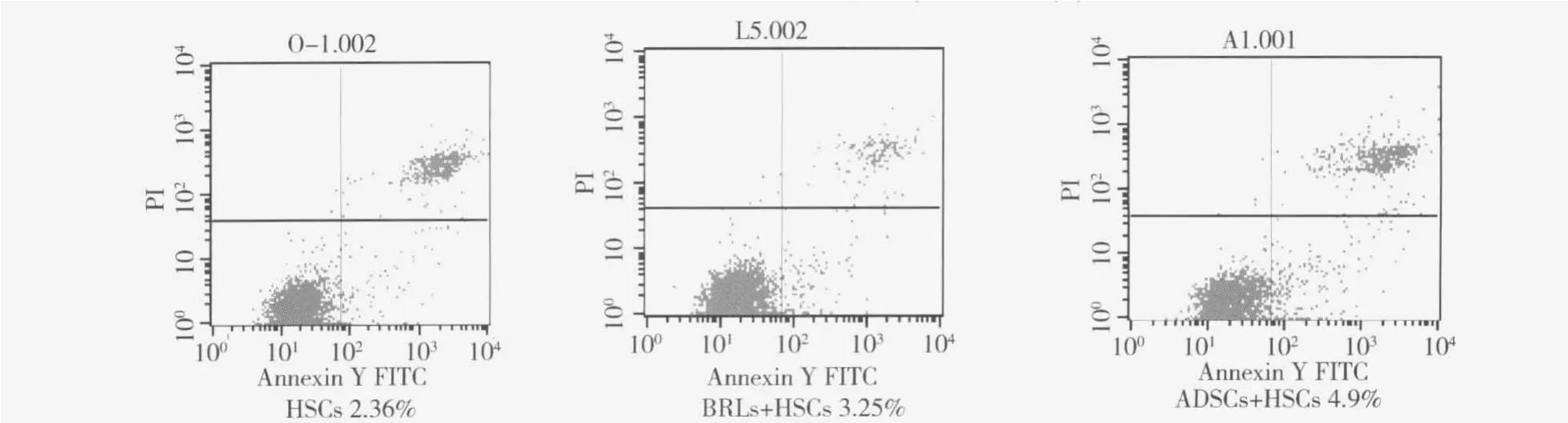
图6 HSCs的凋亡情况
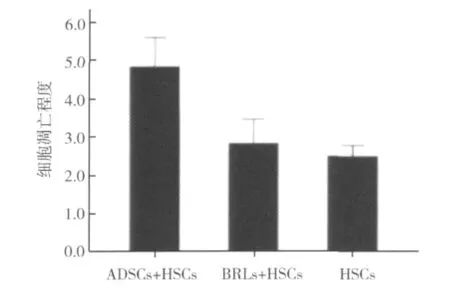
图7 各培养体系中HSCs的细胞凋亡程度比较
6.细胞培养液中细胞因子浓度的测定(pg/ml):通过测定细胞培养液中细胞因子含量发现ADSCs分泌的细胞因子中,与肝细胞比较,HGF量较多(p<0.05),而TGF分泌量明显较少(p<0.01),而 NGF两者之间无显著差别(P>0.05),见表1。
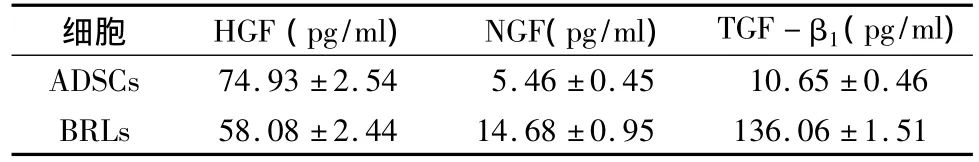
表1 两种细胞培养液中各细胞因子含量比较
讨 论
HSCs属于肝脏的间质细胞,它在肝纤维化过程中扮演着重要的角色,现已成共识[1,2,5~7]。在病理条件下如肝脏受到物理、化学及病毒感染生物因素的刺激时,HSCs增殖并激活,激活的HSCs通过增生和分泌细胞外基质,对肝纤维化的形成起着至关重要作用。
国内外已有研究显示,骨髓间质干细胞通过抑制HSCs的活化而达到缓解肝纤维化进展[5~7]。但骨髓干细胞获取创伤大,且数量少,影响其在临床及研究领域的进一步广泛应用。自Zuk PA等于2001年首次报道从人脂肪组织中分离出ADSCs以来,已有较多研究先后证实了这些细胞在合适诱导剂的作用下可向成骨、软骨、脂肪和成肌等细胞分化,表现出与骨髓间质干细胞相类似的高增殖活性与多向分化潜能等干细胞特性[3,4,8]。而 ADSCs与骨髓干细胞比较而言,因其数量多、获取方便等优势,成为干细胞移植治疗慢性肝病又一颇具发展前景的待选细胞,为当前组织工程种子细胞研究的重点。
既往干细胞移植治疗肝硬化,多集中于研究探讨干细胞在肝内生长分化为肝细胞,从而达到改善肝功能的作用。有实验显示,HSCs的活化与增殖是肝纤维化发生发展的中心环节[9]。那么ADSCs是否可通过调控HSCs的增殖与活化发挥对肝纤维化的抑制作用?为探讨ADSCs是否能够抑制HSCs活化与增殖,我们利用孔径0.4μm的transwell仅透过培养液而不能通过细胞的特点,建立ADSCs与HSCs非直接接触的共培养体系,初步的结果显示HSCs的活化、增殖较BRLs等共培养体系明显抑制,表明ADSCs可以通过非直接接触抑制HSCs活化与增殖。
越来越多的研究显示,通过诱导活化态HSCs凋亡,进而减少细胞外基质分泌,是治愈肝纤维化的关键[10]。动物肝纤维化模型自发逆转的研究显示,诱导活化态HSCs的凋亡是肝纤维化得以逆转的关键[11,12]。我们通过此共培养体系,发现 ADSCs不仅能抑制HSCs活化与增殖,而且还可以促进HSCs凋亡,最终使活化态 HSCs数量减少,从而有效减弱HSCs在肝纤维化过程中的作用。
对于干细胞如何起到抗肝纤维化作用,其机制至今尚未明确。有文献认为是多因素作用,主要包括两方面:一是通过干细胞分化为功能性肝细胞,促进肝再生;二是干细胞通过直接抑制其增殖激活并诱导HSCs凋亡,同时分泌抗纤维化物质如HGF、NGF等。有文献报道,HGF及NGF均有促进HSCs凋亡的作用,同时具有诱使ADSCs向肝细胞分化的功能,还抑制TGF-β1的产生,阻止肝脏发生纤维化,并具有抗肝细胞凋亡的活性。我们通过测定细胞培养液中细胞因子含量也发现ADSCs与对照组肝细胞比较,可分泌较多量HGF、较少量分泌TGF(p<0.05)。因此,根据本研究结果,我们推测ADSCs可能通过分泌多种细胞因子联合抑制HSCs的增殖与活化,促使HSCs凋亡,从而在治疗肝纤维化中发挥作用。
总之,根据目前初步研究成果显示,ADSCs可抑制HSCs活化、增殖,促进凋亡。但对ADSCs研究起步时间相对较晚,因而研究深度不及其他类型的间质干细胞,诸如ADSCs活体移植问题,干细胞移植的致瘤性问题及异体ADSCs的移植排斥等问题均有待进一步深入研究。
1 胡昆鹏,林楠,林继宗,等.人骨髓间质干细胞对肝星状细胞的体外调控[J].中国组织工程研究与临床康复,2009,13(27):5257-5260
2 王豪勋,马军,段芳龄,等.骨髓间充质干细胞治疗肝硬化的动物实验研究[J].胃肠病学和肝病学杂志,2006,15(4):365-368
3 Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell- based therapies[J].Tissue Eng,2001,7:211 -228
4 Seo MJ,Suh SY,Bae YC,et al.Differentiation of human adipose stromal cells into hepatic lineage in vitro and in vivo[J].Biochem Biophys Res Commun,2005,328:258 -264
5 Kania G,Blyszczuk P,Jochheim A,et al.Generation of glycogenand albumin-producing hepatocyte-like cells from embryonicstem cells[J].Biol Chem,2004,385:943 -953
6 Oyagi S,Hirose M,Kojima M,et al.Therapeutic effect of transplanting HGF-treated bone marrow mesenchymal cells into CCl4-injured rats[J].Hepatol,2006,44(4):742 - 748
7 Hu KP,Lin N,Lin JZ,et al.In vitro regulation effect of human bone marrow mesenchymal stem cells on hepatic stellate cells[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2009,13(27):5257-5260
8 Rangappa S,Fen C,Lee EH,et al.Transformation of adult mesenchymal stem cellsisolated from the fatty tissue into cardiomyocytes[J].Ann Thorac Surg,2003,75:775 -779
9 Friedman SL.Mechanisms of Hepatic Fibrogenesis[J].Gastroenterology,2008,134(6):1655 -1669
10 Friedman SL.Hepatic stellate cells:protean,multifunctional,and enigmatic cells of the liver[J].Physiol Rev,2008,88(1):125 -172
11 Russo FP,Alison MR,Bigger BW,et al.The bone marrow functionally contributes to liver fibrosis[J].Gastroenterology,2006,130(6):1807-1821
12 De Minicis S,Seki E,Uchinami H,et al.Gene expression profiles during hepatic stellate cell activation in culture and in vivo[J].Gastroenterology,2007,132(5):1937-1946

