玉郎伞皂苷对四氯化碳诱导大鼠肝纤维化的影响
郭又嘉,文 坎,张士军,吴 咖,黄仁彬
(广西医科大学药理学教研室,广西南宁 530021)
肝纤维化(hepatic fibrosis,HF)是多种慢性肝病向肝硬化发展的中间病理阶段,慢性肝病大多数都有肝纤维化,其中25%~40%最终发展成肝硬化甚至肝癌[1]。玉郎伞(YLS)为豆科植物疏叶崖豆[Millettia Pulchra kurz var.laxior(Dunn)Z.Wei]的干燥根,始见于《广西中药志》,为广西壮、瑶医常用药材。迄今国内外只有本课题组对其进行提取分离及相关药理、药效研究[2]。而玉郎伞皂苷(YLSS)为YLS的一个分离部位,前期研究表明其具有抗自由基、抗高血压、保护离体心血管、保护大脑缺血/再灌注损伤等作用[3-5],但尚未见其抗肝纤维化的报道。而自由基可使肝星状细胞激活,促进Ⅰ型胶原合成,引发肝脏的纤维化反应[6],本文以YLSS为研究对象,探讨其对HF的保护作用及机制。
1 材料
1.1 实验动物 SPF级SD大鼠,体质量150~180 g,♀♂各55只,由广西医科大学实验动物中心提供。试验动物使用许可证:SCXK桂2009-0002。
1.2 药物及试剂 四氯化碳(AR,成都市科龙化工试剂厂,批号20100925)、食用油(嘉里粮油有限公司,SB/T 10292)、玉郎伞皂苷(简称YLSS,由本实验室自行提取,提取率为1.49%)、秋水仙碱片(西双版纳药业有限责任公司,批号110403);试剂盒:分别为AST(批号20110312)、ALT(批号20110317)、考马 斯 亮 蓝 (批 号 20110321)、SOD(批 号20110728)、MDA(批号 20110716)、GSH(批号20110816)和GSH-Px(批号20110816)试剂盒,均为南京建成生物工程研究所生产。
1.3 实验仪器 主要实验仪器设备有:TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)、CL17R低温高速离心机(北京东迅天地医疗仪器有限公司)。
2 方法
2.1 CCl4诱导的大鼠肝纤维化模型的建立 将♀♂SD大鼠分笼饲养,适应环境5 d后分别随机分成两组:肝纤维化模型组及正常对照组。肝纤维化模型组♀♂大鼠分别为♀50只、♂44只,均以50%CCl4食用油溶液1 ml·kg-1灌胃,每周称重并灌胃2次,按实际体重调整给药剂量[7];正常对照组♀♂大鼠均为10只,共20只给予NS灌胃,剂量及给药方法同肝纤维化模型组。造模第7、8周,将♂大鼠麻醉,固定,于腋前线第8肋间进针,刺入肝脏0.5~0.8 cm,拔出穿刺针,取出肝组织条置10%甲醛固定[8];第9、10周对♀大鼠进行肝脏穿刺,操作同上。
2.2 实验分组及用药[9]将确认形成肝纤维化的大鼠随机分为5组:给药组共4组,每组♀♂各8只;模型对照组1组,♀♂各10只;加上空白对照组♀♂各10只,共6组。阳性组给予秋水仙碱0.2 mg·kg-1;YLSS 高、中、低剂量组(YLSSH、YLSSM、YLSSL)分别给予 YLSS 80、40、20 mg·kg-1;空白对照组和模型对照组给予NS 10 ml·kg-1。各组动物在相同条件下饲养,均以每日1次、空腹灌胃,连续给药4周。除空白对照组外,其余各组均继续给予50%CCl4油溶液(同造模方法)。
2.3 样本制备 末次给药禁食不禁水24 h后,腹腔注射戊巴比妥纳30 mg·kg-1麻醉,腹主动脉取血,4℃离心分离血清,-20℃保存,用于 ALT、AST的测定。取肝组织做10%匀浆后于-80℃冰箱保存,用于 SOD、MDA、GSH、GSH-Px及考马斯亮蓝的测定;于肝左叶同一部位取肝组织约(1×1×1)cm3大小,固定于10%甲醛溶液,做光镜观察。
2.4 指标测定 血清中ALT(赖氏法)、AST(赖氏法)和肝组织总蛋白含量、GSH、GSH-Px、SOD、MDA的检测均严格按照试剂盒说明书进行。
2.5 肝组织病理学检查 各组大鼠肝脏标本以10%甲醛溶液固定,常规脱水,经石蜡包埋后切片,HE染色,光镜下观察肝组织纤维化程度。
2.6 数据处理 数据的计算采用Excel表格法。而标准曲线的拟合及数据的统计分析,则以α=0.05为检验水准,应用SPSS 13.0软件分析:计量资料数据均以±s表示,采用单因素方差分析法处理(经方差齐性检验,方差齐者采用LSD法进行组间两两比较,方差不齐者采用Games-Howell法进行两两比较);计数资料采用秩和检验。
Tab 1 Effect of YLSS on the activity of ASTand ALT in the serum of rats(±s)

Tab 1 Effect of YLSS on the activity of ASTand ALT in the serum of rats(±s)
**P <0.01 vs model control group;ΔΔP <0.01 vs normal control group
Group n AST/IU·L-1 ALT/IU·L -1 YLSSL 14 148.90 ±12.11ΔΔ** 49.85 ±3.31**YLSSM 14 129.93 ±4.72ΔΔ** 46.38 ±14.20**YLSSH 15 117.65 ±11.19** 41.37 ±7.10**Colchicine 15 139.62 ±34.18** 53.14 ±15.07**Model control 16 361.95 ±61.57ΔΔ 105.78 ±59.18ΔΔ Normal control 20 109.86 ±9.69** 38.96 ±5.95**
3 结果
3.1 YLSS对肝纤维化大鼠血清AST、ALT的影响 与空白对照组比较,模型对照组大鼠血清AST与ALT的含量升高(P<0.01),YLSS低、中剂量组AST含量亦与空白组差别有显著性(P<0.01)。而与模型组比较,YLSS各剂量组和阳性组大鼠血清AST和ALT含量均降低(P<0.01)。见Tab 1。
3.2 YLSS对肝纤维化大鼠肝组织SOD、MDA、GSH、GSH-Px的影响 与空白组比较,模型对照组大鼠肝组织中SOD、GSH-Px及GSH明显降低(P<0.01),MDA含量明显升高(P<0.01);而YLSS中、高剂量组的GSH-Px增高(P<0.01)。与模型组比较,YLSS各剂量组与阳性组均可升高肝纤维化大鼠血清SOD及GSH活力(P<0.01或P<0.05),降低肝纤维化大鼠肝组织MDA含量(P<0.01);YLSS各剂量组肝组织中GSH-Px活力升高(P<0.01)。阳性对照组GSH-Px活力与模型对照组及空白对照组比较差别均无统计学意义(P>0.05)。而随着给药剂量的增高,YLSS提升SOD能力逐渐升高,但降低MDA的能力有所降低(Tab 2)。
Tab 2Effects of YLSS on the levels of SOD,MDA,GSH-Px,GSH in the liver tissue(±s)

Tab 2Effects of YLSS on the levels of SOD,MDA,GSH-Px,GSH in the liver tissue(±s)
*P <0.05,**P <0.01 vs model control group;ΔP <0.05,ΔΔP <0.01 vs normal control group
Group n SOD/kU·g-1Pro MDA/μmol·g-1Pro GSH-Px/μmol·g-1Pro GSH/μmol·g-1Pro YLSSL 14 131.72 ±31.76* 1.16 ±0.29Δ** 750.87 ±41.37** 4.95 ±0.27ΔΔ*YLSSM 14 138.36 ±22.08** 1.43 ±0.50** 851.80 ±89.37ΔΔ** 5.30 ±0.42ΔΔ**YLSSH 15 153.73 ±27.31** 1.47 ±0.40** 862.91 ±100.10ΔΔ** 5.83 ±0.65**Colchicine 15 126.64 ±18.88** 2.00 ±0.41** 515.65 ±312.03 5.71 ±0.89**MC 16 92.70 ±16.07ΔΔ 3.65 ±0.89ΔΔ 374.12 ±291.96ΔΔ 4.32 ±0.53ΔΔ NC 20 167.55 ±51.82** 2.04 ±0.78** 683.37 ±196.29** 6.58 ±0.44**
3.3 YLSS对肝纤维化大鼠肝组织病理组织学观察 正常对照组:大鼠肝小叶结构完整,为类圆形,肝细胞排列整齐,表现为肝细胞以中央静脉为中心,呈放射状排列,未见变性和坏死;中央静脉及肝窦未见充血、出血和水肿;汇管区亦未见纤维组织增生。模型对照组:肝小叶结构被破坏,汇管区纤维组织明显增生并伸入小叶将肝小叶分割,形成假小叶,结节周围纤维组织增生,少量炎细胞浸润。YLSSH组:肝细胞排列紊乱,肝小叶结构完整,肝组织汇管区及小叶内散在点状、星芒状纤维组织增生,纤维间隔形成,但小叶结构大部分保存,并伴浊肿变性、脂肪变性。YLSSM及阳性对照组:纤维组织增生,纤维间隔形成,局部可见分隔并破坏肝小叶,大部分肝小叶结构保留,但排列紊乱,而无肝硬化改变。YLSSL组:大量纤维间隔,分隔并破坏肝小叶,致小叶结构紊乱,但尚未形成假小叶。
纤维化程度按2000年中华医学会传染病与寄生虫病学分会,肝病学分会联合修订的《病毒性肝炎防治方案》中标准分期,统计结果为:与模型对照组比较,阳性组及YLSS高、中剂量组有统计学意义(P<0.01),而YLSS低剂量组无统计学意义(P>0.05)(Tab 3,Fig 1 ~6)。
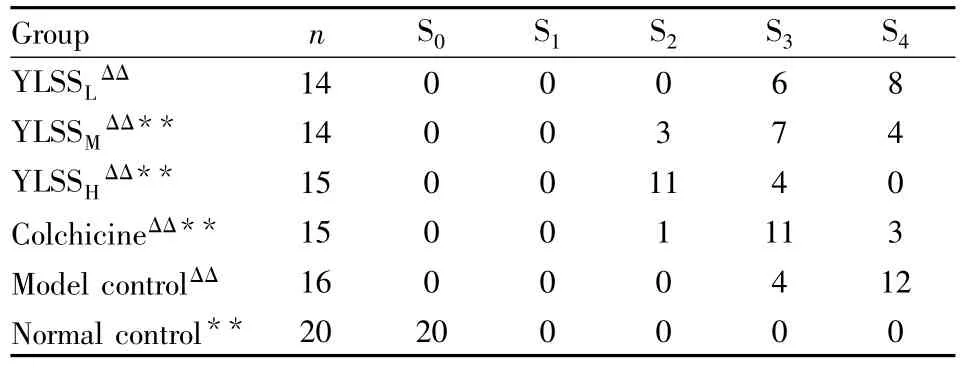
Tab 3 Effect of YLSS on pathological grade of liver in each group
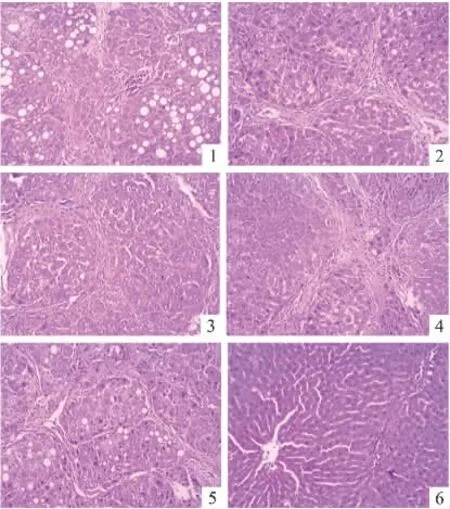
Fig 1 Hepatic lobule of YLSSLgroup Fig 2 Hepatic lobule of YLSSMgroup Fig 3 Hepatic lobule of YLSSHgroup Fig 4 Hepatic lobule of colchine group Fig 5 Hepatic lobule of model control group Fig 6 Hepatic lobule of nomal control group
4 讨论
HF是慢性非自限性肝损伤的后果,存在于几乎所有类型的慢性肝损伤疾病中[10]。现大多学者认为,肝纤维化的主要机制是在肝脏持续损伤过程中,一些细胞分泌诸多细胞因子,这些细胞因子使肝星状细胞(hepatic stelate cels,HSC)活化并转变为肌成纤维细胞(MFB),MFB分泌大量胶原并合成细胞外基质(extra celular matrix,ECM),导致肝纤维化的发生[11]。现已公认,HF 是可逆性的病变之一[12-14],若进一步发展成肝硬化则难以逆转。
CCl4为目前最为常用的诱导肝损伤的药物,采取反复多次给药的方法可制备慢性肝损伤模型。肝损伤主要表现为肝细胞反复的破坏、再生、肝组织结构改变、肝纤维化和肝硬化的发生[15]。CCl4可经肝细胞的细胞色素P450 Fe2+作用产生超氧阴离子(),并通过自由基反应扩展程序产生三氯甲基自由基(CCl3·)、二氯甲基自由基(CCl2·)和过氧化甲基自由基(CClOO·)等自由基。可转化为
3H2O2,后者又经铁离子(Fe3+)促发Fenton反应生成羟自由基(OH·)。OH·、CCl2·和CCl3OO·等自由基可攻击膜磷脂中的多不饱和脂肪酸(PUFA),引发膜脂质过氧化反应[16],最终导致MDA形成增多,肝细胞膜通透性增加,ALT与AST大量释放入血。链式反应过程中产生的过氧化物质可引起炎症反应、刺激库普弗细胞(kuffer cells)活化,进而促进HSC细胞的活化增殖,导致肝纤维化[17];另外,CCl3·还可抑制钙泵[18],使Ca2+大量滞留于细胞内,以致肝细胞损伤。
本实验结果表现为,YLSS各剂量组可降低肝纤维化大鼠血清ALT、AST水平和肝组织中MDA含量,提高肝组织中SOD、GSH-Px和GSH活性。该结果提示了YLSS作用机制可能为通过提高 S OD、GSH-Px和GSH含量,增强清除氧自由基能力,抑制肝脏脂质过氧化反应,从而稳定肝细胞膜、减轻细胞损伤;而GSH的含量的增高,可能与其提高GSH-Px有关。可见,YLSS可有效地缓解CCl4所致的大鼠肝细胞损伤,并对大鼠肝纤维化具有较好的逆转作用。
同时,由上文的叙述可知MDA为脂质过氧化的终产物,其含量反映机体脂质过氧化程度。本实验通过YLSS对体内MDA的影响发现,随着给药浓度的增加MDA含量略有增高,但总体较模型组低。MDA不与剂量呈正相关可能原因有以下方面。一方面,体内的抗氧化有酶系和非酶系统,SOD、GSH-Px及GSH为酶系,而MDA为机体脂质过氧化的终产物,也许不呈正相关与其对抗氧化非酶系统的作用有关;第2方面,本课题组在“玉郎伞多糖和皂苷对氧自由基清除作用研究”中发现,玉郎伞皂苷在体外并非对所有自由基的生成有抑制及清除作用,其对具有明显的抑制及清除作用,但对OH·则是促进生成的作用[19];第3方面,自由基在机体正常生理过程中是存在的,机体是个整体,也许体内自由基的生成和消除体系存在一个负反馈的过程,使之趋于平衡。
综上所述,YLSS对CCl4所致的大鼠肝纤维化具有一定的抑制作用,机制可能与其抗氧化作用有关,同时其体内过程可能存在更为复杂的交互作用。
[1]Pinzani M,Romanelli R G,Magli S.Progression of fibrosis in chronic liver diseases:time to tally the score[J].J Hepatol,2001,34(5):764-7.
[2]简 洁,刘 曦,黄仁彬,等.玉郎伞两种黄酮单体对心肌细胞缺氧/复氧损伤的保护作用[J].中国药理学通报,2009,25(7):942-5.
[2]Jian J,Liu X,Huang R B,et al.Protection and its mechanism of two flavone morphons from Yulangsan on hypoxia-reoxygenation induced injury in myocardial cells[J].Chin Pharmacol Bull,2009,25(7):942-5.
[3]黄仁彬,林 兴,蒋伟哲,等.玉郎伞化学成分对自发性高血压大鼠血压的影响[J].中国医院药学杂志,2006,26(2):130-3.
[3]Huang R B,Lin X,Jiang W Z,et al.Effects of the chemical component of yulangsan on blood pressure in spontaneously hypertensive rats(SHRs)[J].Chin Hosp Pharm J,2006,26(2):130-3.
[4]吕纪华.玉郎伞提取物对离体心血管的作用及其机制的研究[D].广西医科大学,2007.
[4]Lü J H.Effect and actionmechanism of yulangsan extractson cardiovascular system of ratsin vitro[D].Guangxi Med Univ,2007.
[5]陈 健.玉郎伞多糖对大鼠局灶性脑缺血再灌注损伤的保护作用[D].广西医科大学,2008.
[5]Chen J.Protective effect of yulangsan polysaccharide on focal cerebral ischemia/reperfusion injury in rats[D].Guangxi Med Univ,2008.
[6]Sanmugapriya E,Venkataraman S.Studies on hepatoprotective and antioxidant actions of Strychnos potatorum Linn.seeds on CCl4-induced acute hepatic injury in experimental rats[J].J Ethnopharmacol,2006,105(1-2):154-60.
[7]Constandinou C,Henderson N,Iredale J P.Modeling liver fibrosis in rodents[J].Methods Mol Med,2005,117:237-50.
[8]黄新立,张 峰,王学浩,等.建立大鼠部分肝移植动脉化模型的实验研究[J].中国普外基础与临床杂志,2004,11(3):224-7.
[8]Huang X L,Zhang F,Wang X H,et al.Research of partial liver transplantation with hepatic arterialization in rats[J].Chin J Bases Clin General Surg,2004,11(3):224-7.
[9]陈兆霓,张士军,唐爱存.六月青皂苷对四氯化碳诱导的大鼠肝纤维化的影响[J].时珍国医国药,2010,21(8):1911-2.
[9]Chen Z N,Zhang S J,Tang A C.The effect of liuyueqing saponins on liver fibrosis induced by carbon tetrachloride in rats[J].Lishizhen Med Mat Med Res,2010,21(8):1911-2.
[10]Williams R.Global challenges in liver disease[J].Hepatology,2006,44(3):521-6.
[11]Benyon R C,Iredale J P.Is liver fibrosis reversible E[J].Gut,2000(46):443-6.
[12]孔德松,郑仕中,陆 茵.肝内肌成纤维细胞的来源及其在肝纤维化中作用的研究[J].中国药理学通报,2011,27(3):297-300.
[12]Kong D S,Zheng S Z,Lu Y,et al.Research progress on myofibroblasts:their sources and roles in liver fibrogenesis[J].Chin Pharmacol Bull,2011,27(3):297-300.
[13]Pinzani M,Rombouts K.Liver fibrosis:from the bench to clinical targets[J].Dig Liver Dis,2004,36(4):231-42.
[14]Lamireau T,Desmouliere A,Bioulac-Sage P,et al.Mechanisms of hepatic fibrogenesis[J].Arch Pediatr,2002,9(4):392-405.
[15]张海燕,温 韬,卢 静,等.四氯化碳诱导大鼠慢性肝损伤模型方法的探讨[J].实用肝脏杂志,2009,12(3):161-3.
[15]Zhang H Y,Wen T,Lu J,et al.Establishment of CCl4-induced chronic liver injury model in rats[J].J Clin Hepatol,2009,12(3):161-3.
[16]段小群.玉郎伞多糖(YLS)抗肝纤维化作用及机制的研究[D].广西医科大学,2006.
[16]Duan X Q.Porteetive effects and meehanisms of yulangsan polysaccharide(YLS)on hepatic fibrosis[D].Guangxi Med Univ,2006.
[17]黄 艳,黄 成,李 俊.肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖、凋亡的调控[J].中国药理学通报,2010,26(1):9-13.
[17]Huang Y,Huang C,Li J.Effect of cytokines secreted from Kupfer cell on HSC proliferation,apoptosis in hepatic fibrosis process[J].Chin Pharmacol Bull,2010,26(1):9-13.
[18]徐 鑫,屈彩芹.药物性肝损伤机制[J].医学综述,2008,14(5):747-9.
[18]Xu X,Qu C Q.Mechanisms of drug-induced liver injury[J].Med Recap,2008,14(5):747-9.
[19]陈 健,黄媛恒,王乃平,等.玉郎伞多糖和皂苷对氧自由基清除作用研究[J].中药药理与临床,2007,2(5):100-2.
[19]Chen J,Huang Y H ,Wang N P,et al.Scavenging action of yulangsan polysaccharide and total saponinson oxygen free radicals[J].Pharmacol Clin Chin Mat Med,2007,2(5):100-2.

