脂质体多柔比星治疗淋巴瘤患者的疗效及安全性分析
平凌燕 应志涛 王小沛 谢彦 邓丽娟 刘卫平张晨 郑文 林宁晶 涂梅峰 朱军 宋玉琴
北京大学肿瘤医院,暨北京市肿瘤防治研究所淋巴肿瘤科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
淋巴瘤是以化疗为主要治疗选择的恶性肿瘤之一,其一线化疗方案绝大多数含有蒽环类药物,有效率及治愈率均较高。但是蒽环类药物最常见的剂量限制毒性之一就是心脏毒性,尤其是对老年患者及合并心脏疾病的患者需慎重。临床上有数种减低常规蒽环类药物对心脏毒性的方法,包括:限制累积剂量、改变用药方式及时间、使用药物保护和预防心肌毒性,或者使用新的剂型,如脂质体多柔比星。
脂质体是一种相对新型的靶向药物载体,可以增加药物疗效,减少不良反应,在肿瘤药物研发中愈来愈受到重视[1]。近年来,脂质体多柔比星在淋巴瘤中的应用越来越广泛,尤其是高龄及合并心脏疾病的患者。我们回顾性分析了接受脂质体多柔比星联合化疗的69例淋巴瘤患者的临床资料,旨在探讨脂质体多柔比星治疗淋巴瘤患者的有效率、常见不良反应以及耐受性。

表1 患者基本临床特征分析Tab.1 The basic clinical characteristics of all patients
1 资料和方法
1.1 临床资料
回顾性分析2006年1月—2011年10月在北京大学肿瘤医院淋巴肿瘤科住院并接受脂质体多柔比星联合化疗的患者临床资料。有完整临床资料的患者68例,其中初治患者47例,占69.1%;复治患者21例,其中11例为首次复发患者,5例为复发后接受二线治疗后病情稳定的患者,5例为一线治疗后疾病进展的患者。
1.2 临床特征
68例患者中,男性31例,女性37例,平均年龄63.1岁,Ⅲ~Ⅳ期患者54例;有B症状者30例,最常见为发热,22例;LDH增高者37例,β2-MG增高者34例。36例患者合并一种或数种心血管疾患,其中高血压病26例、冠心病13例、心律失常6例、高血压合并冠心病6例(表1)。
1.3 病理类型
在68例患者中,非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)63例,占92.6%,其中弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)42例,包括1例转化型DLBCL,占61.7%;套细胞淋巴瘤(mantle cell lymphoma,MCL)3例,弥漫小B细胞淋巴瘤/慢性淋巴细胞白血病(small B-cell lymphocytic lymphoma/chronic lymphocytic lymphoma,SLL/CLL)2例,滤泡性淋巴瘤(follicular lymphoma,FL)1例,FL伴DLBCL转化淋巴瘤1例;NK/T细胞淋巴瘤(NK/T cell lymphoma, NKTCL)6例,间变大细胞淋巴瘤(anaplastic large T-cell lymphoma,ALCL)及血管免疫母T细胞淋巴瘤(angioimmunoblastic T-cell lymphoma, AITL)各3例,外周T细胞淋巴瘤非特指型(peripheral T-cell lymphoma, non-specified,PTCL-NOS)和蕈样霉菌病/Sézary综合征(mycosis fungoides/Sézary syndrome,MF/SS)各1例。霍奇金淋巴瘤(Hodgkin’s lymphoma, HL)5例,其中结节硬化型(nodular sclerosis subtype,NS)3例,混合细胞型(mixed-cellular subtype,MC)2例。所有病理标本均经北京肿瘤医院病理科确诊,符合世界卫生组织(WHO)2008年淋巴瘤分类标准。具体见表2。
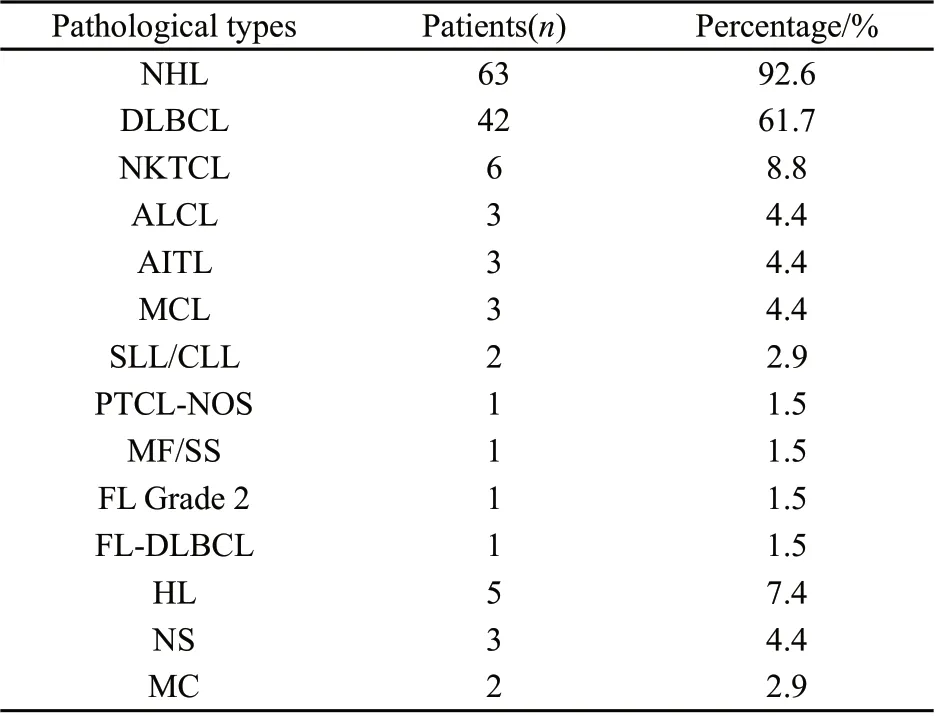
表2 患者的病理类型分析Tab.2 The pathological diagnosis and subtypes of all patients
1.4 既往治疗
21例复治患者既往均接受过全身化疗,其中19例曾接受普通蒽环类药物化疗。化疗周期数1~41个不等,平均周期数11.7个。方案多为CHOP(环磷酰胺、多柔比星、长春新碱、醋酸泼尼松)或CHOP类方案。其中3例患者曾接受利妥昔单抗治疗,4例曾接受氟达拉滨治疗,3例曾接受纵隔局部放疗,2例曾接受大剂量化疗联合自体干细胞移植治疗。
1.5 治疗方案及用药方法
NHL患者应用CCOP方案(脂质体多柔比星、环磷酰胺、长春新碱、泼尼松),其中29例B细胞NHL患者同时联合利妥昔单抗治疗(375 mg/m2)。霍奇金淋巴瘤患者应用ABVD(脂质体多柔比星、博来霉素、长春新碱、氮烯咪胺)或BEACOPP(脂质体多柔比星、博来霉素、依托泊甙、环磷酰胺、长春新碱、甲基苄肼、泼尼松)方案。化疗2~8个周期,平均5.1个周期,中位5个周期。4例患者在常规化疗结束后接受了大剂量化疗联合自体干细胞移植治疗,8例患者在常规化疗后或化疗期间接受过局部放疗,8例患者在常规化疗结束后接受单药利妥昔单抗维持治疗。
脂质体多柔比星12.5~25 mg/m2,20 mg溶于5%葡萄糖溶液250 mL中,静脉滴注30 min以上,给药前30 min静脉输注地塞米松5~10 mg,预防超敏反应,同时进行血压、心律的监测。根据化疗方案每3~4周重复1次,并根据患者体能状态及不良反应决定是否延期或者减量给药。
1.6 疗效判断
采用2007年版Cheson标准判断[2],分为完全缓解(CR)、不确定完全缓解(CRu,评价疗效方法不包括PET/CT)、部分缓解(PR)、疾病进展(PD)和复发(达CR/CRu者)。
1.7 不良反应判断
不良反应按照WHO评价标准进行临床评估,分为0~4级。
1.8 观察指标
治疗前后常规检查血常规、生化(含肝肾功能)、乳酸脱氢酶(LDH)、β2-微球蛋白(β2-MG)、红细胞沉降率(ESR)、心电图。每2个周期化疗后进行CT及B超、磁共振成像(MRI)等影像学检查并评价疗效。
1.9 统计学处理
应用SPSS 17.0 统计软件对病例资料进行统计分析,由于本组初治患者中仅29例的随访时间>2年,且病理类型不统一,因此,仅统计了治疗有效率、随访时间和治疗相关不良反应,未进行生存曲线分析。
2 结 果
2.1 治疗效果
68例患者的总有效率(ORR)为73.5%,其中完全缓解(CR)率为57.4%,部分缓解(PR)率为19.1%;所有初治患者的ORR率为76.6%,CR率为59.6%;初治DLBCL的ORR率为74.3%,CR率为60%,其中接受R-CCOP方案治疗的患者ORR率为81.5%,CR率为66.7%。
2.2 不良反应
最常见的不良反应为骨髓抑制,发生率94.1%。38例患者出现心脏毒性,发生率55.9%,其中心电图改变共37例,包括ST-T改变17例、窦性心律异常16例、房性早搏8例、束支传导阻滞3例;心功能异常3例。这些患者既往均患有冠心病及高血压病,其中2例心脏超声表现为左室射血分数(left ventricular ejection fraction,LVEF)下降。药物性肺损伤5例,但不能确定是否和脂质体多柔比星相关(表3)。
2.3 生存分析
至2011年10月最后一次随访,22例患者死亡,2例患者失访。随访时间超过2年的初治患者28例,2年生存率为71.4%;随访时间超过2年的初治DLBCL患者22例,2年生存率为77.2%。
2.4 预后
因初治患者病理类型不一,未进行预后因素统计学分析。
3 讨 论
脂质体作为蒽环类抗肿瘤药物的有效载体始于上世纪70年代末[3],具有免疫原性小、水溶和脂溶性药物都可包埋运载、药物缓释、药效持续时间长、不良反应低、被动靶向肿瘤部位、疗效增强等优点。表面包裹高分子聚乙二醇的脂质体(pegylated liposomal doxorubicin, PLD),即“隐形”脂质体,含亲水性聚合物,可提高其表面的亲水性,而其衍生物可以阻止血浆蛋白吸附,减少网状内皮系统的吞噬吸收,逃避免疫系统,从而延长药物在体内的循环时间。蒽环类脂质体在毛细血管紧密结合处,如心肌组织,不易被释放;聚乙二醇化可进一步保护蒽环类脂质体,减少其被心肌细胞的吸收,从而极大地减少了蒽环类药物对心脏的不良反应[4]。
脂质体多柔比星早期主要用于淋巴瘤挽救化疗中,尤其是皮肤T细胞淋巴瘤和HL[5]。Pulini等[6]报道,单药脂质体多柔比星治疗19例复发及难治原发皮肤T细胞淋巴瘤患者,20 mg/m2持续输注1 h,28 d重复,共6个周期。ORR和CR分别为84.2%和42.1%,仅1例患者出现2级以上粒细胞减少,1例患者出现1级手足综合征。Lorusso等[7]报道,单药脂质体多柔比星治疗25例复发难治T细胞淋巴瘤的ORR为56%,主要不良反应为贫血(36%)和乏力(20%),心脏毒性主要表现为房室传导阻滞1例,LEF下降1例。Bartlett等[8]报道使用GVD方案(吉西他滨、长春瑞滨及脂质体多柔比星)治疗91例复发HL患者,ORR为70%,CR为19%,主要剂量限制毒性为黏膜炎和粒细胞减少性发热,与HL的其他挽救化疗方案相比,疗效相当,不良反应减少。
脂质体多柔比星一线治疗淋巴瘤多见于老年患者。在意大利的一项研究中[9],共入组13例60~75岁的DLBCL患者,接受R-CHOP一线方案治疗,其中以脂质体多柔比星替代传统多柔比星,ORR为76%,CR为59%。研究期间应用超声心动图、血清心肌酶等指标对心脏毒性进行监测,发现治疗前后无明显差异。另一项前瞻性Ⅱ期临床研究中[10],33例DLBCL患者接受CDOP(环磷酰胺、长春新碱、脂质体多柔比星及泼尼松)一线化疗,共6个周期,全组患者中位年龄74岁。ORR为64%,CR为19%。21例患者出现3~4级粒细胞减少症,未发生有临床意义的心功能损伤。
文献报道脂质体多柔比星的主要不良反应包括黏膜炎、手足综合征、胃肠道反应、超敏反应、骨髓抑制以及心脏毒性[5,7,11]。其中骨髓抑制最常见,黏膜炎和手足综合征是脂质体多柔比星的主要剂量限制毒性。手足综合征的发生率18%~49%[12],与该药的剂量强度有关。重度骨髓抑制的发生率较常规蒽环类药物低,心脏毒性仍然较常见,但与普通蒽环类药物相比,发生率和严重程度明显下降[13]。对该药目前尚无确切的剂量限制[14],但是累积剂量>400 mg/m2时发生心脏毒性的风险有明显增加的趋势。2011年美国国立癌症综合网(NCCN)指南推荐脂质体多柔比星替代普通蒽环类药物,联合一线化疗方案治疗伴左心功能不全的DLBCL患者,并推荐脂质体多柔比星单药治疗MF/SS。
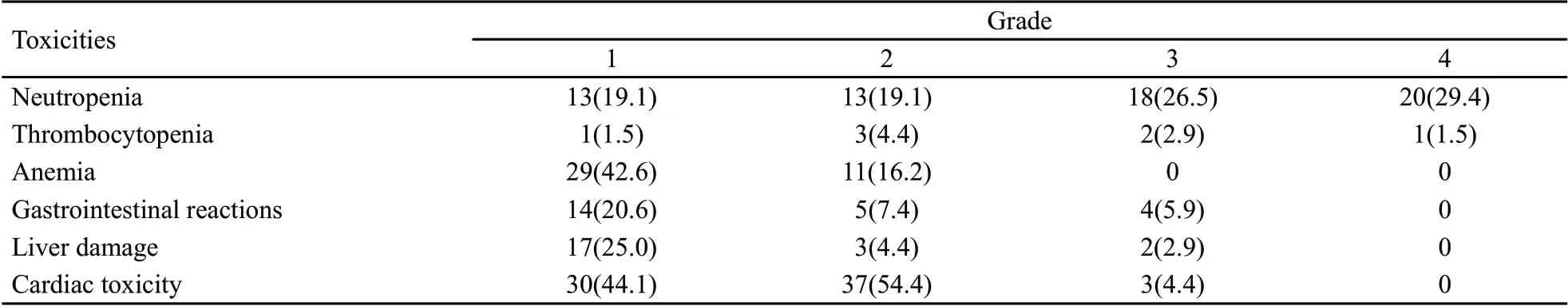
表3 脂质体多柔比星联合化疗的主要不良反应Tab.3 The major toxicities of liposomal doxorubicin-based chemotherapy[n(%)]
本组患者中NHL的治疗有效率与文献报道类似。4例复治HL患者的治疗有效率为75%,因例数太少,与文献报道的数据难以对比。68例患者中,最常见的不良反应为骨髓抑制及心电图改变。3~4级粒细胞减少症的发生率为55.9%,与患者接受联合化疗方案以及部分患者既往多周期化疗有关,而非单系脂质体多柔比星的毒性。38例患者出现心脏毒性,其中37例患者为心电图改变,发生率为54.4%,其中ST-T改变17例,窦性心律异常者16例,早搏8例,束支传导阻滞3例。经过休息、口服扩张血管药物或β受体阻断剂后均有好转。3例出现心功能异常,均系初治患者,年龄>70岁,既往患有冠心病及高血压,其中2例为LEF下降,并因此中断治疗;1例为全心功能下降,经治疗后缓解,继续化疗。目前,此3例患者均维持CR。19例既往接受蒽环类药物治疗的复治患者中,11例出现心电图改变,发生率57.8%,与初治患者差异无统计学意义。所有患者均未发生心肌梗死、黏膜炎及手足综合征。其他毒性包括:3~4级血小板减少症4.4%,无出血患者;1~2级红细胞减少症58.8%;1例71岁患者出现肺部感染、呼吸衰竭并最终死亡,但该患者合并失代偿性肝硬化、2型糖尿病、高血压病及心脏病等多种疾患,心肺功能基础差。
综上所述,脂质体多柔比星用于初治及复治淋巴瘤患者的联合化疗,有效率高,安全性较好。尤其推荐用于老年,或伴有心脏疾患,亦或既往使用过蒽环类药物的患者。同时还需要进行更多、更大规模的临床研究来确认其在淋巴瘤治疗中的地位。
[1]ABU LILA A S, ISHIDA T, KIWADA H, et al.Recent advances in tumor vasculature targeting using liposomal drug delivery systems [J].Expert Opin Drug Deliv, 2009, 6(12): 1297-1309.
[2]CHESON B D, PFISTNER B, JUWEID M E, et al.Revised response criteria for malignant lymphoma[J].J Clin Oncol, 2007, 25(5): 579-586.
[3]ALBERTS D S, GARCIA D J.Safety aspects of pegylated liposomal doxorubicin in patients with cancer[J].Drugs, 1997, 54(Suppl 4): 30-35.
[4]THEODOULOU M, HUDIS C.Cardiac profiles of liposomal anthracyclines: greater cardiac safety versus conventional doxorubicin[J].Cancer, 2004, 100(10): 1052-1063.
[5]ORLOVSKI R Z, NAGLER A, SONNEVELD P, et al.Randomized phase Ⅲ study of pegylated liposomal doxorubicin plus bortezomib compared with bortezomib alone in relapsed or refractory multiple myeloma: combination therapy improves time to progression[J].J Clin Oncol, 2007, 25(25): 3892-3901.
[6]PULINI S, RUPOLI S, GOTERI G, et al.Pegylated liposomal doxorubicin in the treatment of primary cutaneous T-cell lymphomas[J].Haematologica, 2007, 2(05): 686-689.
[7]LORUSSO D, Di STEFANO A, CARONE V, et al.Pegylated liposomal doxorubicin-related palmar-plantar erythrodysesthesia(‘hand-foot’syndrome) [J].Ann Oncol, 2007, 18(7): 1159-1164.
[8]BARTLETTD N L, NIEDZWIECKI D, JOHNSON J L, et al.Gemcitabine, vinorelbine, and pegylated liposomal doxorubicin (GVD), a salvage regimen in relapsed Hodgkin’s lymphoma: CALGB 59804[J].Ann Oncol, 2007, 18(6): 1071-1079.
[9]ZAJA F, TOMADINIO V, ZACCARIA A, et al.CHOPrituximab with pegylated liposomal doxorubicin for the treatment of elderly patients with diffuse large B-cell lymphoma[J].Leukemia Lymph, 2006, 47(10): 2174-2180.
[10]MARTINO R, PEREA G, CABALLERO M D, et al.Cyclophosphamide, pegylated liposomal doxorubicin (Caelyx), vincristine and prednisone (CCOP) in elderly patients with diffuse large B-cell lymphoma: results from a prospective phase Ⅱ study[J].Haematologica, 2002, 87(8): 822-827.
[11]OFFIDANI M, CORVATTA L, PIERSANTELLII M N, et al.Thalidomide, dexamethasone, and pegylated liposomal doxorubicin (ThaDD) for patients older than 65 years with newly diagnosed multiple myeloma[J].Blood, 2006, 108(7): 2158-2164.
[12]QUEREUX G, MARQUES S, NQUYEN J M, et al.Prospective multicenter study of pegylated liposomal doxorubicin treatment in patients with advanced or refractory mycosis fungoides or Sezary Syndrome[J].Arch Dermatol, 2008, 144(6): 727-733.
[13]HUNAULT-BERGER M, LEGUAY T, Thomas X, et al.A randomized study of pegylated liposomal doxorubicin versus continuous-infusion doxorubicin in elderly patients with acute lymphoblastic leukemia: the GRAALL-SA1 study[J].Haematologica, 2011, 96(2): 245-252.
[14]SAFRA T, MUGGIA F, JEFFERS S, et al.Pegylated liposomal doxorubicin (doxil): reduced clinical cardiotoxicity in patients reaching or exceeding cumulative doses of 500 mg/m2[J].Ann Oncol, 2000, 11(8): 1029-1033.

