CDA-Ⅱ联合化疗治疗晚期复治非小细胞肺癌的临床观察
郑鸿 陶莉 肖谜
复旦大学附属肿瘤医院闵行分院化疗科,上海 200240
肺癌是一种常见的肺部恶性肿瘤,其死亡率已逐年升高。近70%的患者被确诊时已不宜手术。一线化疗虽能延长患者生存期,改善患者生存质量,但有效率仅为30%。 因此对复发或转移初治无效患者的治疗,需引入新的药物及治疗方法。尿多酸肽(uroacitides cell differentiation agent Ⅱ,CDA-Ⅱ)是从健康人尿中分离提取的细胞分化诱导剂,对多种肿瘤具有抑制DNA甲基转移酶(DNMT)、诱导分化凋亡的作用,而且还可以逆转肿瘤耐药,防止肿瘤复发和转移[1-2]。复旦大学附属肿瘤医院闵行分院化疗科自2009年1月—2011年2月应用CDA-Ⅱ联合化疗治疗35例晚期复治的非小细胞肺癌患者,现将其疗效及不良反应报道如下。
1 资料和方法
1.1 研究对象
本院收治的二线化疗失败出现复发或转移并采用三线化疗的非小细胞肺癌患者67例,均经病理或细胞学确诊,有可测量病灶。一般状况Karnofsky(KPS)评分≥60,预计生存期3个月以上,男性31例、女性36例,年龄38~79岁。距末次化疗≥4周。心、肝、肾、骨髓等主要器官功能基本正常。自愿接受本疗法且能随访、依从性好的患者67例患者随机分治疗组(35例)和对照组(32例),其中腺癌53例,鳞癌11例,低分化癌3例。1个部位转移的有30例,2个部位转移的有24例,3个及以上的有13例。既往曾手术治疗32例,曾接受放疗35例,曾接受2个化疗方案67例。两组在年龄、性别、病理类型、KPS评分、临床转移及既往治疗情况上差异均无统计学意义(P>0.05)。
1.2 给药剂量及方法
治疗组:CDA-Ⅱ注射液为静脉给药,用时与氯化钠注射液按1∶1稀释后静脉滴注,滴速以原药100 mL/h为宜,每次300 mL,每天1次,于化疗前7 d开始给药,化疗当天停用本品,化疗方案为非小细胞肺癌常用的化疗药物(包括紫杉类、铂类、盖诺、泽菲、培美曲赛);对照组:单纯化疗,化疗方案同治疗组,两组共2~3个周期;21 d为1个周期;每2个周期后评估疗效。
1.3 观察方法
肿瘤疗效评定按实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)标准。分为:完全缓解(complete response,CR),部分缓解(partial response,PR),稳定(stable disease,SD),肿瘤进展(progressive disease,PD)。近期客观有效率为CR+PR,肿瘤控制率为CR+PR+SD。远期疗效观察中位生存时间及1年生存率。
1.4 随访
对所有入组患者定期进行随访,并记录随访结果。随访截止日期为2012年3月10日,两组均无失访病例。从入组至死亡或末次随访时间为总生存时间,同时计算中位生存时间。
1.5 生活质量评估
生活质量的评估[3]参照美国临床受益反应(clinical benefit response,CBR)评估标准稍加修改,KPS评分、疼痛变化、体重变化为CBR评估指标。
1.6 不良反应
主要的不良反应为血液学毒性及非血液学毒性。不良反应分级标准按世界卫生组织(World Health Organization,WHO)评定。如WHO未列不良反应分级标准,则按轻(Ⅰ)、中(Ⅱ)、重(Ⅲ)、致命(Ⅳ)评定。
1.7 统计学处理
采用统计学软件SPSS 13.0进行数据处理,评价疗效及不良反应采用χ2检验,治疗前后临床受益的比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效
治疗组CR为0例,PR 4例,SD 17例,PD 14例,总有效率为11.4%,肿瘤控制率为60.0%。对照组CR为0例,PR 2例,SD 10例,PD 20例,总有效率为6.3%,肿瘤控制率为37.5%,两组总有效率差异无统计学意义(χ2=0.55,P>0.05);而两组的疾病控制率差异有统计学意义(χ2=3.387,P<0.05)。
2.2 生活质量
CBR率为54.3%(19/35),治疗前后比较差异有统计学意义(P<0.05,表1)。
表1 临床受益变化Tab.1 Clinical benef it response (CBR) changes(±s)
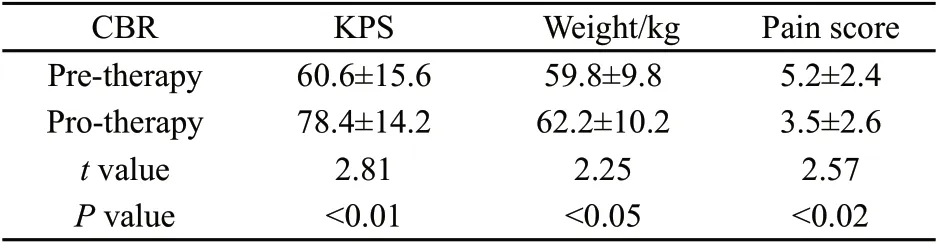
表1 临床受益变化Tab.1 Clinical benef it response (CBR) changes(±s)
?
2.3 远期疗效
治疗组中位生存时间为9.3个月,对照组为6.1个月,治疗组的1年生存率为48.6%(17/35),对照组为31.3%(10/32),两组比较差异有统计学意义(χ2=3.390,P<0.05)。
2.4 不良反应
67例患者共完成259个周期化疗,中位周期数为3个。两组均可评价不良反应,两组主要不良反均应为骨髓抑制及胃肠道反应,主要为Ⅰ~Ⅱ级。粒细胞减少治疗、对照组分别为80.0%(28/35)和75.0%(24/32),血小板减少分别为22.9%(8/35)和15.6%(5/32),恶心呕吐分别为42.8%(17/35)和37.5%(12/32)。总体不良反应轻微,耐受性好(表2)。
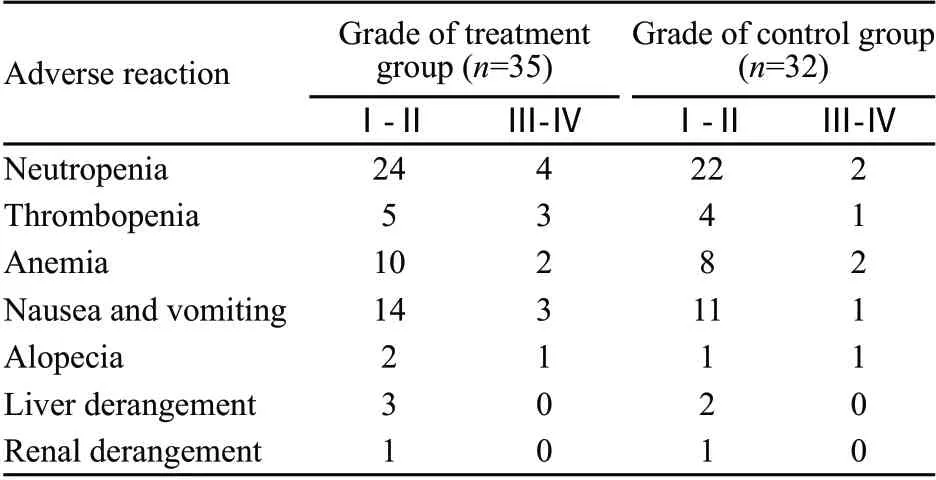
表2 两组不良反应的比较Tab.2 Comparison of adverse reactions related to chemotherapy between two groups
3 讨 论
晚期非小细胞肺癌的治疗以联合化疗为主,肿瘤细胞原发或继发耐药的存在是化疗失败的常见原因。有文献[4]报道,CDA-Ⅱ作用于Her-2/neu、MDR-1,能降低耐药基因,从而起到逆转耐药的作用。而CDA-Ⅱ的主要成分有马尿酸、苯乙酰谷氨酰胺、4-羟基苯乙酸、5-羟基吲哚乙酸和多肽等,是一种新型的国内自主研发的非细胞毒抗肿瘤药物[5]。国内许多学者[6-7]通过体内外实验研究表明CDA-Ⅱ能显著抑制肿瘤细胞生长,通过抑制甲基转移酶活性和DNA去甲基化,诱导肿瘤细胞向正常细胞分化来发挥其抗癌作用。
本研究结果显示,治疗组和对照组肿瘤控制率为60.0%和37.5%,两者差异有统计学意义(P<0.05),这可能与CDA-Ⅱ逆转化疗耐药的作用机理有关;主要表现为[8]:①CDA-Ⅱ作用于肿瘤干细胞,抑制肿瘤干细胞的活性,对肿瘤的长期控制有一定影响;②CDA-Ⅱ为细胞分化诱导剂,诱导肿瘤干细胞向正常细胞分化,而不是通过细胞毒作用杀死肿瘤细胞,所以肿瘤的体积不会迅速缩减。本研究结果还显示:治疗组患者治疗前后肿瘤大小变化不大,无CR病例,SD 17例,可能与此机理有一定关系。此外,两组有效率分别为11.4%和6.3%,两者差异无统计学意义(P>0.05);这与文献[4]报道的结果一致;这可能与本试验入选病例的特殊性有关,入组病例均为晚期复治的二线化疗失败的非小细胞肺癌患者。治疗组患者的中位生存期为9.3个月,高于对照组的6.1个月,1年生存率分别为48.6%和31.3%(P<0.05) ,说明CDA-Ⅱ联合化疗可延长晚期复治非小细胞肺癌患者的生存期。
本研究还发现,CDA-Ⅱ联合化疗提高了患者的生活质量,CBR率为54.3%;且不良反应以骨髓抑制、胃肠道反应为主。两组骨髓抑制以粒细胞减少为主,分别为80.0%和75%,这可能与患者既往已行多次放化疗有关;恶心呕吐分别为42.8%和37.5%,但差异均无统计学意义(P>0.05)。本研究均无静脉炎发生,因所有患者有深静脉或PICC导管。说明CDA-Ⅱ联合化疗未增加化疗药物的不良反应
目前肿瘤治疗不仅关注肿瘤的退缩及生存期的延长,还注重患者生活质量的提高。本研究结果显示CDA-Ⅱ联合化疗可以提高晚期复治的非小细胞肺癌患者的肿瘤控制率及远期生存率,改善患者生活质量且不良反应轻,可以耐受,值得临床进一步推广应用。
[1]廖明徵.肿瘤的诱导分化疗法[J].中国肿瘤, 2002, 11(2): 104-107.
[2]叶宝东, 沈一平, 周郁鸿, 等.尿多酸肽( CDA-2)诱导多发性骨髓瘤细胞RPMI8226凋亡的实验研究[J].浙江中医药大学学报, 2010, 34(5): 650-657.
[3]冯奉仪, 李青, 王振玖.尿多酸肽改善晚期癌症患者生活质量的临床研究[J].中国肿瘤, 2002, 2(11): 108-110.
[4]唐俊舫, 徐丽艳, 朱允中, 等.尿多酸肽联合NP与NP方案化疗在晚期非小细胞肺癌的随机对照临床研究[J].肺癌杂志, 2006, 9(6): 536-538.
[5]王红兵, 王亚丽, 刘德生, 等.尿多酸肽对人肺腺癌A549细胞的作用及人肺腺癌A549细胞株E-cadherin基因甲基化的研究[J].实用癌症杂志, 2010, 25(5): 445-452.
[6]石永刚, 郭小齐, 李甸源, 等.喜滴克联合化疗治疗多发性转移食管癌的临床研究[J].中国医药技术经济与管理, 2008, 2(8): 66-68.
[7]陈建新, 王轩, 于阳, 等.尿多酸肽治疗低/中危骨髓增生异常综合征患者贫血改善的疗效观察[J].中国新药杂志, 2012, 21(5): 502-504.
[8]李青, 冯奉仪, 陈强, 等.尿多酸肽注射液治疗晚期肿瘤的临床研究[J].中华肿瘤杂志, 2008, 30(7), 534-537.

