低分子肝素对肿瘤化疗免疫功能的影响分析
程海花,许利华
(1.三原县人民医院,陕西 三原 713800;2.南通市第一人民医院,江苏 南通 226001)
一般情况下,化疗患者常常处于机体免疫功能的较低状况[1]。与正常人群相比,恶性肿瘤患者中免疫功能受损的发生率是正常人群的4倍[2]。低分子肝素(LMWH)是近10年发展起来的新一代肝素类抗凝药物[3]。本研究通过分别检测胃癌患者单纯化疗组和化疗+低分子肝素组化疗前24h、化疗后1h、24h免疫指标的变化,以探讨低分子肝素对肿瘤化疗免疫功能的影响,报告如下。
1 资料与方法
1.1 一般资料
选择2008年2月~2011年4月在我院住院的胃癌患者80例,男49例,女31例,年龄18~64岁,平均(52.2±3.24)岁,包括腺癌40例、鳞癌30例、腺鳞癌10例。①所有病例均为病理组织学确诊且一线治疗无效或复发的胃癌患者;②年龄17~65岁;③卡氏评分>60分;④能承受化疗;⑤患者同意并签署治疗知情同意书;⑥本治疗得到医院医学伦理委员会批准。随机分为治疗组与对照组各40例,两组患者年龄、性别、癌症病理类型比较差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
两组都采用常规化疗方法,给予多西紫杉醇75 mg/(m2·dl)或多西紫杉醇75m/(m2·dl)+顺铂80mg/(m2·dl)的化疗方案静脉给药。在此基础上治疗组加用低分子肝素(国药准字H20010299,海南通用同盟药业有限公司)5 000IU皮下注射Q12h。两组均治疗4周。
1.3 标本采集
两组分别于治疗前、化疗后1h、24h采集静脉血2mL,用3.2%枸橼酸钠抗凝,随即以3 000r/min离心10min分离血浆,最迟须在6h内分离血浆,血浆分存后储存于-20℃至检测时。
1.4 观察指标
①T细胞亚群检测:取抗凝全血100μl,加入10 μl CD3-PC5/CD25-PE,混 匀,室温避光反应20 min,每管加入预冷的溶血剂1mL,混匀,室温避光反应10min,取出后1 500r/min离心5min弃上清,1.5mL PBS洗2次(1 200r/min,5min),弃上清,加入500μl PBS缓冲液重悬细胞。FCM测定,CellQuest软件中获取数据和分析,分析细胞所占比例,收集测定细胞10 000个。②NK细胞检测:取抗凝全血100μl,加入10μlPE,混匀,室温避光反应20min,每管加入预冷的溶血剂1.5mL,混匀,室温避光反应10min,取出后1 500r/min离心5min弃上清,1.5mL PBS洗2次(1 200r/min,5min),弃上清,加入500μl PBS缓冲液重悬细胞。CellQuest软件中获取数据和分析,分析细胞所占比例,收集测定细胞10 000个。
1.5 疗效判定
两组患者均于治疗后复查胸片或CT,评价近期疗效(参照 WHO肿瘤病灶分类及疗效评价标准)[4]。
1.6 统计学方法
所有组间、组内数据均采用SPSS 19.0统计软件进行统计学分析,免疫指标数据结果以均数±标准差(±s)表示,各组均数的比较采用单因素方差分析(ANOVA),有差异显著者用Tamhane检验作两两比较(方差不齐);临床疗效等资料对比采用χ2检验,P<0.05为具有统计学意义。
2 结果
2.1 近期疗效评价
两组均无CR病例,治疗组的RR为30.0%,对照组为10.0%,治疗组的近期疗效明显高于对照组(P<0.05),见表1。

表1 两组患者近期疗效(例)
2.2 T淋巴细胞亚群的变化
两组患者CD+3、CD+4、CD+4/CD+8值于化疗后1 h与24h显著降低,与治疗前比较差异有统计学意义(P<0.05);治疗组在化疗后两个时间点的上述指标值下降均较对照组多(P<0.05),见表2。
表2 两组患者化疗前后T淋巴细胞亚群的变化(±s,%)
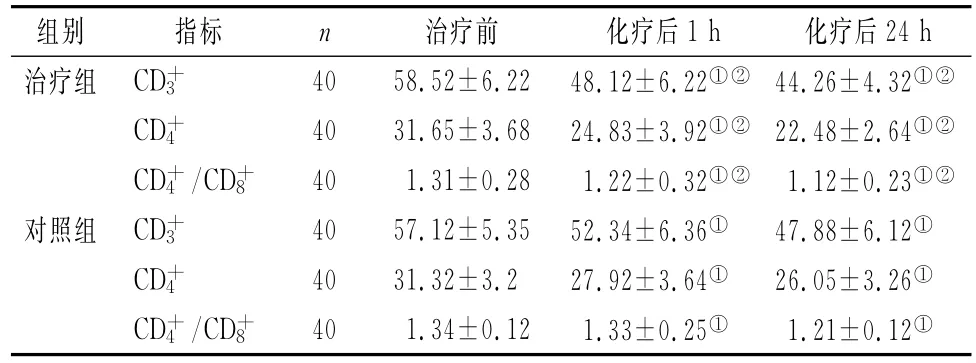
表2 两组患者化疗前后T淋巴细胞亚群的变化(±s,%)
注:与化疗前比较,①P<0.05;组间比较,②P<0.05
组别 指标 n 治疗前 化疗后1h 化疗后24h治疗组 CD+340 58.52±6.22 48.12±6.22①② 44.26±4.32①②CD+4 40 31.65±3.68 24.83±3.92①② 22.48±2.64①②CD+4/CD+8 40 1.31±0.28 1.22±0.32①②1.12±0.23①②对照组 CD+340 57.12±5.35 52.34±6.36①47.88±6.12①CD+4 40 31.32±3.2 27.92±3.64①26.05±3.26①CD+4/CD+8 40 1.34±0.12 1.33±0.25①1.21±0.12①
2.3 NK细胞的变化
两组患者NK细胞的数量于化疗后1h与24h显著降低,与治疗前比较差异有统计学意义(P<0.05);治疗组在化疗后1h与24h后两个时间点的NK细胞的数量下降均较对照组明显(P<0.05),见表3。
表3 两组患者化疗前后NK细胞的变化(±s,%)

表3 两组患者化疗前后NK细胞的变化(±s,%)
注:与化疗前比较,①P<0.05;组间比较,②P<0.05
组别 n 治疗前 化疗后1h 化疗后24h治疗组 40 12.33±2.12 10.13±1.23①② 9.22±1.22①②对照组 40 12.34±1.51 10.84±1.44① 10.32±1.45①
3 讨论
肿瘤的发生部分是由于机体全身或局部免疫功能失常而引起的,肿瘤的生长与发展也在很大程度上决定于机体的免疫系统状态[5]。增强机体的免疫功能对提高肿瘤治疗的预后起着重要作用,恶性肿瘤患者的免疫功能低下,而化疗药物可损害患者的免疫系统,导致免疫功能缺陷或下降。免疫功能指标如E-玫瑰结试验、CH50、C3补体、T细胞亚群、NK细胞活性、白介素Ⅱ等,在化疗后均可不同程度的下降,大部分抗肿瘤化疗药物有免疫抑制作用[6,7]。有研究报告显示治疗前T淋巴细胞亚群(TLS)水平在正常范围的小儿患者,在化疗后CD+3、CD+4、CD+4/CD+8值均显著下降[8]。在免疫功能指标上,T细胞来源于骨髓的淋巴样干细胞,在胸腺中经历早期T细胞发育、阳性选择和阴性选择3个不同的分化阶段后发育成熟为T细胞。NK细胞减少可导致游离出的微小癌栓成活[9]。
低分子肝素克服了普通肝素的出血、注射吸收低等缺点。低分子肝素能够增加膜脂流动性,使镶嵌在细胞膜脂质双层中的抗原决定簇暴露,增加肿瘤细胞的抗原性,利于体液免疫的杀伤[10]。同时可以使肿瘤细胞凋亡,并产生特异性免疫,从而起到杀伤肿瘤的作用。本文显示,化疗后两组均无CR病例,治疗组RR30.0%,对照组RP10.0%,治疗组的近期疗效明显高于对照组(P<0.05)。两组患者CD+3、CD+4、CD+4/CD+8和NK细胞数量于化疗后1 h与24h显著降低,与治疗前比较差异有统计学意义(P<0.05);治疗组在化疗后两个时间点的上述指标值下降均较对照组明显(P<0.05)。
总之,低分子肝素在胃癌化疗中的应用能够有效提高近期疗效,降低T细胞亚群和NK细胞数量,从而改善免疫功能,值得推广应用。
[1]张治云,凌沛学,王凤山,等.低分子肝素临床应用的研究进展[J].中国生化药物杂志,2006,27(4):253-255.
[2]毛祖彝.热疗对荷瘤小鼠NK细胞活性的影响[J].中华放射肿瘤学杂志,2008,8(4):260-263.
[3]阳洁.小剂量肝素防治急性早幼粒细胞白血病联合化疗并发DIC的初步观察[J].南华大学学报·医学版,2001,29(4):381-382.
[4]王慧敏,廖美琳,顾爱琴,等.抗凝联合化疗治疗晚期NSCLC的临床研究[J].肿瘤,2005,25(3):250-253.
[5]元俊华,张秀东,郭立峰.低分子肝素在妇科肿瘤患者术后的应用[J].实用妇产科杂志,2001,17(3):150.
[6]Godwin J.Use of low molecular weight heparin in malignancy related thromboembolic disorders:a clinical review[J].Clin Appl Thromh Hemostas,2008,2(1):28-34.
[7]Akl EA,Barba M,Rohilla S,et al.Anticoagulation for the long term treatment of venous thromboembolism in patients with cancer[J].Evid Based Nurs,2011,11(4):117.
[8]Kodama N,Komuta K,Nanba H.Effect of Maitake(Grifola frondosa)D-Fraction on the activation of NK cells in cancer patients[J].J Med Food,2003,6(4):371-377.
[9]Orditura M,Romano C,De Vita F,et al.Behaviour of interleukin-2serum levels in advanced non small cell lung cancer patients:relationship with response to therapy and survival[J].Cancer Imaunol Imunother,2000,49(10):530-536.
[10]Fischer JR,Schindel M,Bulzebruck H,et al.Long term survival in small cell lung cancer patients is correlated with high interleukin-2secretion at diagnosis[J].J Cancer Res C1in Oncol,2000,126(12):730-733.

