肿瘤坏死因子-α对人表皮黑素细胞增殖及黑素合成的影响研究
林新瑜,王芳,林鸿刚,段西凌
(1.四川省医学科学院·四川省人民医院皮肤病性病研究所,四川 成都 610072;2.四川大学国家生物治疗重点实验室,四川 成都 610041)
黄褐斑、白癜风等是临床上常见的色素障碍性疾病,目前其发病机理还不十分清楚,治疗难度也较大,影响美观。黑素细胞合成黑素是在其特征性细胞器-黑素小体内进行的,酪氨酸酶是黑素生成的主要限速酶。本研究建立正常人表皮黑素细胞体外培养体系,采用不同浓度的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)作用于体外培养的黑素细胞,观察其对黑素细胞生物活性的影响,包括黑素细胞的增殖、黑素合成和黑素细胞的凋亡率,从而为研究色素障碍性皮肤病的发病机制及色素性疾病的治疗提供新的思路。
1 材料和方法
1.1 材料及仪器
MCDB-153培养基,牛胰岛素,人转铁蛋白,LDopa,TNF-α,DMSO,MTT 均购自美国 Sigma公司。重组人表皮生长因子(rhEGF)购于美国Peprotech公司,牛垂体提取物(BPE)购于美国Invitrogen公司。10%新生小牛血清购自Hyclone公司。EDTA-Na2购自美国Gibco公司。氢化可的松0.5μg/ml,青霉素100IU/ml,链霉素100 IU/ml,胰蛋白酶,苔盼兰均系国产。培养瓶、96孔板和6孔板均购于美国Corning公司;酶联免疫检测仪;流式细胞仪。标本经患者知情同意后取自18~35岁行包皮环切术的正常人包皮。
1.2 方法
1.2.1 正常人黑素细胞的培养及鉴定
参照文献[1~4]进行黑素细胞体外纯培养,培养细胞经多巴染色、Fontana银染、S-100蛋白免疫组化染色进行鉴定[5],证实其为黑素细胞。
1.2.2 黑素细胞增殖的测定
采用四甲基偶氮唑蓝比色法(MTT法)[6],按公式计算其净抑制率。抑制率=(对照组-实验组)/对照组×100%,净抑制率=各组的抑制率-溶剂对照组(PBS)的抑制率。
1.2.3 黑素合成的测定
采用 NAOH 法[7]。黑素合成抑制率=[1-(药物孔吸光度值÷药物孔细胞密度)÷(对照孔吸光度值÷对照孔细胞密度)]×100%。
1.2.4 流式细胞术检测
细胞培养、计数等如前,按2×105/孔接种到6孔板,浓度100ng/ml的TNF-α处理组和PBS对照组,空白对照组设置如前,细胞处理72h后,分别收集细胞悬液转到相应的已经收集有各自上清的离心管里,1500rpm离心3min,弃去上清,重复3次PBS清洗过程后,弃去上清,加入PI溶液,室温避光孵育30min,上机检测。
1.3 统计学处理
全部数据采用SPSS统计软件10.0版进行分析。
2 结果
2.1 形态学结果
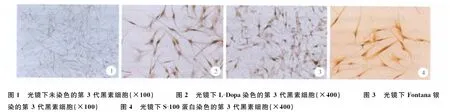
体外培养的正常人黑素细胞为双极、三极和多极的树突状细胞,细胞增殖良好,细胞树突之间交织成网(见图1)。
2.2 黑素细胞鉴定
2.2.1 L-Dopa 染 色
第3代黑素细胞经0.1%L-Dopa染色后镜下见黑素细胞胞质及树突均被染成灰黑色(见图2)。
2.2.2 Fontana银染
3代黑素细胞经氨银液避光浸染30min,细胞被染成黑色(见图3)。
2.2.3 S-100蛋白染色
黑素细胞胞质及树突呈棕黄色阳性着色从而可以鉴定为黑素细胞(见图4)。
2.3 不同浓度TNF-α对人正常皮肤黑素细胞增殖率(%)的影响
黑素细胞增殖的测定结果见表1和表2。
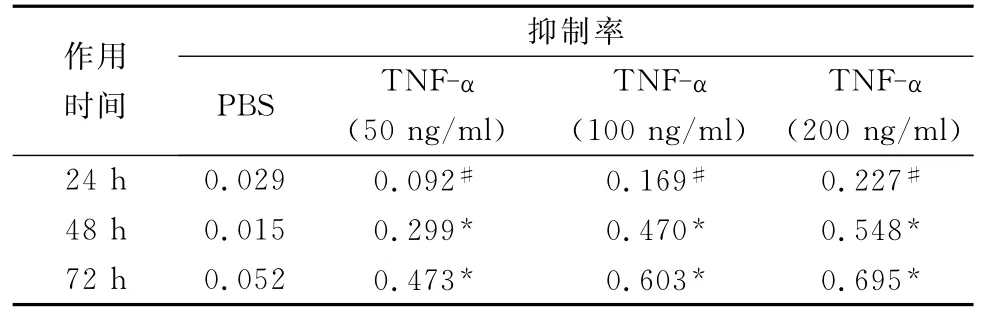
表1 不同浓度TNF-α与PBS作用于黑素细胞后的抑制率的比较
表1可见,不同浓度TNF-α实验组对黑素细胞的抑制率较PBS对照组相比有统计学意义(P<0.05#或P<0.01*)。

表2 不同浓度TNF-α作用于黑素细胞后的净抑制率比较
从表2中可以看出随作用时间增加,黑素细胞净抑制率逐渐增加,而且随TNF-α的浓度增加,黑素细胞的净抑制率也逐渐增加,说明其对黑素细胞的抑制作用呈现出时间和剂量的相关性。
2.4 黑素合成的测定结果
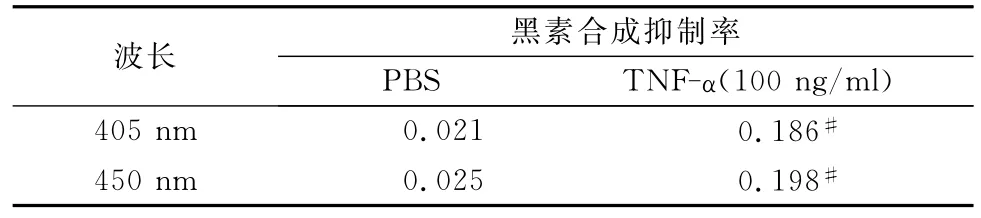
表3 TNF-α作用于黑素细胞后的黑素合成抑制率的比较
从表3可见,405nm处和450nm处测量吸光度值,按公式计算其黑素合成抑制率均可见TNF-α作用后黑素合成抑制率增加,而且TNF-α组与PBS组比较,统计学上均有显著性差异(P<0.05#)。
2.5 流式细胞术检测结果
浓度为100ng/ml的TNF-α作用于黑素细胞72h后用流式细胞术检测的结果:空白对照组黑素细胞凋亡率为4.0%,溶剂PBS组黑素细胞凋亡率为6.7%,TNF-α(100ng/ml)组黑素细胞凋亡率为35.4%。TNF-α(100ng/ml)组黑素细胞凋亡率与空白对照组及溶剂PBS组比较差异有统计学意义(P<0.01)。
3 讨论
皮肤黑素化过程包括黑素细胞增殖、酪氨酸酶合成和活化以及黑素体的转运和降解。酪氨酸酶是皮肤黑素生物合成的主要限速酶。黑素的合成受细胞因子、金属离子、激素等多种因素的调节。黑素细胞的培养在皮肤色素性疾病的研究和治疗中具有重要意义。TNF是一种主要由单核巨噬细胞分泌的细胞因子,影响多种组织和细胞的生长、分化,在免疫应答和炎症反应的不同水平起着重要的调节作用。根据细胞来源和分子结构的不同,TNF可分为TNF-α和TNF-β型。TNF-α即经典的 TNF,主要由细菌脂多糖(LPS)激活的单核巨噬细胞产生。TNF-β即以往的淋巴毒素(lymphotoxin),主要由活化的T细胞产生。TNF-α正常储存于真皮肥大细胞之中[8],但激活的表皮朗格汉斯细胞[9],甚至受到刺激的表皮角质形成细胞也可合成并释放TNF-α[10]。黑素合成与细胞因子间的相互作用已引起学者们的关注。隋连金等学者[11]采用ELISA法测定了白癜风患者血清TNF-α水平,并与正常对照组相比较,结果发现白癜风患者血清T NF-α水平增高,提示其可能参与白癜风发病,并与白癜风的活动有关。曾静等学者[12]采用SABC免疫组化法对18例进展期及20例稳定期白癜风患者皮损处TNF-α及其受体TNFR1进行检测,并以20例正常人作对照,结果发现寻常型进展期白癜风皮损中TNF-α的表达较寻常型稳定期组显著增加,寻常型稳定期白癜风皮损中TNF-α的表达较正常对照组显著增加,患者组与对照组TNFR1无显著性差异,提示TNF-α可能参与寻常型白癜风发病的某一环节。Swope[13]等研究发现IL-1、IL-6及 TNF-α3种细胞因子可抑制培养黑素细胞的酪氨酸酶活性,此外它们还能抑制黑素细胞的生长但无细胞毒性作用,故认为它们可能是阻碍黑素细胞黑素生成的重要因素。本研究建立正常人表皮黑素细胞体外培养体系后,用不同浓度的TNF-α作用于黑素细胞后也发现TNF-α对黑素细胞活力有抑制作用,能使细胞增殖力降低,两者存在明显的浓度和时间效应,浓度越高,抑制率越强,时间越长,抑制率越强,与Swope等[13]的研究一致。本研究还发现TNF-α作为旁分泌的细胞因子,还可导致黑素合成减少,增加黑素细胞的凋亡率。但是TNF-α是通过什么通路和机制达到这些作用还有待进一步的深入研究。
[1]丁国斌,陈璧,汤朝武.不同培养条件及时相对黑素细胞生物学特性的影响[J].中国临床康复,2002,6(24):3665-3666.
[2]唐建兵.黑素细胞的体外培养研究进展及意义[J].中国美容医学,2010,19(8):1244-1246.
[3]Tsuji T,Karasek M.A procedure for the isolation of primary culture of melanocyte from newborn and adult human skin[J].J Invest Dermatol,1983,81(2):179-180.
[4]项蕾红,郑志忠,祝绿川,等.黑素细胞体外纯培养及生物学特性鉴定[J].临床皮肤科杂志,2001,30(3):166-167.
[5]陈菊萍,冉玉平,魏大鹏,等.人黑素细胞培养最佳条件的选择和生物学鉴定[J].中国麻风皮肤病杂志,2007,23(3):214-216.
[6]Mosmann T.Rapid colorimetric assay for celluar growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1-2):55-63.
[7]Boyd MR,Bacon TH,Sutton D,et al .Antiherpesvirus activity of 9-(4-Hydroxy-3-Hydroxy-methylbut-1-yl)guanine(BRL 39123)in cell culture[J].Antimicrob Agents Chemother,1987,31(8):1238-1242.
[8]Gordon JR,Galli SJ.Mast Cells as a source of both preformed and immunologicelly inducible TNF-alpha/cachectin [J].Nature,1990,346(6281):274-276.
[9]Larrick JW,Morhenn V,Chiang YL,et al.Activated langerhans cells release tumor necrosis factor[J].J Leukoc Biol,1989,45(5):429-433.
[10]Kock A,Schwarz T,Kirnbaucr R,et al.Human keratinocytes are a source for tumor necrosis factor alpha:evidence for synthesis and release upon stimulation with endotoxin or ultraviolet light[J].J Exp Med,1990,172(6):1609-1614.
[11]隋连金,戎丽娟,王炜,等.白癜风患者血清相关细胞因子的检测[J].中国麻风皮肤病杂志,2006,22(5):386-388.
[12]曾静,张启国,方春红,等.肿瘤坏死因子-α及其受体在白癜风患者皮损中的表达[J].中国皮肤性病学杂志,2006,20(7):409-410,415.
[13]Swope VB,Abdel-Malek Z,Kssem LM,et al.Interleubins 1 alpha and 6and tumor necrosis factor-alpha are paracrine inhibitors of human melanocyte proliferation and melanogenesis[J].J Invest Dermatol,1991,96(2):180-185.

