牛奶中烟酸本底含量的测定
刘志楠,李海礁,宋晓东,叶峰,喻东威,解鑫
(内蒙古蒙牛乳业(集团)股份有限公司质量安全管理中心分析中心,内蒙古 呼和浩特 011500)
牛奶是天然的全营养物质,其微量元素的含量比较全面。早在1867年人们就在实验室中合成了烟酸,而其真正得到发展是始于20世纪30年代,1937年C.A.Elvehijiem等分离出烟酸,不久又在肝脏中获得烟酞胺[1],一时间作为医药产品得到了迅速发展,新的用途被不断的开发出来,其应用领域筱盖医药、食品、饲料添加剂及化工助剂等行业。烟酸即3—毗吮甲酸,又名尼可丁酸,是结构最简单、理化性质最稳定的一种维生素,是人体和动物中不可缺少的营养成分,它参与组织的氧化还原过程,具有促进细胞新陈代谢和扩张血管的功能,能促进人体和动物的生长发育[2-3]。烟酸不仅参与细胞内呼吸过程而且在VB6、泛酸和生物素的存在下还参与脂肪蛋白质和DNA的合成[4-5],因此烟酸对人体有着重要的生理功能[6]。
关于水溶性维生素的检测,以往文献报道的方法主要包括微生物、高效液相法、酶法和免疫法等[7-8],依据国标的方法,我们采用高效液相色谱法和微生物法对牛奶中的烟酸进行检测。但国内文献对牛奶中烟酸本底含量的相关报道却很少。针对这种现象,我们选取410份中国各地的牛奶样本进行大量的实验,意在得出牛奶中烟酸含量的大致范围,以指导乳制品企业在合理范围内强化烟酸的添加量。本研究参考了AOAC[9]的方法,并使用烟酸检测试剂盒[10]使微生物检测烟酸的方法有较大程度的优化,使检测时间有较大幅度的缩短。
为了评价食品标签上标注成分的准确性。美国食品和药物管理局FDA规定维生素在食品中的实际添加量必须为标签上标注量的100%或更多,而原生维生素产品中的维生素含量必须为标签上标注量80%或更多。European Directive2002/46/EC也制定了一系列法规,用于检测添加过维生素的食品中标注的维生素含量[11]。2010年我国针对乳制品食品安全体系存在的一些列问题作出了相应的规定,出台了最新国家标准作为检测乳品中各种营养素的国家强制性检测标准,国标GB5413-2010[12]《食品安全国家标准婴幼儿食品和乳品中烟酸和烟酰胺的测定》对婴幼儿配方食品与奶粉中维生素含量的检测方法、检测限度、适用范围等都做了明确的规定。作为乳品企业而言,产品必须符合国家的标准才可以出厂,其次了解烟酸的大致范围可以给企业带来新的利润增长点。
牛奶属于动物源性食品,牛奶中烟酸的含量受饲料、季节、环境、种群和牛个体差异的影响较大,所以数据会在一定的范围内浮动。
1 材料与方法
1.1 高效液相色谱法
1.1.1 材料
中国各地的牛奶样本。
1.1.2 试剂及设备
淀粉酶:酶活力≥25 nkat/mg;盐酸;氢氧化钠;盐酸(2.4 mol/L):准确移取10 mL盐酸于50 mL容量瓶中,用水定容;氢氧化钠溶液(2.5 mol/L):称取5.0 g氢氧化钠于50 mL容量瓶中,用水定容;高氯酸(HClO4):体积分数为60%;甲醇(CH4O):色谱纯;异丙醇(C3H8O):色谱纯;庚烷磺酸钠(C7H15NaO3S):优级纯。
U3000高效液相色谱仪(带紫外检测器):美国UltiMate;pH计(精度为0.01,型号为S40+电导率模块)、天平(感量为 0.1 mg,型号为 XS204):瑞士mettler;E100H超声波振荡器:Elmasonic;培养箱(30℃~80℃,型号为Frioce11222):德国MMM。
1.1.3 方法
试样经热水提取、酸性沉淀蛋白质后,以C18色谱柱分离,用紫外检测器定量。
1.1.4 前处理
称取混合均匀固体试样约5.0 g(精确到0.0001 g)加入约25 mL 45℃~50℃的水,或称取混合均匀液体试样约20.0 g(精确到0.0001 g)于150 mL锥形瓶中,振摇,静置5 min~10 min,充分溶解,并冷却至室温。将上述锥形瓶置于超声波振荡器中振荡约10 min。
1.1.5 测定液的制备
待试样溶液降至室温后,用盐酸调节试样溶液的pH至1.7±0.1,放置约2 min后,再用氢氧化钠溶液调节试样溶液的pH至4.5±0.1。将试样溶液转至50 mL容量瓶中,用水反复冲洗锥形瓶,洗液合并于50 mL容量瓶中,用水定容至刻度,混匀后经滤纸过滤,滤液再经0.45 μm微孔滤膜加压过滤,用试管收集,即为试样待测液。
1.1.6 参考色谱条件
色谱柱:C18柱(粒径 5 μm,150 mm×4.6 mm)或具有同等性能的色谱柱。
流动相:甲醇70mL,异丙醇20mL,庚烷磺酸钠1g,用910mL水溶解并混匀后,用高氯酸调pH至2.1±0.1,经0.45 μm膜过滤。
流速:1.0 mL/min。检测波长:261 nm。柱温:25℃。进样量:10 μL。
1.1.7 标准品配制
烟酸及烟酰胺标准储备液(1.0 mg/mL):称取烟酸及烟酰胺标准品各0.1 g(精确到0.0001 g),分别置于100 mL容量瓶中,用水溶解定容。
烟酸及烟酰胺混合标准中间液(40μg/mL):分别准确吸取烟酸及烟酰胺标准储备液2 mL至50 mL定量瓶中,用水定容,临用前配制。烟酸及烟酰胺混合标准系列测定液:分别准确吸取烟酸及烟酰胺混合标准中间液 0.0、1.0、2.0、5.0、10.0 mL,至 50 mL 容量瓶中用水定容。该标准系列浓度分别为0.00、0.80、1.60、4.00、8.00μg/mL。临用前配制。
1.1.8 试样溶液的测定
将试样待测液进行色谱测定。记录各组分色谱峰面积或峰高,根据标准曲线计算出试样待测液中烟酸及烟酰胺各组分的浓度。
1.2 微生物法
1.2.1 材料
中国各地的牛奶样本。
1.2.2 试剂及设备
烟酸检测试剂盒:德国ifp公司;Elx808酶标仪(630 nm):美国Biotek;AIR TECH超净台:苏州安泰公司;微量可调移液器(100μL~1000μL、20μL~200μL):德国 Eppendorf;一次性无菌滤膜(0.2 μm~0.22 μm);5 mL一次性无菌注射器;15 mL无菌离心管;1.5 mL~2.0 mL无菌离心管。
1.2.3 菌种
植物乳酸杆菌 Lactobacillus plantarum(ATCC 8014)。
1.2.4 方法
某些菌体生长对某种特定维生素具有较强的依赖性。配制选择性的培养基,即含有菌体生长除待测维生素以外的所有营养元素,待测维生素添加的多少直接影响菌体的生长情况。通过添加不同浓度的待检测维生素作为标注曲线,就可以半定量判定样品中的特定维生素的含量,最后通过细菌生长的浊度显示出来,因此根据标准曲线法通过测定的浊度来得出样品中的烟酸含量[13]。
1.2.5 前处理
取1 mL样品至50 mL离心管中,准确加入双蒸水39 mL,漩涡混匀。在超净台中用 0.2 μm~0.22 μm 无菌滤膜过滤至1.5 mL~2.0 mL无菌心管中。
1.2.6 培养基制备
加入10 mL无菌水至维生素培养基中,盖好瓶盖,摇匀。在90℃~100℃水浴中加热5 min以上,其间振荡至少2次,迅速冷却至室温(低于30℃)。使用0.2 μm~0.22 μm无菌滤膜过滤培养基至15 mL无菌离心管中。
1.2.7 标准品配制
烟酸标准品用无菌水配置成不同的浓度梯度(0、0.016、0.032、0.064、0.096、0.160 mg/100 g),在 630 nm处测定吸光度,以吸光度为纵坐标,标品浓度为横坐标,绘制标准曲线。
1.2.8 检测步骤
将菌体包被于微孔中,取出需要数量的微孔板条并在板上固定,未使用的微孔板条立即放回原来的箔袋中,并与干燥剂一起重新封好,储存在2℃~8℃条件下;用移液器吸取150 μL待检维生素培养基至微孔中;用移液器吸取150 μL标准品或样品至指定的微孔中;用粘合箔盖住微孔条或微孔;在(37±1)℃黑暗条件下孵育44 h~48 h。
1.2.9 测量及计算
将微孔板漩涡混匀,用酶标仪630 nm条件下读取浊度。使用维生素专用软件进行计算(4P法)。
2 结果
2.1 烟酸标准曲线和色谱图
微生物法烟酸标准曲线,见图1;高效液相色谱法,见图2。
图1微生物法标准曲线相关系数均为1.000,效果较好。图2高效液相色谱法标准品峰值和峰形较好。
2.2 不同方法检测烟酸数据对比情况
选取10组样本进行对比试验,微生物法和高效液相色谱法检测牛奶中烟酸的STD、RSD和CV值的统计结果见表1。
表1结果显示:微生物法和高效液相色谱法检测牛奶中烟酸数值的CV值都在10%的范围内,相当于国标要求的检测2个平行样品之间的数值要求范围,可见2种方法的结果是一致的,因此我们可以采用一种方法(微生物法)进行大量样本的检测。

图1 微生物法烟酸标准曲线Fig.1 Microbiological assay of nicotinic acid standard curve

图2 高效液相色谱法Fig.2 HPLC method
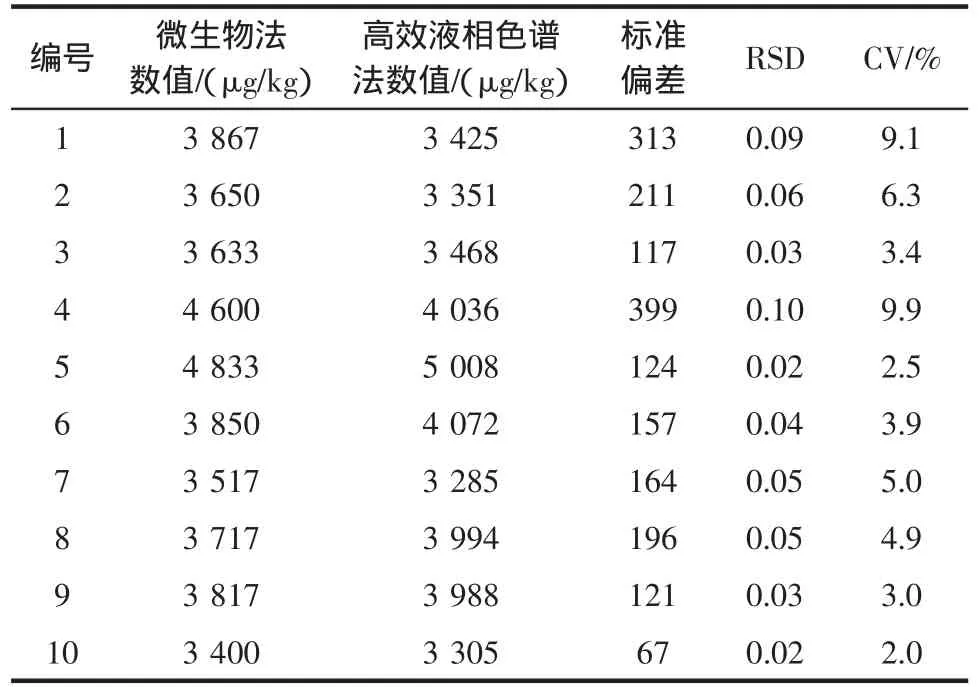
表1 不同方法检测烟酸的统计数值Table 1 Different methods for the detection of niacin statistics
2.3 烟酸回收率的测定
选取的20组样本作回收率抽样统计,结果见表2。
由表2可见,微生物法回收率在79.5%~112.5%之间,检测的结果符合回收率的要求。
2.4 烟酸相对标准偏差的测定
选取的20组样本,同一样品做平行样检测,相对标准偏差抽样统计结果见表3。

表2 烟酸回收率的测定结果Table 2 Nicotinic acid recovery measurement results

表3 烟酸相对标准偏差的测定结果Table 3 Nicotinic acid and relative standard deviations of deter mination results
由表3可见:微生物法检测相对标准偏差在2.4%~9.9%之间,检测的结果较好。
2.5 烟酸大量数据的测定
烟酸大量数据的测定,见表4;烟酸的测定范围和烟酸含量正态分布图,见图3和图4。

表4 烟酸大量数据的测定结果Table 4 Results of determination of niacin to large amounts of data

图3 烟酸的测定范围Fig.3 Determination of niacin range

图4 烟酸含量正态分布图Fig.4 Nicotinic acid content of normal distribution
由表4、图3和图4可见:410组烟酸数据平均值为 87μg/100 mL,数据范围在 36μg/100 mL~138μg/100mL。牛奶中烟酸含量大部分在70μg/100mL~120μg/100 mL之间。
3 结论与讨论
实验结果显示:微生物法和高效液相色谱法的检测结果一致。另对微生物法检测烟酸的标准曲线相关系数、回收率和相对标准偏差进行统计,检测结果都很好,另外高效液相色谱法因其检测速度较慢、成本较高,所以我们采用微生物法进行大量样本的测定。
微生物法对410组牛奶样本进行统计分析结果显示:烟酸平均值为87μg/100 mL,数据范围在36μg/100 mL~138μg/100 mL之间。牛奶中烟酸含量大部分在 70μg/100 mL~120μg/100 mL 之间。
烟酸性质比较稳定,在没有菌体污染的情况下损失较少。作为乳制品企业可以根据牛奶中烟酸的本底含量,适量添加烟酸即可以达到要求。
[1]李钟玉,李临生.烟酸、烟酸胺的研究进展[J].化工时刊,2003,17(2):6-9
[2]王利民.烟酸的合成[J].哈尔滨工程大学,2003(3):1-10
[3]聂勇.烟酸、烟酞胺的生产及市场概述[J].吉林石油化工,1994(4):32-37
[4]陈丙卿.营养与食品卫生学[M].北京:人民卫生出版社,2000(4):91-105
[5]鲁长豪.食品理化检验学[M].北京:人民卫生出版社,1993:105-119
[6]中国预防医学科学院标准处.食品卫生国家标准汇编(2)[M].北京:中国标准出版社,2002:302-306
[7]Jorg A,Klein BP,Becker D,et al.Biot in method of vita min assay[J].4th edi.USA:John Wiley&Sons Inc,1985(9):507-543
[8]左景善,张丽娟.高效液相色谱法测定婴儿奶粉中的泛酸[J].营养学报,1988,10(3):281-285
[9]Angyal G.Methods for microbiological analysis of sel ected nutrients[M].USA:AOAC Int ebnational,1996:41-45
[10]廖冰军,左成丽.B族维生素检测方法及其使用[J].食品安全导刊,2009(8):40-41
[11]雷涛,张辉,韩惠雯,等.婴幼儿配方奶粉中水溶性维生素的检测方法研究[J].乳业科学与技术,2004(2):81
[12]中华人民共和国卫生部.GB 5413.15-2010食品安全国家标准婴幼儿食品和乳品中烟酸和烟酰胺的测定[S].北京:中国标准出版社,2010:1-8
[13]王弘,陈彦红,周玲仙.48种云南特有食物营养成分中烟酸的测定[J].食品科学,2000,21(11):53-54

