黄芪提取液对大肠杆菌抑菌特性研究
毛森军,霍健聪
(浙江海洋学院普陀科技学院,浙江 舟山 316000)
大肠杆菌是引起食物中毒的主要微生物之一,是食品微生物必检指标。据舟山市水产品加工出口协会有关数据显示:舟山市每年出口水产品中由于大肠杆菌超标而造成的经济损失高达数百万美元。目前使用防腐剂仍是解决包括大肠杆菌在内的食品微生物超标的主要手段之一,但因苯甲酸(钠)等化学防腐剂食品安全性不断受到质疑,欧盟等国家和地区对化学防腐剂的使用和检测越来越严格,开发新型食品防腐剂成为必然。天然防腐剂由于其安全性高不断受到关注,更成为近年来的研究热点。近20年来,国内外对于天然防腐剂的研究主要集中于植物多糖、香辛料(植物源)或抗菌肽(动物源)等,但是动物源生物防腐剂普遍存在提取条件苛刻、提取成本高、抗菌谱窄、带有异味、价格偏高等缺陷,导致其实际应用极为有限[1-3]。结合我国拥有丰富的植物资源这一得天独厚的条件,开发生物天然防腐剂成为今后防腐剂发展的主要方向。
黄芪(Astragalus mongholicus)又称黄耆,是我国传统补益中药,为豆科植物蒙古黄芪或膜荚黄芪的干燥根[4]。《中国药典》中记载:黄芪有益气固表、敛汗固脱、托疮生肌、利水消肿之功效,有增强机体免疫功能、保肝、利尿、抗衰老、抗应激、降压和较广泛的抗菌作用。本研究旨在通过对黄芪提取液抑菌效果研究和抑菌特性研究,开发天然防腐剂,为黄芪开辟综合利用新途径。
1 材料与方法
1.1 供实菌种
大肠杆菌(Escherichia coli):购于中国工业微生物菌种保藏中心;黄芪:购于舟山市存德堂大药房;培养基制备:称取牛肉膏3.0 g,蛋白胨10.0 g,氯化钠5.0 g,琼脂20.0 g,水1000 mL,加热融化后调节pH到7.4~7.6,分装后在121℃条件下灭菌20 min,备用(液体培养基不加琼脂)。
1.2 黄芪提取液原液的制备
参考蒋益虹等方法,做适量改进[5]。取适量黄芪,切碎后置于旋转蒸发仪内,加入20倍质量的水,减压后保持微沸状态下浸提、浓缩,得到黄芪提取液原液,即1 mL提取液中含有1 g黄芪。
1.3 实验菌液的制备
将保藏菌种的安瓿瓶用75%医用酒精擦拭后在火焰上加热数秒钟,用灭菌滴灌吸取无菌去离子水滴加至安瓿瓶颈部,使其炸裂,用无菌移液管吸取0.5 mL适宜的液体培养基滴入安瓿瓶内,振荡将悬浮菌液注入适宜的液体培养基内,在37℃下培养24 h,作为种子菌悬液。二次活化的实验菌种斜面培养24 h后,挑取一单菌落接种到100 mL液体培养基中,培养24 h后进行平板菌落计数,以无菌水进行梯度稀释,同时记录每一浓度梯度菌悬液吸光值OD,根据OD值和菌悬液浓度关系绘制标准曲线,将菌悬液浓度调整为107cfu/mL左右。
1.4 抑菌效果实验[6]
1.4.1 最低抑菌浓度(MIC)测定
将黄芪提取液用培养基稀释成梯度浓度,每个浓度重复2次,同时进行空白实验。在含有不同浓度提取液的培养基中加入0.1 mL菌悬液,混匀后置于37℃培养箱中培养24 h,按照平板菌落计数法计算,并按下式计算抑菌率。
抑菌率/%=(对照实验菌落数-相应浓度培养基菌落数)×100%/对照实验菌落数
1.4.2 pH对黄芪提取液抑菌活性的影响
采用0.5%NaOH和1%HCl调节培养基酸度,设置 5、6、7、8、9 共 5 个梯度,加入低于 MIC 一个数量级浓度的提取液,再加入0.1 mL菌悬液,以无菌水作为对照,培养24 h后计数。
1.4.3 温度对黄芪提取液抑菌活性的影响
取低于MIC一个数量级浓度的黄芪提取液分别置于 60、80、100℃水浴和 121℃条件下处理 20、15、10、5 min,然后立刻取出置于冰箱中冷却,加入0.1 mL浓度为107cfu/mL的菌悬液,于37℃培养箱中培养15 h后平板计数,探讨温度对黄芪提取液抑菌活性的影响。以无菌水作用对照。
1.4.4 金属离子对黄芪提取液抑菌活性的影响
分别选用食品中常见的NaCl和CaCl2配成0.1mol/L和0.05 mol/L培养基溶液,加入低于MIC一个数量级浓度的提取液,加入0.1 mL浓度为107cfu/mL的菌悬液,于37℃培养箱中培养15 h后平板计数并计算抑菌率,以无菌水做对照,探讨金属离子对黄芪提取液抑菌活性的影响。
2 结果与讨论
2.1 黄芪提取液最低抑菌浓度MIC
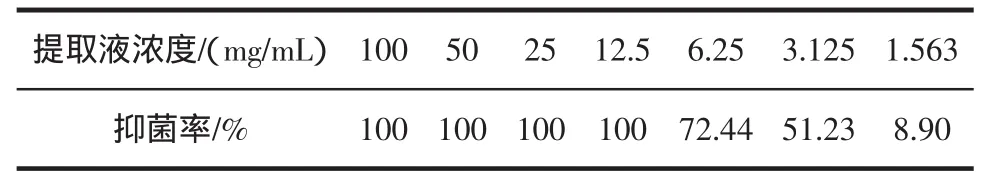
表1 不同浓度黄芪提取液的抑菌率Table 1 Antibacterial rate of different concentration of Astragalus mongholicus
从表1可以看出,黄芪提取液对大肠杆菌具有较强的抑菌效果。随着抑菌浓度的增加,抑菌率显著提高,其中当提取液浓度稀释6次后,浓度比1∶64,即提取液浓度为1.563 mg/mL时抑菌率仅为8.90%,而提取液浓度为6.25 mg/mL时抑菌率高达72.44%,高于该浓度提取液抑菌率达100%。这表明黄芪提取液最低抑菌浓度MIC为12.5 mg/mL,表明黄芪提取液在较低浓度下有较强的抑菌活性。
2.2 pH对黄芪提取液抑菌活性的影响
图1是不同pH对黄芪提取液抑菌活性的影响。
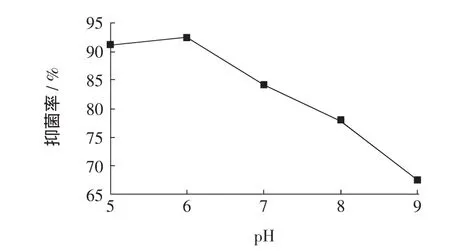
图1 不同pH对黄芪提取液抑菌活性的影响Fig.1 Effect of pH of Astragalus mongholicusn extract
从图1中可以看出,不同pH对黄芪提取液抑菌活性影响较大,酸性条件下提取液抑菌活性较高,均达到85%以上;而中性及碱性条件下黄芪提取液抑菌活性显著降低,pH越高则抑菌活性越低。这表明黄芪提取液在酸性条件下对大肠杆菌抑菌活性显著高于碱性条件。这可能是由于黄芪提取液中含有多种具有抑菌活性的有机酸,因而在碱性条件下抑菌活性较弱。黄芪的有机酸主要有香草酸、阿魏酸、异阿魏酸、对羟苯基丙烯酸、咖啡酸、绿原酸及棕榈酸[7]。黄芪抑菌主要依赖自身有机酸创造的酸性条件实现,创造pH低于4的环境,使得大多数致病菌难以存活。黄芪总酸度仅是抑菌作用的一方面,可能还与其他化学成分有关,如黄酮类、胡萝卜苷(daucostero1)、叶酸(folicacid)、β-谷甾醇(β-sitostero1)等。
2.3 温度对黄芪提取液抑菌活性的影响
温度对黄芪提取液抑菌活性的影响见图2。
从图2可以看出,黄芪提取液在不同温度条件下处理不同时间后仍就有较强的抑菌活性,其中提取液经100℃和121℃处理后,抑菌率有所降低,但仍然达到85%以上;而随着处理温度的下降,抑菌率明显上升,其中60℃处理抑菌率为85.76%,只比空白实验低8个百分点。这表明黄芪提取液热较为稳定,具有较好的热稳定性。这为黄芪提取液在食品工业中的应用奠定了良好的理化基础,可将其应用于巴氏杀菌的食品生产中。

图2 不同温度对提取液抑菌活性的影响Fig.2 Effect of temperature on antibacterial activity of Astragalus mongholicusn
2.4 金属离子对黄芪提取液抑菌活性的影响
食品中大多含有钠离子和钙离子,为了探讨黄芪提取液能否广泛应用在食品中,本文研究了其提取液在氯化钠和氯化钙体系中的抑菌活性,见图3。

图3 不同金属离子对提取液抑菌活性的影响Fig.3 Effect of metal on antibacterial activity of Astragalus mongholicusn extract
由图3可知,氯化钠和氯化钙对提取液抑菌活性影响差异较大,其中氯化钠在所选取的两个浓度条件下对提取液抑菌活性基本无影响,抑菌率均在90%左右;而氯化钙对提取液抑菌活性影响显著,同等浓度下抑菌活性显著小于氯化钠,且对抑菌活性的影响随浓度增大而增强,在高浓度条件下抑菌活性仅为46.23%。这可能是由于钙离子易与多种有机酸结合形成不溶性钙盐,如柠檬酸钙、酒石酸钙等,造成环境pH上升,抑菌活性降低。
2.5 室温下放置时间对黄芪提取液抑菌活性的影响
前人研究资料显示:在探讨天然防腐剂抑菌效果时通常目的产物经制备后直接测定其抑菌活性,而不探讨环境对其抑菌活性的影响。到目前为止尚未见到天然防腐剂敞露于环境状态下对其抑菌效果影响的研究,仅有蓝江林从美洲大蠊中诱导、分离纯化抗菌肽,经室温下暴露放置不同时间后检测其抑菌活性发现,抗菌肽抑菌活性仅能维持3 d,5 d后仅有微弱抑菌活性,而抑菌活性于6 d后完全丧失[8]。由于前人对天然防腐剂的研究多集中于蛋白肽类或多糖类,而此类天然防腐剂防腐效果从长时间看较差,时间长后反而可促进微生物的生长,这也成为此类天然防腐剂应用于食品工业的显著弊端之一。
黄芪提取液室内暴露与空气中放置不同时间后抑菌效果见图4。

图4 放置时间对黄芪提取物液抑菌活性的影响Fig.4 Effect of laytime on antibacterial activity of Astragalus mongholicusn extract
从图4中可以看出,放置时间对提取液抑菌活性影响极大,短时间放置对抑菌活性基本无影响,表现在放置2 d、4 d时,抑菌活性接近90%,而随着放置时间的延长,抑菌活性显著降低,放置8 d时,抑菌率仅为25%,抑菌活性基本消失殆尽。实验中也发现放置8 d后提取液表面漂浮有菌落,表明提取液已被环境中的微生物污染,抑菌活性消失殆尽。这也提示黄芪提取液如要用于食品保藏,最好通过喷雾干燥等方式制成固体形式保存和应用。
3 结论
开发安全性高、防腐效果好的天然防腐剂已经成为今后食品防腐剂的重要发展方向。黄芪是我国特产之一,具有多种生理功效。从本研究实验结果来看,黄芪提取液具有良好的抑菌活性,其最低抑菌浓度为12.5 mg/mL,在酸性条件下提取液具有较高的抑菌活性,提取液对温度较为稳定,适用于采用巴氏杀菌的食品当中,黄芪提取液对钠离子适应性好,而钙离子可显著降低其抑菌活性。综上所述,黄芪提取液对大肠杆菌具有较好的抑制效果,可作为天然食品防腐剂应用于食品当中,具有广阔的开发前景。
[1]Valero M,Salmeron M C.Antibacterial activity of 11 essential oils against Bacillus cereus in tyndallized carrot broth[J].International journal of food microbiology,2003(85):73-81
[2]Adegoke G O,Odesola B A.Storage of maize and cowpea and inhibition of microbial agents of biodeterioration using the powder and essential oil of lemon grass(Cymbopogon citrates)[J].International bioderioration&biodegration,1996(1):81-84
[3]吴传茂,吴周和,曾莹,等.从植物中提取天然防腐剂的研究[J].食品科学,2000,21(9):24-27
[4]聂江力,丛沛桐,祖元刚,等.用人工智能计算技术估测东北地区北五味子果实资源量[J].植物研究,2003(2):24-26
[5]蒋益虹.荷叶抑菌有效成分的提取优化工艺研究[J].中国中药杂志,2005,30(13):1030-1031
[6]张文治.新编食品微生物学[M].北京:中国轻工业出版社,1995:122-125
[7]王艳芳,鲍建材,郑友兰,等.黄芪的研究概况[J].人参研究,2002,16(1):10-16
[8]蓝江林.美洲大蠊(Periplaneta Americana L.)抗菌肽的研究[D].福州:福建农林大学,2003:53-57

