玉米超氧化物歧化酶的提取与纯化工艺
刘杰凤,张峰培,杜丽明
(广东石油化工学院生物工程系,广东 茂名 525000)
超氧化物歧化酶 (superoxide dismutase,SOD;EC1.15.1.1)广泛存在于动植物及微生物体内,可催化细胞内超氧负离子(O2-·)的歧化反应,使O2-·转化为H2O2和O2,是一种能清除体内超氧自由基的金属酶[1]。对SOD的生理功能研究表明,SOD具有抗脂质氧化、抗衰老、抗辐射和消炎的作用,是一种新型的药用酶及功能性酶,在医药、食品、化妆品等领域有着广阔的应用前景[2-4]。目前,SOD制品主要从动物血液或肝脏中获得,但是其应用存在安全性问题,而且杂蛋白含量高,人们正逐渐转向通过微生物发酵和从植物细胞中提取。已有的研究表明,有些植物的细胞质溶质及叶绿体中富含SOD,如芦荟、大蒜、玉米等[5-7]。尤其是玉米胚和胚乳中富含SOD,是一种具营养和保健作用的主要粮食作物,而且在我国广泛种植,产量高。在玉米的深加工前,如饲料复配、淀粉制备、乙醇发酵等,进行玉米SOD的提取,是提高玉米利用率,增加玉米深加工产品种类,深化玉米资源综合利用的有效途径。因此,工业化规模开发植物源SOD,玉米是最有潜力的资源之一。本文对玉米SOD提取工艺进行了优化试验,目的是找寻安全性能高、提取工艺简单、提取效率高、成本低的SOD生产工艺。
1 仪器、材料与方法
1.1 主要材料与试剂
糯玉米:茂名官渡市场购买;邻苯三酚(分析纯)、硫酸铵:天津市大茂化学试剂厂;考马斯亮蓝G-250、DEAE-纤维素、N-N’-亚甲基双丙烯酰胺:北京鼎国生物技术有限公司;标准牛血清白蛋白、丙烯酰胺(分析纯):上海凌峰化学试剂有限公司。
1.2 主要仪器设备
TU1810紫外-可见分光光度计:北京普通分析仪器厂;TGL-20M高速冷冻离心机:湖南赛特湘仪离心机仪器有限公司;PHS-3C酸度计:上海精密仪器有限公司;DYY-11型电泳仪:北京六一仪器厂。
1.3 玉米SOD的提取及纯化
1.3.1 SOD粗酶液的提取工艺
按一定料液比在100 g玉米中加入0.05 mol/L磷酸缓冲液(pH7.8),28℃浸泡若干小时,淋干。匀浆机粉碎后,再以磷酸缓冲液30℃浸提1 h,4℃,5000 r/min离心15 min,得玉米SOD粗酶提取液,并对粗酶液进行分析。
1.3.2 沉淀分离
1.3.2.1 热变性
粗酶液于50℃~60℃水浴10 min~15 min,冷却,5000 r/min离心15 min,弃沉淀。
1.3.2.2 氯仿-乙醇混合液沉淀
取一定体积的粗酶液,加入0.25倍体积的冷氯仿-乙醇混合液(体积比为3∶5),冰水浴中搅拌15 min后,4℃,5000 r/min离心15 min,去除杂蛋白沉淀,上清液静置分层,弃下层液体,得上层酶液。
1.3.2.3 丙酮沉淀SOD
粗酶液置于冰浴中,缓慢加入4℃预冷的丙酮,搅拌10 min。5000 r/min、4℃冷冻离心15 min,弃上清,沉淀以50 mmol/L,pH7.8的磷酸缓冲液溶解。
1.3.3 DEAE-纤维素柱层析
粗产品用少量的磷酸缓冲液溶解后,通过预先经过pH7.8的2.5 mmol/L磷酸缓冲液平衡的DEAE-纤维素层析柱(2.0 cm×30 cm),选用 2.5 mmol/L,pH7.8的起始缓冲液进行杂蛋白的洗脱,流速控制在1.2mL/min,直至没有杂蛋白为止(OD280nm吸光值低于0.1)(约1 h)。然后用2.5 mmol/L~50 mmol/L的pH7.8磷酸缓冲液进行梯度洗脱,每管收集9 mL,收集40管,测定各管蛋白含量及酶活,合并活力峰。
1.3.4 SDS-聚丙烯酰胺(SDS-PAGE)凝胶电泳
柱层析纯化的酶液经冷丙酮沉淀,冷冻离心后,用磷酸缓冲液溶解,采用质量分数为10%的分离胶和5%的浓缩胶进行SDS-PAGE电泳,加样量20 μL,用考马斯亮蓝R-250染色。
1.4 测定方法
1.4.1 蛋白质含量及紫外吸收光谱的测定
采用考马斯亮蓝G-250染色法测定SOD蛋白浓度,以标准牛血清白蛋白绘制标准曲线,以A599为纵坐标,蛋白质含量(μg/mL)为横坐标作图,得回归方程为:y=0.0075x+0.0146,R2=0.994。
采用TU1810紫外分光光度计对SOD进行光谱扫描(范围:200 nm~360 nm)。
1.4.2 酶活性的测定及酶活定义
改良的邻苯三酚自氧化法测定酶活[8]。酶活性单位采用1 mL反应液中每分钟抑制邻苯三酚自氧化速度达50%时的酶量定义为一个活力单位(U),以U/mL表示。
2 结果与讨论
2.1 玉米SOD粗酶液最佳提取条件的确定
2.1.1 SOD浸泡诱导和浸提过程磷酸缓冲液用量的选择
SOD在萌发的植物种子中含量最高,所以对种子进行浸泡诱导是获得SOD高收率的关键[8]。植物SOD多数为酸性酶,因而浸提常在中性或弱碱性体系中进行,常用的缓冲液有磷酸盐或Tris-HCl缓冲体系,本实验选用pH7.8、0.05 mol/L的磷酸氢二钠-磷酸二氢钠缓冲液(以下同)。固定玉米用量,分别改变浸泡和浸提的磷酸缓冲液用量,采用邻苯三酚法测定提取液中酶活力,考察了原料与磷酸盐缓冲液不同配比对SOD诱导及浸提效果的影响,结果见图1。
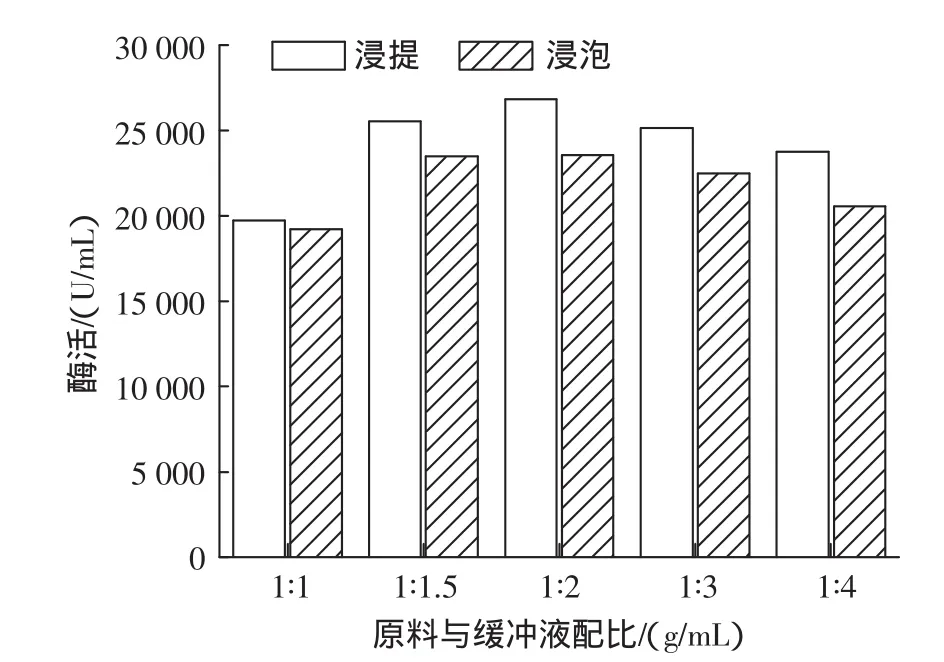
图1 磷酸缓冲液用量对SOD的诱导及浸提的影响Fig.1 Effect of phosphoric acid buffer solution dosage on induction and digestion of SOD
由图1可见,对SOD的浸泡诱导来说,缓冲液过少,浸泡不充分,浸泡液量过多,可能是由于氧的不足影响玉米呼吸从而使SOD活性降低,当玉米与磷酸缓冲液的配比为1∶1.5~1∶3时,均能得到较好的浸泡效果。而对于浸提来说,玉米与磷酸缓冲液的最佳配比为 1∶2(g/mL)。
2.1.2 诱导与浸提时间的确定
考察了不同浸泡诱导和浸提时间对SOD酶活力的影响,结果见图2。
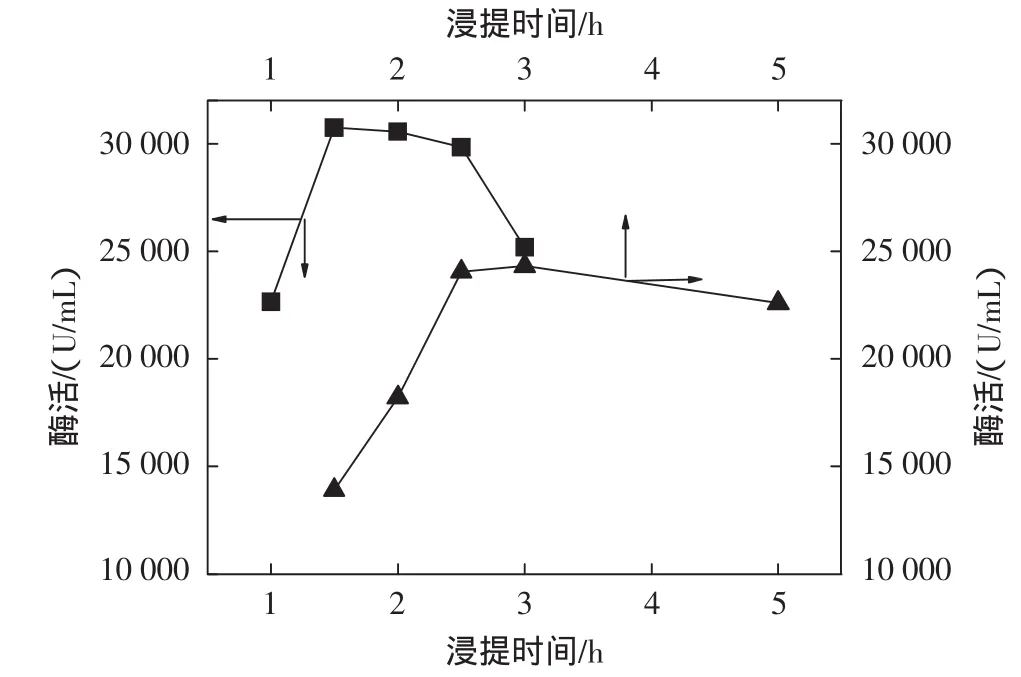
图2 浸提时间对SOD酶活性的影响Fig.2 Effect of digestion time on SOD activity
由图2可见,最佳浸泡时间为25 h~30 h,这段时间为玉米种子开始萌发阶段,大量的SOD已合成,而最佳浸提取时间为1.5 h时,此时得到的SOD酶活力最高。
2.2 SOD沉淀分离工艺研究
SOD酶是金属酶,对热稳定性较高。在SOD的初步分离纯化中,常用热变性、氯仿-乙醇混合物或饱和度为50%以下的硫酸铵盐析等方法去除杂蛋白,而采用丙酮、聚乙二醇或饱和度为70%~90%的硫酸铵盐析法沉淀SOD。使用盐析法的最大优点是安全无毒,缺点是后续需增加透析除盐工艺,而且玉米中蛋白含量低,而SOD在水中的溶解度大,所用硫酸铵的量较大,而且沉淀分辩率较低。本实验采用丙酮沉淀SOD,比较了热变性与氯仿-乙醇混合物除杂蛋白对沉淀分离SOD效果的影响,不同的纯化方法及分离结果见表1。
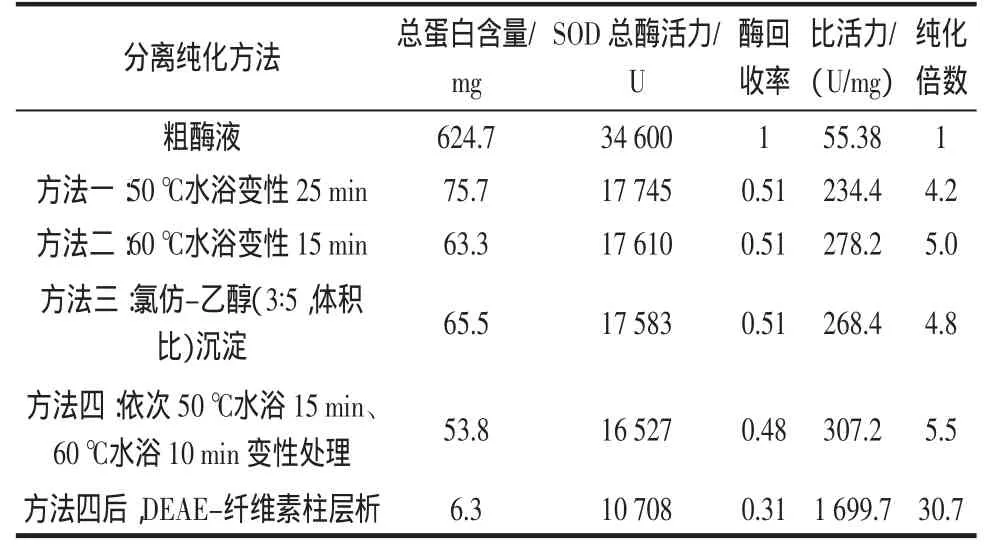
表1 沉淀分离工艺对SOD纯化效果的影响Table 1 Effect of precipitation technology on purification of SOD
由表1可见,方法一除去了88%的杂蛋白,方法二除去了90%的杂蛋白,当变性温度升至60℃时,热变性除杂蛋白的效果将优于有机溶剂氯仿-乙醇沉淀法。当变性温度升至60℃时,热变性除杂蛋白的效果与有机溶剂氯仿-乙醇沉淀法相当。采用两次热变性沉淀杂蛋白,SOD的酶活力只损失6%,而总蛋白下降了17%,比酶活力提高了14%。可见,方法四是一种较好的纯化方法。
2.3 DEAE-纤维素离子交换柱层析
由纯化方法四所得沉淀用少量缓冲液溶解后,进行DEAE-纤维素柱层析,并测定层析收集到的40管酶液的蛋白质含量及酶活力,以试管编号为横坐标,吸光值为纵坐标作图,见图3。
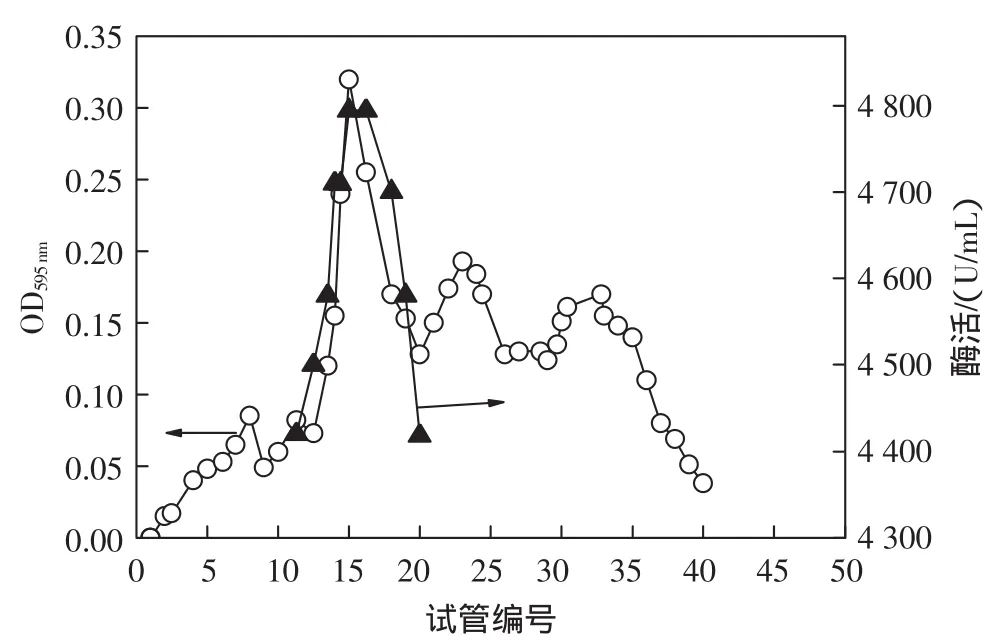
图3 DEAE-纤维素纯化玉米SOD蛋白质及酶活力曲线Fig.3 The protein and activity curves of corn SOD by DEAE-cellulase column
由图3可见,在蛋白质分开的3峰中,第1个峰与SOD的活力峰基本重叠,即为玉米SOD的蛋白峰。磷酸缓冲液的浓度约为收集SOD活性峰出现的第11管至20管洗脱液,约为30mmol/L~40mmol/L。经DEAE-纤维素层析纯化后的酶活见表1。
2.4 玉米SOD的紫外吸收光谱
将经DEAE-纤维素离子交换柱分离纯化后的SOD磷酸缓冲液在紫外区(200 nm~340 nm)范围内进行吸收光谱扫描,结果见图4。
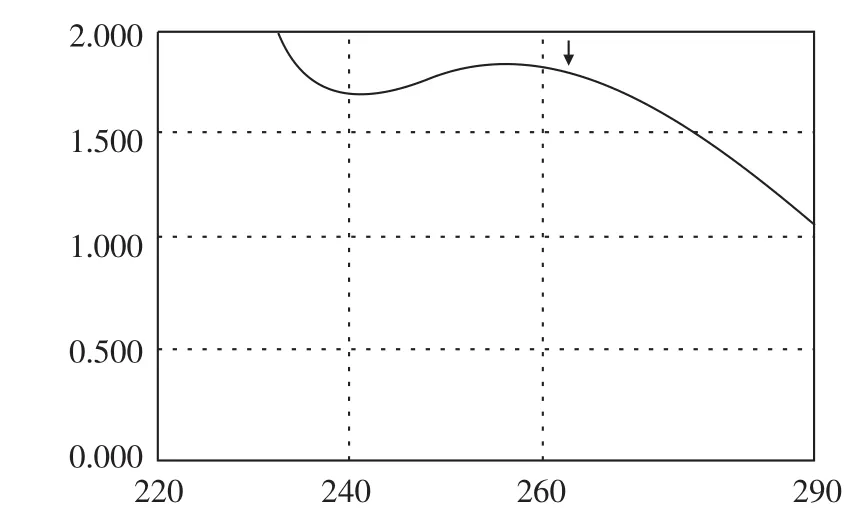
图4 玉米SOD的紫外吸收光谱Fig.4 Ultraviolet absorption spectrum of corn SOD
由于Cu·Zn-SOD含色氨酸或酪氨酸较少,而酪氨酸和色氨酸的最大吸收波长分别为275 nm和280 nm,所以SOD的紫外吸收特征有别于一般蛋白质。图4表明,玉米SOD在紫外区的最大吸收峰在260 nm处,这与文献报道的不同来源的Cu·Zn-SOD紫外吸收(255nm~270 nm)相一致[9]。
2.5 玉米SOD纯度的鉴定
采用SDS-PAGE电泳鉴定玉米SOD的纯度,将经上述各步分离所得蛋白质样品在同一凝胶上进行SDS-PAGE电泳,结果见图5。

图5 玉米SOD SDS-PAGE电泳谱图Fig.5 Picture of SDS-PAGE electrophoresis of corn SOD
由图5可见,随着分离的进行,蛋白条带越来越少,经DEAE-纤维素柱层析后,提取酶液只剩一条电泳带,Cu·Zn-SOD由两个分子量接近的亚基组成,说明纯化的玉米SOD己达到电泳纯。
3 结论
探讨了玉米超氧化物岐化酶(SOD)提取与纯化工艺条件,结果表明:一定量pH7.8、0.05 mol/L的磷酸缓冲液浸泡对玉米SOD的生成有一定的诱导作用,最佳诱导和浸提的原料与缓冲液配比分别为1∶1.5~1∶3、1∶2,最佳诱导和浸提时间分别为25 h~30 h和1.5 h。采用50、60℃两次热变性除杂蛋白,丙酮沉淀SOD得到的酶液纯度最好,比活力高,而且安全无毒。
沉淀分离的SOD酶经DEAE-纤维素柱层析纯化后,比酶活达到1699.7 U/mg,纯化倍数为30.7,酶的回收率为31%。SDS-PAGE电泳表明,纯化的玉米SOD己达电泳纯。
紫外光谱扫描结果表明,玉米SOD紫外区的吸收峰在260 nm处,而不在280 nm,表明其是含酪氨酸和色氨酸较少的Cu·Zn-SOD。
[1]Raziye ztürkrek,Leman Tarhan.Purification and characterization of superoxide dismutase from chicken liver[J].Comparative biochemistry and physiology PartB,2001,128:205-212
[2]蒋一茵,钱燕,胡良冈,等.丹参提取物和超氧化物歧化酶对新生大鼠高氧肺损伤的防治作用[J].中国新生儿科杂志,2008,23(5):283-286
[3]于平.超氧化物歧化酶研究进展[J].微生物学通报,2006,41(1):4-5
[4]郑新,程安威,白景香,等.人SOD1基因在大鼠血管平滑肌细胞的表达及对抗氧自由基损伤的作用[J].生理学报,1999,51(2):199-205
[5]宋小青,赵晓瑜,刘建荣,等.玉米SOD的分离纯化与部分性质研究[J].中国生化药物杂志,2008,28(4):260-262
[6]王晶冰,刘建国,崔占峰.超滤法提取大蒜超氧化物歧化酶的工艺研究[J].现代化工,2009,29(增刊1):320-324
[7]董长颖,张巧.三种芦荟超氧化物歧化酶的活性测定[J].北方园艺,2009(5):97-99
[8]张宏,谭竹钧.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较[J].内蒙古大学学报:自然科学版,2002,33(6):677-681
[9]刘婷婷,王海灵,张艳荣.玉米超氧化物歧化酶超声波提取技术的研究[J],食品科学,2007,28(8):156-160

