猪肝超氧化物歧化酶的分离纯化与初步表征
肖厚荣,杨红,王中风,翟伟华
(合肥学院生物与环境工程系,安徽 合肥 230022)
超氧化物歧化酶(Superoxide dismutase,SOD,EC 1.15.1.1)是一类广泛存在于生物体内的金属酶,由Mann和Keilin于1938年首次从牛红细胞中分离得到,为一种蓝色含铜蛋白质。1969年McCord和Fridovich发现该蛋白具有催化O2-·发生歧化反应的功能,故将此酶命名为超氧化物歧化酶[1]。其主要作用是清除超氧阴离子自由基(O2-·)[2],是一种具有抗氧化、抗衰老、抗肿瘤、抗辐射和消炎作用的药用酶[3],在食品、医药、保健品、化妆品等领域有着广泛的应用[4-7]。
动物SOD研究主要集中在肝脏和血液,植物SOD则主要集中在仙人掌和烟草等。目前,已建立了从动物血红细胞中分离纯化SOD的多种方法[8-10],然而,从动物肝脏中提取SOD的技术尚在探讨中。本试验以猪肝为原料提取SOD,并对工艺技术参数进行优化,参考有关文献[11-14],运用多重线性回归的方法研究多个自变量与蛋白的比活力是否存在某种线性关系或非线性关系,建立多重回归方程;同时对纯化获得的SOD进行了初步表征。
1 材料与方法
1.1 材料
猪肝:购自安徽省合肥市黄山路菜市场。
1.2 试剂与仪器
1.2.1 试剂
磷酸二氢钠、磷酸氢二钠:天津市化学试剂三厂;磷酸氢二钾:上海恒信化学试剂有限公司;磷酸二氢钾:广东西陇化工厂;盐酸:上海苏懿化学试剂有限公司;邻苯三酚、三羟甲基氨基甲烷:Tris,BR,国药集团化学试剂有限公司;十二烷基磺酸钠(SDS):上海生化所申华生化公司,以上试剂均为分析纯。
1.2.2 仪器
JJ-2组织捣碎匀浆机:常州国华电器有限公司;电子天平:北京赛多利斯仪器系统有限公司;20000转式离心机:德国进口;BSZ-160型自动部分收集器、HL-Z恒流泵:上海泸西分析仪器厂;Z型系列层析柱:上海锦华实验器械厂;Libra S22型紫外分光光度计:英国 Biochrom;Agilent1100液相色谱系统:Agilent,USA;Aeomscan Advantage电感耦合等离子体-原子发射光谱仪(ICP-AES):Thermo Jarrell Ash Corporation,USA。
1.3 方法
1.3.1 SOD的酶活力及蛋白质含量的测定
1.3.1.1 测定酶活时邻苯三酚用量的确定
在10 mL试管中加入4.50 mL Na2HPO4-NaH2PO4缓冲溶液(50 mmol/L,pH 8.3),在(25±0.5)℃的恒温水浴中保温10 min,然后加入50 mmol/L邻苯三酚溶液(25±0.5)℃(空白管用10mmol/LHCl代替),迅速摇匀倒入1 cm比色皿中,以空白管为参比,在325 nm下,每隔30s测1次吸光度值,连续记录3min。调节邻苯三酚溶液用量,将其自氧化速率控制在0.070(±0.002)D/min,此值即为测酶活时邻苯三酚溶液的用量。
1.3.1.2 SOD酶活力的测定
酶活力单位定义:在25℃恒温条件下,每毫升反应液中,每分钟抑制邻苯三酚自氧化率达50%的酶量定义为1个酶活力单位。
如上步骤,加入邻苯三酚溶液(25±0.5)℃9 μL(空白管用10 mmol/L HCl代替),迅速摇匀倒入1 cm比色杯中,以空白管为参比,在325 nm下,每隔30 s测1次吸光值,连续记录3min,调节样液体积,使样液中连苯三酚的氧化速度控制在0.035(±0.002)D/min,并记录样液体积。
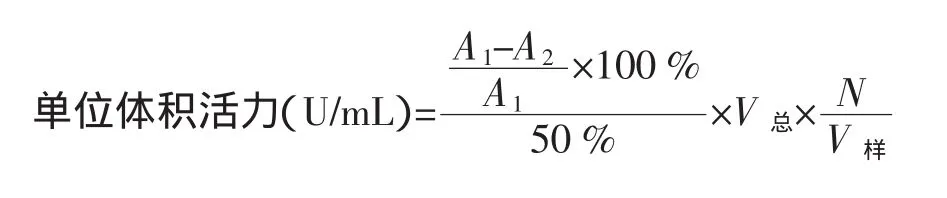
其中:A1为自氧化速率;A2为样液氧化速率;V总为反应液总体积;N为样液稀释倍数;V样为样液体积。
1.3.1.3 蛋白质含量的测定
采用紫外分光光度计法。
1.3.2 超氧化物歧化酶的提取与分离纯化
猪肝500 g,加入500 mL 1.2%KCl溶液后匀浆,离心15 min(10000 r/min),其上清液水浴升温至一定温度并保持固定时间,冷却,离心20 min(11000 r/min),弃去沉淀;在4℃下向上清液中加入冷丙酮,放置过夜;离心30min(13000r/min,4℃),弃上清液,沉淀即为SOD。
在对热变性时间、热变性温度、丙酮用量和提取的盐浓度等单因素进行探讨的基础上,采用正交设计方法以酶的比活力为指标对工艺参数进行优化。
粗提获得的SOD经Sephadex G-200进一步纯化。层析柱规格为Ф26×100(mm),洗脱液为0.05 mol/L NaCl,流速为 12 mL/h,每管收集 4 mL。
1.3.3 超氧化物歧化酶的检测与表征
1.3.3.1 SOD纯度及分子量测定
标准蛋白质和纯化得到的SOD在同一条件下进行SDS-PAGE,根据相对迁移率可直接在标准曲线上求出分子量,同时可以获得蛋白质纯度信息。
为进一步验证蛋白质是否达到单一组分的纯度,使用高效液相色谱对纯化得到的SOD进行检测。色谱条件:Zorbax SB-C18色谱柱(5 μm,4.6 mm×250 mm,Agilent,USA);流动相:pH 8.30 的 50 mmol/L K2HPO4-KH2PO4缓冲液(超纯水配制);流速:1.0 mL/min,紫外检测波长:254 nm,280 nm;柱温:30℃;进样量:500 μL。
1.3.3.2 紫外-可见光谱与电感耦合等离子体-原子发射光谱
1)紫外-可见光谱
纯SOD粉末溶于去离子水,在190 nm~700 nm范围内进行扫描,测定它的最大吸收波长。
2)金属离子测定及类别鉴定
在1.8 mg纯SOD(预先在50℃条件下干燥24 h)中加入10 mL 0.02 mol/L的Tris-HCl缓冲液(pH 7.0),所得酶液装入透析带(半透膜)在去离子水中透析至电导不再变化。处理后的样品用电感耦合等离子体-原子发射光谱仪测金属离子的种类和含量。
1.3.3.3 SOD的酶学性质
以邻苯三酚为底物,改变反应体系缓冲液的温度、pH,分别测定SOD的最佳反应温度和最佳pH,并通过双倒数法测定该酶的Km值和Vmax。
2 结果与讨论
2.1 超氧化物歧化酶的提取与分离纯化
2.1.1 超氧化物歧化酶提取条件的优化
在前期单因素试验结果的基础上,采用L9(34)设计来优化酶的提取与分类纯化条件,以SOD的比活力为衡量标准。试验结果见表1。
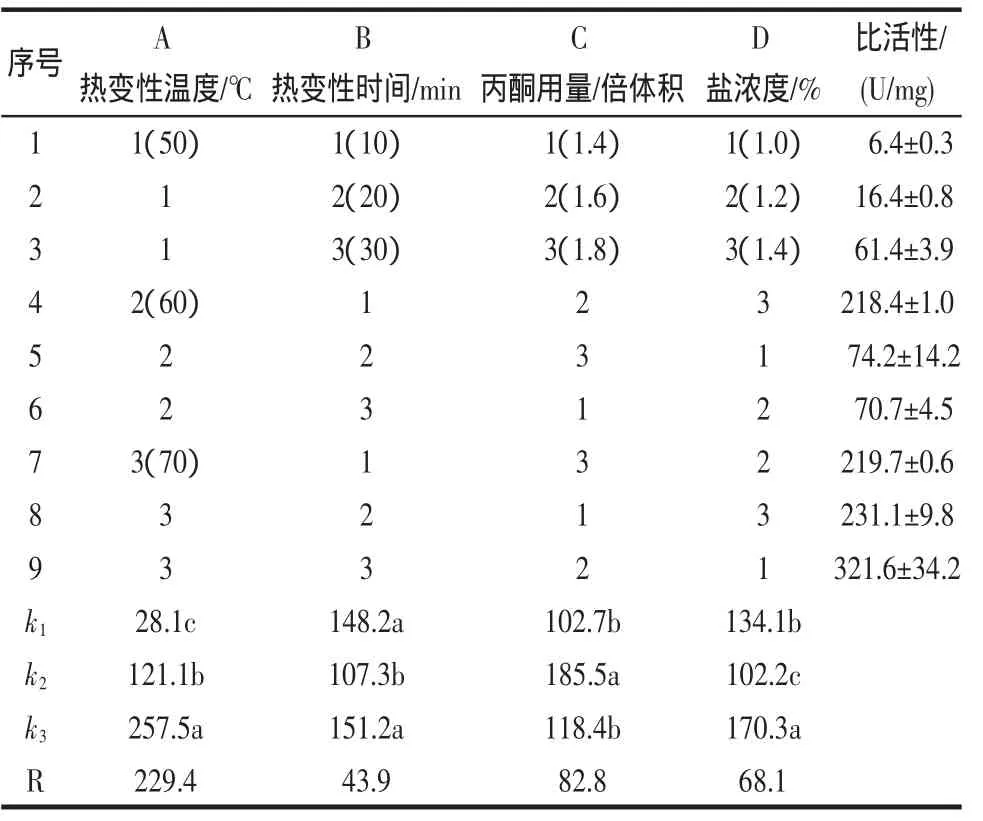
表1 正交试验表Table 1 Orthogonal test
对试验结果进行方差分析,结果如表2所示。
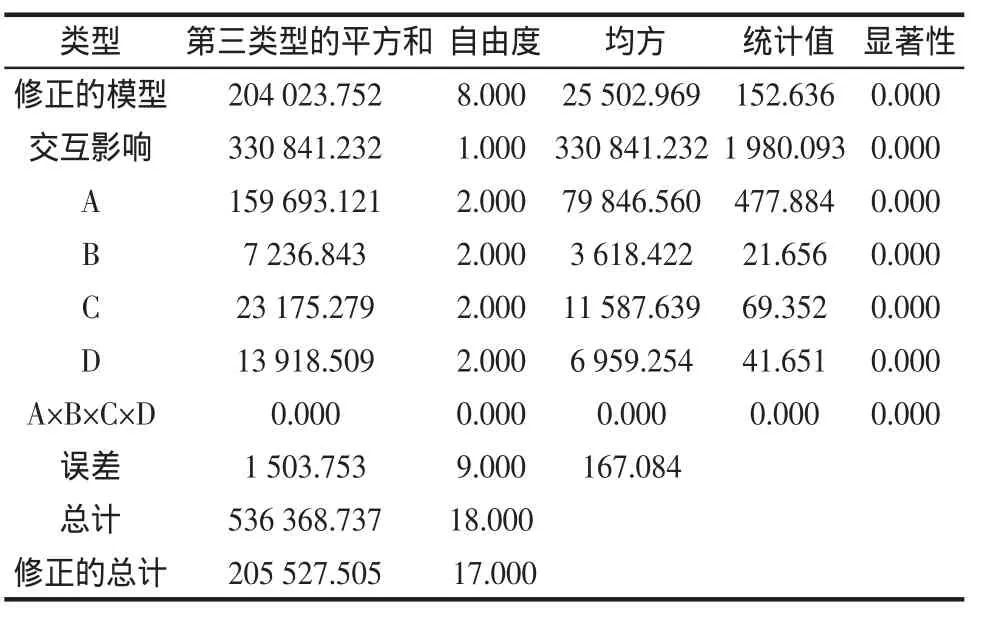
表2 方差分析表Table 2 Tests of Between-Subjects Effects
以上方差分析表明4个因素的P值均小于0.001,差异极显著,故对试验中的A、B、C、D四因素采用SN-K法进行多重比较,误差均方=167.1,调和样本容量=6.0,α=0.05,结果见表1所示。
由表1多重比较和极差R可知:因素的影响大小依次为:A>C>D>B。A因素的3个不同水平间差异均显著。试验中观察到,当热变性温度为50℃和60℃的时候,所沉淀的杂蛋白明显少于70℃时的量。而酶活测定则表明,热变性温度为70℃所得SOD的比活力及总活力均高于其他两组。故本试验中,SOD提取的热变性温度为70℃。
B因素为20 min的这一组与其他两组相比,差异显著;而热变性时间为10 min和30 min的这两组间,差异不显著。试验发现,SOD酶比活力随时间的延长呈现先减小后增大的趋势;30 min组的比活力虽大于10 min的组,但这两组从统计学上检验差异不显著,故从节能的角度考虑,选择热变性时间为10 min。
C因素为1.4和1.8这两组相比,差异不显著,但这两组与1.6倍体积的相比,差异均显著,且1.6组所得的SOD的比活力比其他两组均大。
丙酮用量对SOD的比活力的影响较大,SOD的比活力随着丙酮用量的增大,刚开始出现增加的趋势,但当丙酮用量超过1.6倍体积时,SOD的比活力却出现下降的趋势。从生物统计角度来讲,丙酮用量为1.6倍体积的这一组与其他两组结果差异显著。综合考虑节约成本和所得产品比活力,本实验丙酮用量为1.6倍体积。
D因素为1%,1.2%和1.4%这三组相比,差异均显著。试验发现,当盐浓度为1.4%的时候,所得到的SOD的比活力高于其他两组。同时,从统计学的角度来说,盐浓度为1.4%的这一组与其他两组结果差异显著。所以,在本试验的范围内,SOD提取的最佳盐浓度为1.4%。
故本试验方案的最佳组合为A3B1C2D3。即:热变性温度为70℃,热变性时间为10 min,丙酮用量为1.6倍体积,盐浓度为1.4%。
2.1.2 SOD的纯化、纯度鉴定与分子量测定
2.1.2.1 SOD的纯化
粗提获得的SOD经Sephadex G-200柱层析纯化,其收集液逐管测定酶活和波长280 nm处吸光度。以吸光度为纵坐标、以管数为横坐标作图,结果见图1。
图1显示,共有4个蛋白峰。酶活测定结果显示,第3个峰显示SOD酶活性。
2.1.2.2 SOD中金属离子种类与含量
紫外-可见光谱结果显示猪肝SOD的紫外最大吸收波长为255nm(见图2),而不是一般蛋白的280 nm,这表明该酶为Cu,Zn-SOD,因为Cu,Zn-SOD的明显特征为最大紫外吸收在250 nm~270 nm,与文献报道的茶叶、鸭血中的Cu,Zn-SOD最大紫外吸收波长在265.4 nm和258 nm相符。
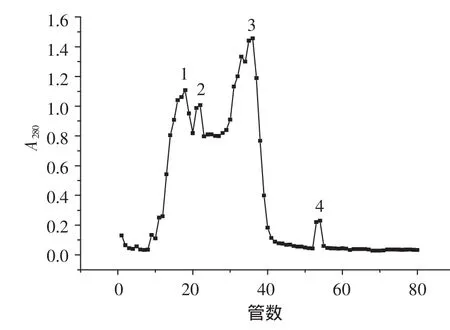
图1 Sephadex G-200色谱分离Fig.1 Chromatography of Sephadex G-200
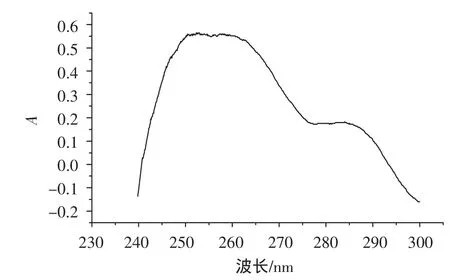
图2 SOD紫外吸收光谱Fig.2 UV Spectra of the purified SOD from liver
ICP-MS分析结果进一步证实,分离纯化得到的SOD含铜锌元素,且铜离子、锌离子、蛋白质分子的比例为 1∶1∶1。
2.1.2.3 SOD分子量的测定
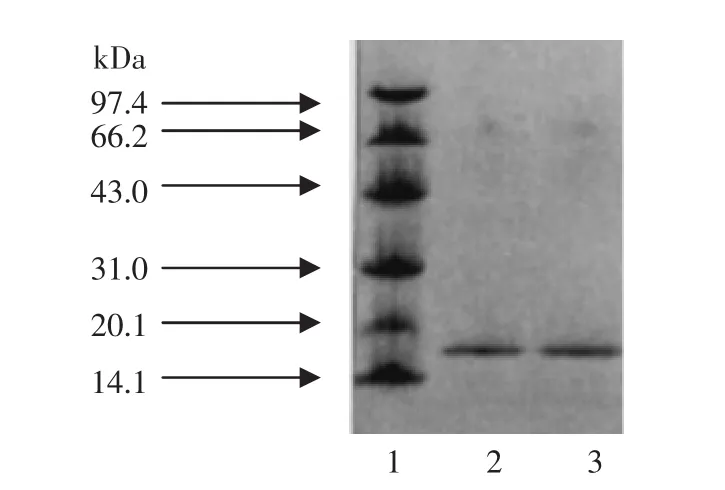
图3 Cu,Zn-SOD的SDS-PAGE电泳Fig.3 SDS-PAGE of Cu,Zn-SOD from liver
纯化的样品经SDS-PAGE电泳、染色后为一条电泳带,说明纯化后的SOD酶为均一蛋白质。根据标准蛋白SDS-PAGE电泳结果作对数分子量相对迁移率曲线,计算得该Cu,Zn-SOD酶的对数分子量为32 ku,而Cu,Zn-SOD酶是由2个相同亚基组成[15-16],单一条带的分子量约为16 ku。这一试验结果与苏昕[16]等报道酵母SOD结果相吻合。
纯化得到的SOD液相色谱检测结果见图4。

图4 SOD的HPLC谱图Fig.4 HPLC chromatogram of SOD from liver
由图4可见,SOD的HPLC谱图出现了单一的对称峰,图中横坐标为流动相的体积,流动相的流速为1 mL/min。可以看出,该酶的纯度较高。由此可见,HPLC与SDS-PAGE的结果是吻合的。
2.2 SOD的酶学和理化性质
2.2.1 温度对SOD活力的影响
温度对SOD酶活性的影响见图5。
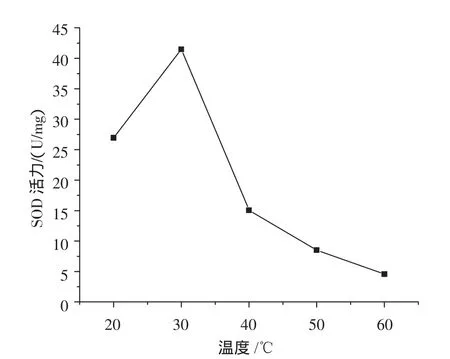
图5 温度对SOD活力的影响Fig.5 Effect of temperature on the activity of SOD
由图5可以看出,30℃以下时,SOD的活力随温度的升高而增高,30℃时,SOD的活力最高,当温度超过30℃后,SOD的活力随着温度的升高迅速下降,降幅较大(p<0.01)。相关学者[17]从烟草中分离纯化得到SOD的3种同功酶,其中Cu-Zn-SODⅠ的最适温度为30℃,Cu-Zn-SODⅢ的最适温度约为40℃。
2.2.2 pH对SOD活力的影响
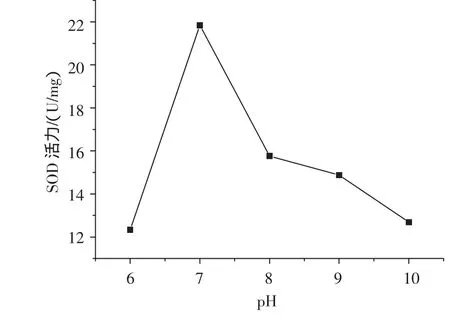
图6 pH对SOD活力的影响Fig.6 Effect of pH on the activity of SOD
pH对SOD活力的影响见图6。可以看出,pH对SOD活性的影响较大,pH7.3以下时,SOD活力较低,随着pH的升高,SOD活力逐渐增高,且增幅较大,pH7.3时活力最高;当pH超过7.3后,SOD活力随着pH的升高又迅速降低。在pH 6.5~9.0的范围内,SOD具有较高的活力,表明SOD的最适pH范围是pH 6.5~9.0。刘剑利[18]等报道利用金属螯合亲和层析法纯化的玉米SOD的pH稳定范围是pH6~10之间,与本研究结果相吻合。
2.2.3 SOD Km值和Vmax的测定
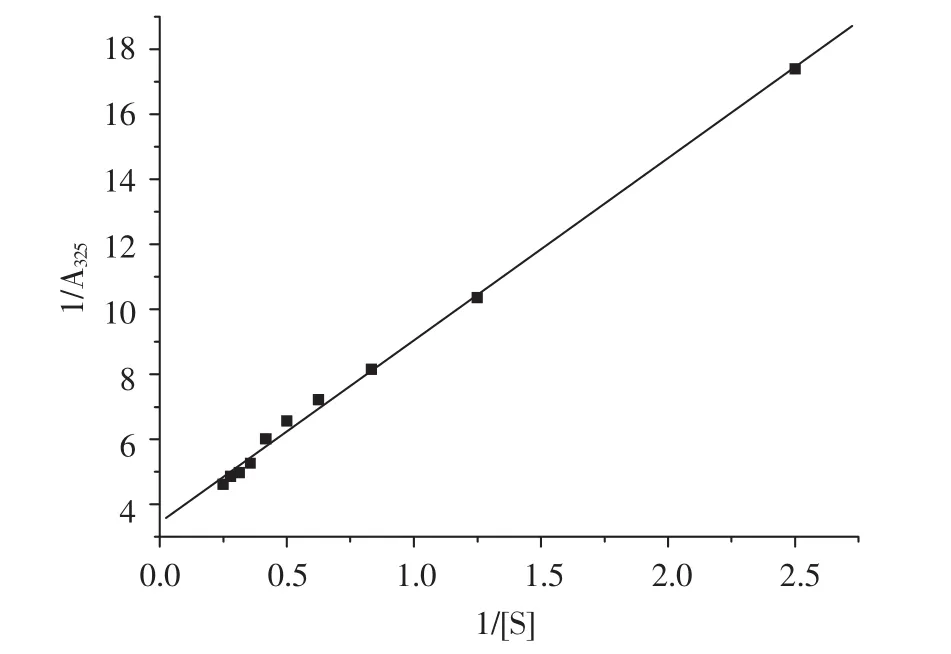
图7 双倒数作图曲线Fig.7 Lineweaver-Burk
使用双倒数作图法,以1/[S]为横坐标,1/△A325为纵坐标使用Origin进行作图,得到一条直线,直线与X轴的截距为1/Km,与Y轴的截距为1/Vmax,从而得到Km=1.574、Vmax=0.268。
3 结论
1)以猪肝为原料,通过抽提液加热、丙酮沉淀和Sephadex G-200层析柱色谱提取、纯化,可以得到单一组分的 Cu,Zn-SOD。
2)最佳的提取条件是:在1.4%的盐浓度下,于70℃水浴中热变性10 min,然后加1.6倍体积的丙酮获得SOD粗沉淀。
3)紫外-可见吸收光谱和ICP-MS分析结果均表明得到的是含铜、锌的SOD,即Cu,Zn-SOD,且铜离子、锌离子、蛋白质分子的比例为 1∶1∶1。
4)猪血Cu,Zn-SOD分子量为32 ku,由2个相同亚基组成,单一条带的分子量约为16 ku。
5)猪血 Cu,Zn-SOD 最适为 pH7.3,最适温度为30℃。
6)以邻苯三酚为底物,该酶的Km值为1.574,Vmax为0.268。
[1]McCord J M,Fridoxich I.Superoxide dismutase[J].J Biol Chem,1969,244(22):6049
[2]田春美,钟秋平.超氧化物歧化酶的现状研究进展[J].中国热带医学,2005,5(8):1730-1731
[3]蒋雪薇,吴学玲.超氧化物歧化酶及其在生命科学中的作用[J].怀化师专学报,2000,19(2):63-65
[4]迟玉杰,王明丽,孙艳红.SOD对人体的营养保健作用[J].中国乳品工业,2000,28(4):27-29
[5]ZHOU Jiangyan,PROGNON P.Raw material enzymatic activity determination:A specific case for validation and comparison of analytical methods-The example of super oxide dismutase(SOD)[J].Journal of pharmaceutical and biomedical analysis,2006,40(5):1143-1148
[6]李敬玺,刘继兰,王选年,等.超氧化物歧化酶研究和应用进展[J].动物医学进展,2007,28(7):70-75
[7]冯启浩.奶品中超氧化物歧化酶的检测[J].食品科学,1994(6):15-16
[8]冯启浩.中国乳品工业[M].北京:乳品工业信息中心出版社,1993:27
[9]陈艺虹,张志群,王兰,等.猪血Cu,Zn-SOD的分离纯化[J].微生物学杂志,2004,24(2):58-59
[10]李豪,车振明.猪血超氧化物歧化酶的纯化研究[J].食品工业科技,2006,27(3):156-159
[11]李敏康,钱冬明,宋宏新.猪血SOD提取条件的研究[J].陕西科技大学学报,2007,25(3):53-55
[12]王钦德.食品试验设计与统计分析[M].北京:中国农业出版社,2003:330-366
[13]张文彤,闫洁.SPSS统计分析基础教程[M].北京:高等教育出版社,2004:71-90
[14]张文彤.SPSS统计分析高级教程[M].北京:高等教育出版社,2004:114-157
[15]章慧慧,励建荣.超氧化物岐化酶的研究和应用现状[J].农产品加工(学刊),2007,109(8):28-31
[16]苏昕,阎浩林,梁丽莉.酵母SOD分离纯化及其酶学性质的研究[J].沈阳药科大学学报,2005,22(1):67-70
[17]盛良全.烟草铜锌超氧化物岐化酶同功酶的分离纯化、结构性质及功能研究[D].中国科技大学博士学位论文,2003:1-116
[18]刘剑利,孟鑫,张强,等.金属螯合亲和层析法纯化玉米SOD及其酶学性质的研究[J].粮食与饲料工业,2005(10):25-27

